高考二轮复习知识点:元素周期律和元素周期表的综合应用4
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. LDFCB是锂离子电池常用的一种离子导体,其阴离子由同周期元素原子W、X、Y、Z构成,结构如图。基态Y原子的s轨道与p轨道电子数相等,Z的核外电子总数是W的最外层电子数的3倍。下列说法正确的是( )
 A、同周期元素第一电离能小于Y的有5种 B、简单氢化物的沸点:Z>Y>X C、W的最高价氧化物对应的水化物具有两性 D、W和Z可形成含有极性共价键的非极性分子2. 前20号主族元素W、X、Y、Z位于不同周期且原子序数依次增大,W的单质在Y的单质中可以安静地燃烧,火焰为苍白色,且伴有白雾生成;W、X、Y元素原子的最外层电子数之和为13,W与Z的族序数相邻。下列说法错误的是( )A、常温下,X的单质为气体 B、W与Z形成的化合物中可能含有共价键 C、W、X和Y三种元素可以形成离子化合物 D、简单离子半径:Y>Z>W3. 物质A可用作抗氧化增效剂等,其结构式如图所示。物质A的组成元素X、Y、Z、Q为原子序数依次增大的短周期主族元素,且Y的一种单质是天然存在的最硬的物质。下列说法错误的是( )
A、同周期元素第一电离能小于Y的有5种 B、简单氢化物的沸点:Z>Y>X C、W的最高价氧化物对应的水化物具有两性 D、W和Z可形成含有极性共价键的非极性分子2. 前20号主族元素W、X、Y、Z位于不同周期且原子序数依次增大,W的单质在Y的单质中可以安静地燃烧,火焰为苍白色,且伴有白雾生成;W、X、Y元素原子的最外层电子数之和为13,W与Z的族序数相邻。下列说法错误的是( )A、常温下,X的单质为气体 B、W与Z形成的化合物中可能含有共价键 C、W、X和Y三种元素可以形成离子化合物 D、简单离子半径:Y>Z>W3. 物质A可用作抗氧化增效剂等,其结构式如图所示。物质A的组成元素X、Y、Z、Q为原子序数依次增大的短周期主族元素,且Y的一种单质是天然存在的最硬的物质。下列说法错误的是( ) A、物质A与稀硫酸反应生成的有机物能发生缩聚反应 B、X、Y、Z、Q四种元素原子半径的大小顺序为 C、Y与Z分别形成的简单氢化物的沸点: D、Q、Z两种元素形成的化合物中可能存在共价键4. 短周期主族元素W、X、Y、Z的原子序数依次增大,W与X同周期且相邻,W、Y的最外层电子数之和与Z的最外层电子数相等,Z的单质与X的氢化物可发生置换反应,常温下Y的单质在浓硫酸中能形成致密氧化膜。下列说法一定正确的是( )A、最简单氢化物的沸点: W<X B、Y与Z形成离子化合物 C、W的氧化物是酸性氧化物 D、简单离子的半径: X<Y5. 一种麻醉剂的分子结构式如图所示。其中,X元素是宇宙中含量最多的元素;元素Y、Z、W原子序数依次增大,且都与X处于相邻周期;主族元素E的原子序数比W多8。下列说法错误的是( )
A、物质A与稀硫酸反应生成的有机物能发生缩聚反应 B、X、Y、Z、Q四种元素原子半径的大小顺序为 C、Y与Z分别形成的简单氢化物的沸点: D、Q、Z两种元素形成的化合物中可能存在共价键4. 短周期主族元素W、X、Y、Z的原子序数依次增大,W与X同周期且相邻,W、Y的最外层电子数之和与Z的最外层电子数相等,Z的单质与X的氢化物可发生置换反应,常温下Y的单质在浓硫酸中能形成致密氧化膜。下列说法一定正确的是( )A、最简单氢化物的沸点: W<X B、Y与Z形成离子化合物 C、W的氧化物是酸性氧化物 D、简单离子的半径: X<Y5. 一种麻醉剂的分子结构式如图所示。其中,X元素是宇宙中含量最多的元素;元素Y、Z、W原子序数依次增大,且都与X处于相邻周期;主族元素E的原子序数比W多8。下列说法错误的是( ) A、第一电离能: B、原子半径: C、气态氢化物的稳定性: D、分子中含有极性共价键和非极性共价键6. 短周期主族元素W、X、Y、Z可形成结构如下的物质,该物质中所有原子均满足稳定结构。四种元素中W的原子序数最大,W、Y、Z均不与X同周期。下列说法错误的是( )
A、第一电离能: B、原子半径: C、气态氢化物的稳定性: D、分子中含有极性共价键和非极性共价键6. 短周期主族元素W、X、Y、Z可形成结构如下的物质,该物质中所有原子均满足稳定结构。四种元素中W的原子序数最大,W、Y、Z均不与X同周期。下列说法错误的是( ) A、Y的最高价氧化物对应的水化物是弱酸 B、X、Z可形成具有强氧化性的化合物 C、由Z和W形成的化合物中可以存在共价键 D、W、X、Y、Z的原子半径从大到小为W>Z>Y>X7. X、Y、Z、W为原子序数依次增大的短周期主族元素,Y、W同族,常温下Z的单质遇Y的最高价氧化物对应水化物的浓溶液会发生钝化反应,由X、Y、Z三种原子构成的一种特殊离子化合物如图所示,下列说法正确的是( )
A、Y的最高价氧化物对应的水化物是弱酸 B、X、Z可形成具有强氧化性的化合物 C、由Z和W形成的化合物中可以存在共价键 D、W、X、Y、Z的原子半径从大到小为W>Z>Y>X7. X、Y、Z、W为原子序数依次增大的短周期主族元素,Y、W同族,常温下Z的单质遇Y的最高价氧化物对应水化物的浓溶液会发生钝化反应,由X、Y、Z三种原子构成的一种特殊离子化合物如图所示,下列说法正确的是( ) A、在元素周期表中,111号元素与Z元素同族 B、Y的非金属性比W的强,所以单质的还原性:Y>W C、X、Y形成的二元化合物只含有极性共价键 D、X、Z、Y、W四种元素的简单离子半径依次增大8. 短周期元素X、Y、Z、W原子序数依次增大。常温下,四种元素最高价氧化物对应水化物均能形成浓度为的溶液,它们的分布如下图所示。下列说法正确的是( )
A、在元素周期表中,111号元素与Z元素同族 B、Y的非金属性比W的强,所以单质的还原性:Y>W C、X、Y形成的二元化合物只含有极性共价键 D、X、Z、Y、W四种元素的简单离子半径依次增大8. 短周期元素X、Y、Z、W原子序数依次增大。常温下,四种元素最高价氧化物对应水化物均能形成浓度为的溶液,它们的分布如下图所示。下列说法正确的是( ) A、X与W可能位于同一主族 B、最外层未成对电子数: C、四种元素的简单离子中Y的半径最小 D、四种元素的最高价氧化物对应水化物中Z的酸性最强9. 已知表是几种常见元素的原子半径数据:
A、X与W可能位于同一主族 B、最外层未成对电子数: C、四种元素的简单离子中Y的半径最小 D、四种元素的最高价氧化物对应水化物中Z的酸性最强9. 已知表是几种常见元素的原子半径数据:元素
C
O
Na
Mg
Si
原子半径/nm
0.077
0.073
0.154
0.130
0.111
下列说法正确的是( )
A、随着核电荷数的增加,原子半径逐渐增大 B、元素F的原子半径在0.073~0.154 nm之间 C、最外层电子数相同的元素,电子层数越多,原子半径越大 D、Mg2+的半径大于Mg的半径10. 已知X、Y、Z、W是同一短周期主族元素。单质具有强氧化性,可用于杀菌消毒。四种元素与锂离子组成的盐是一种新型的锂离子电池的电解质,结构如图所示(“→”表示配位键)。下列说法正确的是( ) A、原子半径:X>Y>Z>W B、Y的最高价氧化物的水化物为强酸 C、单质氧化性: D、阴离子中四种元素的原子均满足8电子稳定结构11. X、Y 、Z、M是四种短周期主族元素,它们组成一种团簇分子X2Z2Y4(YM)2 , 其结构如图所示(球的大小表示原子半径的相对大小)。其中X与Y原子核外电子总数之比为3:2,M的原子序数小于Y,Z是一种金属元素。下列说法错误的是( )
A、原子半径:X>Y>Z>W B、Y的最高价氧化物的水化物为强酸 C、单质氧化性: D、阴离子中四种元素的原子均满足8电子稳定结构11. X、Y 、Z、M是四种短周期主族元素,它们组成一种团簇分子X2Z2Y4(YM)2 , 其结构如图所示(球的大小表示原子半径的相对大小)。其中X与Y原子核外电子总数之比为3:2,M的原子序数小于Y,Z是一种金属元素。下列说法错误的是( ) A、简单离子半径:X>Z> Y> M B、最高价氧化物对应水化物的碱性:X>Z C、Y和M形成的化合物可能含有非极性键 D、可通过电解Y、Z形成的化合物的熔融态制备Z单质12. 五种短周期元素X、Y、Z、W、M的原子序数依次增大且位于不同的主族,Y的最外层电子数是次外层的2倍,M的原子序数等于Y和W的原子序数之和,只有Y、Z、W同周期。下列说法错误的是( )A、简单离子半径: B、X、Y、W三种元素可形成多种化合物 C、M的最高价氧化物对应的水化物为强酸 D、Y、Z、M均可与X形成电子数相等的分子13. 一种治疗皮肤黏膜炎症的药物的脱水产物结构如图所示,W、X、Y、Z是原子序数依次增大的短周期元素,下列说法错误的是( )
A、简单离子半径:X>Z> Y> M B、最高价氧化物对应水化物的碱性:X>Z C、Y和M形成的化合物可能含有非极性键 D、可通过电解Y、Z形成的化合物的熔融态制备Z单质12. 五种短周期元素X、Y、Z、W、M的原子序数依次增大且位于不同的主族,Y的最外层电子数是次外层的2倍,M的原子序数等于Y和W的原子序数之和,只有Y、Z、W同周期。下列说法错误的是( )A、简单离子半径: B、X、Y、W三种元素可形成多种化合物 C、M的最高价氧化物对应的水化物为强酸 D、Y、Z、M均可与X形成电子数相等的分子13. 一种治疗皮肤黏膜炎症的药物的脱水产物结构如图所示,W、X、Y、Z是原子序数依次增大的短周期元素,下列说法错误的是( ) A、简单离子半径:Z< Y B、W与Y形成的化合物分子间有氢键,沸点高 C、W3XY3分子的中心原子X满足8电子稳定结构 D、W和乙形成的化合物只含有离子键,且可与水反应生成气体14. 某化合物的结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,原子序数W+Z=X+Y, W与X的原子序数之和等于Y的族序数。下列说法正确的是( )
A、简单离子半径:Z< Y B、W与Y形成的化合物分子间有氢键,沸点高 C、W3XY3分子的中心原子X满足8电子稳定结构 D、W和乙形成的化合物只含有离子键,且可与水反应生成气体14. 某化合物的结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,原子序数W+Z=X+Y, W与X的原子序数之和等于Y的族序数。下列说法正确的是( ) A、原子半径: W<X<Y<Z B、X的最高价含氧酸为弱酸 C、W和Y形成的化合物中只含有极性键 D、Z元素的焰色反应的焰色为白色15. a、b、c、d四种短周期主族元素,a、b元素形成的一种化合物e可用作潜水运动员的供氧剂,c的原子序数是b的两倍,a、c、d三元素的最高价氧化物的水化物两两间能发生反应,下列说法正确的是( )A、e中含有极性键 B、简单离子半径:r(c)>r(a)>r(d)>r(b) C、简单氢化物稳定性:c> b D、工业上电解b、d形成的化合物制单质d16. 短周期主族元素W、X、Y、Z的原子序数依次增大,其中W、Y、Z组成的化合物M遇稀硫酸得到Z的单质及其氧化物,M的结构如图所示。下列有关说法错误的是( )
A、原子半径: W<X<Y<Z B、X的最高价含氧酸为弱酸 C、W和Y形成的化合物中只含有极性键 D、Z元素的焰色反应的焰色为白色15. a、b、c、d四种短周期主族元素,a、b元素形成的一种化合物e可用作潜水运动员的供氧剂,c的原子序数是b的两倍,a、c、d三元素的最高价氧化物的水化物两两间能发生反应,下列说法正确的是( )A、e中含有极性键 B、简单离子半径:r(c)>r(a)>r(d)>r(b) C、简单氢化物稳定性:c> b D、工业上电解b、d形成的化合物制单质d16. 短周期主族元素W、X、Y、Z的原子序数依次增大,其中W、Y、Z组成的化合物M遇稀硫酸得到Z的单质及其氧化物,M的结构如图所示。下列有关说法错误的是( ) A、简单气态氢化物的稳定性: B、M中W原子满足8电子稳定结构 C、化合物M与稀硫酸反应均可用于研究温度、压强、浓度等对反应速率的影响 D、Y分别与W、Z形成的二元化合物中可能均含有共价键17. W、X、Y、Z为原子序数依次增大的短周期主族元素,W元素可形成密度最小的气体单质; W和Y的最外层电子数相同,可形成离子化合物YW;常温下0.01mol·L-1 X、Z的最高价氧化物对应的水化物溶液的pH值均为2,下列叙述错误的是( )A、原子半径:Y>Z> W B、X、Z分别与W形成的简单化合物相遇会产生白烟 C、XZ3分子中,所有原子的最外层均满足8电子稳定结构 D、W、X和Z形成的化合物中只含有共价键18. 六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E同主族,B与F同主族,E与F同周期。已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数2倍,单质F是一种重要的半导体材料。则下列推断中正确的是( )A、由A,C,D三种元素组成的化合物一定是共价化合物 B、F与D形成的化合物性质很不活泼,不与任何酸反应 C、原子半径由大到小的顺序是:E>F>C>D D、元素的非金属性由强到弱的顺序是:D>C>F>B19. X、Y、Z、R、M为原子序数依次增大的五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( )
A、简单气态氢化物的稳定性: B、M中W原子满足8电子稳定结构 C、化合物M与稀硫酸反应均可用于研究温度、压强、浓度等对反应速率的影响 D、Y分别与W、Z形成的二元化合物中可能均含有共价键17. W、X、Y、Z为原子序数依次增大的短周期主族元素,W元素可形成密度最小的气体单质; W和Y的最外层电子数相同,可形成离子化合物YW;常温下0.01mol·L-1 X、Z的最高价氧化物对应的水化物溶液的pH值均为2,下列叙述错误的是( )A、原子半径:Y>Z> W B、X、Z分别与W形成的简单化合物相遇会产生白烟 C、XZ3分子中,所有原子的最外层均满足8电子稳定结构 D、W、X和Z形成的化合物中只含有共价键18. 六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E同主族,B与F同主族,E与F同周期。已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数2倍,单质F是一种重要的半导体材料。则下列推断中正确的是( )A、由A,C,D三种元素组成的化合物一定是共价化合物 B、F与D形成的化合物性质很不活泼,不与任何酸反应 C、原子半径由大到小的顺序是:E>F>C>D D、元素的非金属性由强到弱的顺序是:D>C>F>B19. X、Y、Z、R、M为原子序数依次增大的五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( ) A、Y、Z、M属于同一周期,非金属性依次增强 B、Z、M的氧化物对应水化物均为强酸 C、X、M形成的化合物具有还原性,水溶液呈酸性 D、X与其他四种元素都能形成共价键20. 短周期元素X、Y、Z、M、R 的原子半径和最外层电子数之间的关系如图所示。下列说法错误的是( )
A、Y、Z、M属于同一周期,非金属性依次增强 B、Z、M的氧化物对应水化物均为强酸 C、X、M形成的化合物具有还原性,水溶液呈酸性 D、X与其他四种元素都能形成共价键20. 短周期元素X、Y、Z、M、R 的原子半径和最外层电子数之间的关系如图所示。下列说法错误的是( ) A、R一定能与水反应 B、Y和M在自然界均有单质存在 C、X、Y形成的化合物都可以燃烧 D、Z、X形成的气体可使湿润的蓝色石蕊试纸变红
A、R一定能与水反应 B、Y和M在自然界均有单质存在 C、X、Y形成的化合物都可以燃烧 D、Z、X形成的气体可使湿润的蓝色石蕊试纸变红二、多选题
-
21. 短周期元素X、Y、Z、W、Q在周期表中相对位置如图,其中元素X是地壳中含量最高的元素,下列说法正确的是( )
X
Y
Z
W
Q
A、阴离子的还原性:W2﹣<Q﹣<Y﹣ B、常温下,X2与W的单质间化合反应不能自发进行 C、ZX2是两性氧化物 D、Y的氢化物可用来篆刻玻璃22. (多选)X,Y,Z,W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数为20.下列判断正确的是( )W
X
Y
Z
A、Z,X,Y形成的气态氢化物稳定性依次增强 B、四种元素形成的单质最多有6种 C、四种元素的原子半径:rZ>rY>rX>rW D、四种元素中,X的氧化物对应的水化物酸性最强三、非选择题
-
23. X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同.回答下列问题:(1)、X、Y和Z的元素符号分别为、、 .(2)、由上述元素组成的化合物中,既含有共价键又含有离子键的有、 .(3)、X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的物质的电子式为此化合物在酸性条件下与高锰酸钾反应的离子方程式为;此化合物还可将碱性工业废水中的CN﹣氧化为碳酸盐和氨,相应的离子方程式为 .24. [选修3--物质结构与性质]M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子.元素Y的负一价离子的最外层电子数与次外层的相同.回答下列问题:(1)、单质M的晶体类型为 , 晶体中原子间通过作用形成面心立方密堆积,其中M原子的配位数为 .(2)、元素Y基态原子的核外电子排布式为 , 其同周期元素中,第一电离能最大的是(写元素符号).元素Y的含氧酸中,酸性最强的是(写化学式),该酸根离子的立体构型为 .(3)、M与Y形成的一种化合物的立方晶胞如图所示.

①该化合物的化学式为 , 已知晶胞参数a=0.542nm,此晶体的密度为g•cm﹣3 . (写出计算式,不要求计算结果.阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是 . 此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为 .
25. 短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)、M元素位于周期表中的第周期、族.(2)、Z元素是 , 其在自然界中常见的二元化合物是 .(3)、X与M的单质在高温下反应的化学方程式为 , 产物分子为直线形,其化学键属共价键(填“极性”或“非极性”).(4)、四种元素中的可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为 .26. 某盐的组成可表示为3[H3ON5]:3[NH4N3]·NH4Cl。回答下列问题(1)、氯原子的电子排布式为.(2)、元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是;氮元素的E1呈现异常的原因是。(3)、经X射线衍射测得化合物3[H3ON5]·3NH4N5]·NH4Cl的晶体结构,其局部结构如图(b)所示
①H3O+中心原子的杂化类型为 , NH4+的空间构型为。
②3[H3ON5]·3[NH4N5]·NH4Cl中阴离子N5-中的 键总数为个。分子中的大 键可用符号 表示,其中m代表参与形成大键的原子数,n代表参与形成大键的电子数(如苯分子中的大 键可表示为 ),则N5-中的大 键应表示为。
③图(b)中虚线代表氢键,其中表示式为(NH4)N一H……Cl、、。
(4)、3[H3ON5]·3[NH4N5]·NH4Cl的晶体密度为dg.cm-3 , 其立方晶胞参数为a nm,晶胞中含有y个3[H3ON5]·3[NH4N5]·NH4Cl单元,该单元的相对质量为M,则y的计算表达式为.27. a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。A
原子核外电子分占3个不同能级,且每个能级上排布的电子数相同
B
基态原子的p轨道电子数比s轨道电子数少1
C
位于第2周期,原子核外有3对成对电子、两个未成对电子
d
位于周期表中第7纵列
e
基态原子M层全充满,N层只有一个电子
请回答:
(1)、c属于区的元素,其基态原子的电子排布图为。(2)、b与其同周期相邻元素第一电离能由大到小的顺序为(用元素符号表示)。(3)、元素b 的氢化物的水溶液中存在的氢键有种;画出一种存在于b 的氢化物与水分子之间的氢键。(4)、a与其同主族短周期元素的最高价氧化物的熔点高低顺序为(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的中心原子的轨道杂化类型为 , A的空间构型为;(5)、a元素与b元素可形成ab-阴离子,则与ab-互为等电了体的单质及化合物的化学式分别为、(各填写一种)。(6)、在e2+离子的水溶液中逐滴滴加b的氢化物水溶液至过量,可观察到的现象为。(7)、d 的某氧化物晶体结构如图。每个阴离子周围等距离且最远的阴离子数为 , 其晶胞的棱长为xcm,则该晶体距离最近的两个阴离了的核间距为cm (用含有x 的代数式表示)。 28. 开发新型储氢材料是氢能源利用的重要研究方向之一。请回答以下问题:(1)、Ti(BH4)3是一种储氢材料, 可由TiCl4和LiBH4反应制得。
28. 开发新型储氢材料是氢能源利用的重要研究方向之一。请回答以下问题:(1)、Ti(BH4)3是一种储氢材料, 可由TiCl4和LiBH4反应制得。①基态Ti3+的电子排布式为;LiBH4中Li、B、H 元素的电负性由大到小的排列顺序为。
②另有一种含钛元素的新型材料,其理论结构模型如图所示,图中虚线框内碳原子的杂化轨道类型为。
 (2)、氨硼烷(NH3BH3)是优良的储氢材料,少量氨硼烷可以由硼烷(B2H6)和NH3合成。
(2)、氨硼烷(NH3BH3)是优良的储氢材料,少量氨硼烷可以由硼烷(B2H6)和NH3合成。①NH3BH3中是否存在配位键(填“是”或“否”);与NH3BH3互为等电子体的分子的化学式为。
②B、C、N 与O元素的第一电离能由大到小的顺序为。
③氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石。则立方氮化硼晶体可用作(选填下列字母序号)。
a.切削工具
b.钻探钻头
c.导电材料
d.耐磨材料
(3)、一种有储氢功能的铜合金晶体具有面心立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。①若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为;
②铜与其它许多金属及其化合物都可以发生焰色反应,其原因是。
(4)、金属氢化物也是具有良好发展前景的储氢材料。某储氢材料是短周期金属元素R的氢化物。R的部分电离能如下表所示:I1/KJ·mol-1
I2/KJ·mol-1
I3/KJ·mol-1
I4/KJ·mol-1
I5/KJ·mol-1
738
1451
7733
10540
13630
①该金属元素是(填元素符号)..
②若氢化物的晶胞结构如图所示(有4 个H原子位于面上,其余H原子位于晶胞内),已知该晶体的密度为ρg·cm-3 , 则该晶胞的体积为cm3[用含ρ、NA的代数式表示(其中NA为阿伏加德罗常数的值)]。
 29. TiO2是一种性能优良的半导体光催化剂,能有效地吸附有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质。(1)、Ti基态核外电子排布式为。(2)、甲醛HCHO分子空间构型为;分子中碳原子轨道杂化类型为 , π键和σ键的个数之比为 ,(3)、氨气极易溶于水,是因为氨和水的分子均是 , 还因为。(4)、甲苯分子中能够共平面的原子最多为个;苯环不易被卤素加成,而比较容易被卤素取代苯环上的氢,原因是。(5)、含CN-的污水毒性极大,用NaClO先把CN-氧化为CNO- , 然后在酸性条件下再将CNO-氧化为无污染的气体。请写出与CNO-互为等电子体的微粒分子或离子,写一种)。(6)、Ti[(CN)4]2-中Ti2+与CN-的C原子形成配位键。不考虑空间构型,Ti[(CN)4]2-的结构可表示为。(7)、Ti的某氧化物和CaO相互作用能形成钛酸盐的晶胞结构如图所示(Ti4+位于立方体的顶点,Ca2+ 处于立方体的中心)。该晶体中,Ti4+和周围 个O2-相紧邻;若该晶胞的密度为dg/cm3则钛氧键的键长为pm (用带NA的代数式表示)。
29. TiO2是一种性能优良的半导体光催化剂,能有效地吸附有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质。(1)、Ti基态核外电子排布式为。(2)、甲醛HCHO分子空间构型为;分子中碳原子轨道杂化类型为 , π键和σ键的个数之比为 ,(3)、氨气极易溶于水,是因为氨和水的分子均是 , 还因为。(4)、甲苯分子中能够共平面的原子最多为个;苯环不易被卤素加成,而比较容易被卤素取代苯环上的氢,原因是。(5)、含CN-的污水毒性极大,用NaClO先把CN-氧化为CNO- , 然后在酸性条件下再将CNO-氧化为无污染的气体。请写出与CNO-互为等电子体的微粒分子或离子,写一种)。(6)、Ti[(CN)4]2-中Ti2+与CN-的C原子形成配位键。不考虑空间构型,Ti[(CN)4]2-的结构可表示为。(7)、Ti的某氧化物和CaO相互作用能形成钛酸盐的晶胞结构如图所示(Ti4+位于立方体的顶点,Ca2+ 处于立方体的中心)。该晶体中,Ti4+和周围 个O2-相紧邻;若该晶胞的密度为dg/cm3则钛氧键的键长为pm (用带NA的代数式表示)。 30. X、Y、Z、W是短周期元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一 半,Y、Z、W原子的最外层电子数之和为14。(1)、XW4的空间构型为 , HWO的结构式为 , Z在元素周期表中的位置是。(2)、①X、Y、Z、W原子半径由大到小依次是(填元素符号)。
30. X、Y、Z、W是短周期元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一 半,Y、Z、W原子的最外层电子数之和为14。(1)、XW4的空间构型为 , HWO的结构式为 , Z在元素周期表中的位置是。(2)、①X、Y、Z、W原子半径由大到小依次是(填元素符号)。②X、Z、W最高价氧化物水化物酸性由强到弱依次是。(填化学式)。
(3)、W同族上一周期元素单质不能把W元素从其钠盐的水溶液中置换出来,用化学方程式解释。(4)、①家用“管道通”的有效成分是烧碱和Y的单质,使用时需加入一定量的水,此时发生反应的化学方程式为。②含Y元素的盐与小苏打溶液可用作泡沫灭火剂,写出灭火时发生反应的离子方程式。
(5)、NW3是黄色油状液体,无漂白性,在热水中会发生水解。NW3的电子式为。若取该液体滴入50℃左右的热水中,片刻后取该热水溶液滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色。写出NW3在热水中发生水解的化学方程式。31. A、B、D、E、G、H均是前四周期的元素.在所有前四周期的基态原子中A的未成对电子最多;B基态原子的L电子层的p能级上有一个空轨道;D 的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E的基态原子M层有6种运动状态不同的电子; G在周期表中位于第8列,H的原子序数比G大3.根据信息回答下列问题:(1)、E元素基态原子的M层有种能量不同的电子;EO2分子的立体构型为 , 其VSEPR模型名称为 .(2)、A元素的名称为 , 其基态原子价电子排布图为 .(3)、区分晶体与非晶体最可靠的科学方法是对固体进行;G与BD能形成挥发性液体G(BD)5 , 则其属于晶体.G常见晶体结构为体心立方堆积,其中G原子在二维平面里放置时的配位数为 . 某种含G化合物的晶胞如图所示,该晶体的密度为ρ g/cm3 , 则NA可以表示为(用含ρ、a、b的式子表示,不必化简)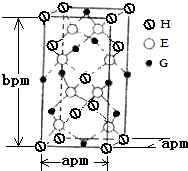 32. 根据已学物质结构与性质的有关知识,回答下列问题:(1)、请写出第三周期元素中p轨道上有3个未成对电子的元素符号: , 某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4 , 该元素的名称是 .(2)、根据价层电子对互斥理论推测下列离子或分子的空间立体构型:H3O+ , BF3 .(3)、向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关反应的离子方程式、 .(4)、金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为 .
32. 根据已学物质结构与性质的有关知识,回答下列问题:(1)、请写出第三周期元素中p轨道上有3个未成对电子的元素符号: , 某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4 , 该元素的名称是 .(2)、根据价层电子对互斥理论推测下列离子或分子的空间立体构型:H3O+ , BF3 .(3)、向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关反应的离子方程式、 .(4)、金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为 . 33. 已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大.X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素.
33. 已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大.X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素.请回答下列问题:
(1)、Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) .(2)、Z在元素周期表中的位置为 .(3)、上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) .(4)、X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) , 在实验室中,制取该物质的反应原理是(写化学方程式) .(5)、M2Z的电子式为 . MX与水反应可放出气体,该反应的化学方程式为 .(6)、常温下,不能与G的单质发生反应的是(填序号) .a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
工业上用电解法制G的单质的化学方程式是 , 若以石墨为电极,阳极产生的混合气体的成分是(写化学式) .
34. 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.(1)、W原子的核外电子排布式为 .(2)、均由X、Y、Z三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,其中盐的化学式为 , 推测盐中阴离子的空间构型为 , 其中心原子杂化方式为 .(3)、Z、W两种元素电负性的大小关系为;Y、Z两种元素第一电离能的大小关系为 .(4)、CO的结构可表示为CO,元素Y的单质Y2的结构也可表示为YY.如表是两者的键能数据(单位:kJ•mol﹣1):A﹣B
A═B
A≡B
CO
357.7
798.9
1071.9
Y2
154.8
418.4
941.7
①结合数据说明CO比Y2活泼的原因: .
②意大利罗马大学Fulvio Cacace等人获得了极具研究意义的Y4分子,其结构如图所示,请结合上表数据分析,下列说法中,正确的是 .
A.Y4为一种新型化合物
B.Y4与Y2互为同素异形体
C.Y4的沸点比P4(白磷)高
D.1mol Y4气体转变为Y2将放出954.6kJ热量.
 35. I.2015年国产C919大型客机正式下线,标志着我国成为世界上少数几个具有自行研制大型飞机的国家之一,标志着我国航空工业进入了新的发展阶段.(1)、飞机的外壳通常采用镁﹣铝合金材料,铝的价电子排布图为 , 第一电离能:镁(填“大于”或“小于”)铝.(2)、现代飞机为了减轻质量而不减轻外壳承压能力,通常采用复合材料﹣﹣玻璃纤维增强塑料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如1图所示:
35. I.2015年国产C919大型客机正式下线,标志着我国成为世界上少数几个具有自行研制大型飞机的国家之一,标志着我国航空工业进入了新的发展阶段.(1)、飞机的外壳通常采用镁﹣铝合金材料,铝的价电子排布图为 , 第一电离能:镁(填“大于”或“小于”)铝.(2)、现代飞机为了减轻质量而不减轻外壳承压能力,通常采用复合材料﹣﹣玻璃纤维增强塑料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如1图所示:
其中碳原子的杂化方式为 , 个数比为 .
(3)、II.大型飞机的发动机被誉为航空工业皇冠上的“宝石”.制造过程中通常采用碳化钨做关键部位的材料.钨元素位于周期表的第六周期第VIB族,请写出其外围电子排布式 ,
(4)、图2为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物.在此结构中,其中钨原子有个,1个钨原子周围距离钨原子最近的碳原子有个,下列金属元素的堆积方式与碳化钨晶胞中碳原子和钨原子所处位置类似的是 .A.Fe CuB.Ti AuC.Mg ZnD.Cu Ag
(5)、假设该部分晶体的体积为Vcm3 , 碳化钨的摩尔质量为M g/mol,密度为b g/cm3 , 则阿伏加德罗常数NA用上述数据可以表示为 .