高考二轮复习知识点:元素周期律和元素周期表的综合应用2
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是( )
 A、该化合物中,W、X、Y之间均为共价键 B、Z的单质既能与水反应,也可与甲醇反应 C、Y的最高化合价氧化物的水化物为强酸 D、X的氟化物XF3中原子均为8电子稳定结构2. W、X、Y和Z为原子序数一次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同,下列叙述正确的是()A、X与其他三种元素均可形成两种或两种以上的二元化合物 B、Y与其他三种元素分别形成的化合物中只含有离子键 C、四种元素的简单离子具有相同的电子层结构 D、W的氧化物对应的水化物均为强酸3. 五种短周期元素的信息如下表,下列有关叙述正确的是
A、该化合物中,W、X、Y之间均为共价键 B、Z的单质既能与水反应,也可与甲醇反应 C、Y的最高化合价氧化物的水化物为强酸 D、X的氟化物XF3中原子均为8电子稳定结构2. W、X、Y和Z为原子序数一次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同,下列叙述正确的是()A、X与其他三种元素均可形成两种或两种以上的二元化合物 B、Y与其他三种元素分别形成的化合物中只含有离子键 C、四种元素的简单离子具有相同的电子层结构 D、W的氧化物对应的水化物均为强酸3. 五种短周期元素的信息如下表,下列有关叙述正确的是元素代号
M
N
O
P
Q
原子半径/nm
0.160
0.143
0.089
0.102
0.071
主要化合价
+2
+3
+2
+6、+4、-2
-1
A、N3+比Q-少一个电子层 B、O的单质既能与强酸反应又能与强碱反应 C、第一电离能:M<N D、P形成的气态氢化物比Q形成的气态氢化物更稳定4. 短周期元素W、X、Y、Z的原子序数依次增大,浙江大学研究团队以aY2X3·bZX2(硅酸盐,a、b为计量数)为载体,利用Au-Pb纳米颗粒催化气态单质W2、X2合成W2X2其原理如图所示。下列说法正确的是 A、地壳中元素含量:X>Y>Z B、简单离子半径:Y>X C、Y2X3和ZX2、W2X均具有较高熔点 D、W与X形成两种化合物均为极性分子5. 化合物Q由短周期主族元素W、X、Y、Z四种元素组成,且原子序数依次增大。某实验小组按如下流程进行相关实验:
A、地壳中元素含量:X>Y>Z B、简单离子半径:Y>X C、Y2X3和ZX2、W2X均具有较高熔点 D、W与X形成两种化合物均为极性分子5. 化合物Q由短周期主族元素W、X、Y、Z四种元素组成,且原子序数依次增大。某实验小组按如下流程进行相关实验:
已知:①气体体积均在标况下测定、无色气体D是一种单质;②反应均完全发生。
下列说法正确的是
A、简单离子的半径: X<Y<Z B、简单氢化物的沸点: Z>Y C、无色气体D为N2 D、Q的化学式为(NH4)2S2O86. X、Y、Z为原子序数逐渐增大的短周期主族元素。X、Y、Z能形成一种化合物,其结构如图,下列说法错误的是 A、X、Y、Z存在同素异形体 B、简单离子半径:Z>X>Y C、同周期元素组成的单质中Y还原性最强 D、同周期元素中Z的第一电离能大于左右相邻的元素7. 短周期主族元素X、Y、Z、W的原子序数依次增大,X元素的最高正价和最低负价之和相差2,Y和W同主族,在短周期元素中Z原子的原子半径最大,其中Y、Z、W构成的某种物质结构如图所示。下列说法正确的是
A、X、Y、Z存在同素异形体 B、简单离子半径:Z>X>Y C、同周期元素组成的单质中Y还原性最强 D、同周期元素中Z的第一电离能大于左右相邻的元素7. 短周期主族元素X、Y、Z、W的原子序数依次增大,X元素的最高正价和最低负价之和相差2,Y和W同主族,在短周期元素中Z原子的原子半径最大,其中Y、Z、W构成的某种物质结构如图所示。下列说法正确的是 A、简单离子半径:W> Z> Y> X B、元素X的氧化物对应水化物是强酸 C、元素Y和Z能形成一种用于呼吸面具供氧剂的物质 D、向Y、Z和W形成的上述化合物中加入稀硫酸,无明显现象8. 一种新型的电解质的结构如图所示(箭头指向表示共用电子对由W提供),W、X、Y、Z是同周期四种主族元素,Y原子的最外层电子数是X原子次外层电子数的3倍,下列说法错误的是
A、简单离子半径:W> Z> Y> X B、元素X的氧化物对应水化物是强酸 C、元素Y和Z能形成一种用于呼吸面具供氧剂的物质 D、向Y、Z和W形成的上述化合物中加入稀硫酸,无明显现象8. 一种新型的电解质的结构如图所示(箭头指向表示共用电子对由W提供),W、X、Y、Z是同周期四种主族元素,Y原子的最外层电子数是X原子次外层电子数的3倍,下列说法错误的是 A、该物质中含离子键、极性键和非极性键 B、该物质中X原子满足8电子稳定结构 C、W的非金属性比Y的弱 D、W、X、Y、Z四种元素中,X的原子半径最大9. 化合物M是一种高效消毒漂白剂,结构如图所示。W、X、Y、Z是原子序数依次增大的短周期主族元素,Y的某种单质可用于自来水消毒,Y、Z在不同周期。下列叙述错误的是
A、该物质中含离子键、极性键和非极性键 B、该物质中X原子满足8电子稳定结构 C、W的非金属性比Y的弱 D、W、X、Y、Z四种元素中,X的原子半径最大9. 化合物M是一种高效消毒漂白剂,结构如图所示。W、X、Y、Z是原子序数依次增大的短周期主族元素,Y的某种单质可用于自来水消毒,Y、Z在不同周期。下列叙述错误的是 A、第一电离能: B、W的杂化方式为 C、分子的空间结构为三角锥形 D、最高价氧化物对应水化物的酸性:10. 关于C2H2、N2H2、H2O2、H2S2的结构与性质,下列说法错误的是A、热稳定性:H2O2>H2S2 B、N2H2存在顺反异构现象 C、键角:C2H2>N2H2>H2S2>H2O2 D、四种物质中沸点最高的是H2O211. X、Y、Z、W为原子序数依次增大的前四周期元素,X为周期表中原子半径最小的元素,Y、Z位于同一主族,且原子序数之和为24,基态W原子的价电子数为11,化合物WZY4•5X2Y的热重曲线如图。下列说法错误的是
A、第一电离能: B、W的杂化方式为 C、分子的空间结构为三角锥形 D、最高价氧化物对应水化物的酸性:10. 关于C2H2、N2H2、H2O2、H2S2的结构与性质,下列说法错误的是A、热稳定性:H2O2>H2S2 B、N2H2存在顺反异构现象 C、键角:C2H2>N2H2>H2S2>H2O2 D、四种物质中沸点最高的是H2O211. X、Y、Z、W为原子序数依次增大的前四周期元素,X为周期表中原子半径最小的元素,Y、Z位于同一主族,且原子序数之和为24,基态W原子的价电子数为11,化合物WZY4•5X2Y的热重曲线如图。下列说法错误的是 A、同周期中第一电离能大于Y的元素有3种 B、Z的最高价含氧酸酸性是同主族中最强的 C、WZY4•5X2Y中有三种不同结合力的X2Y D、220℃时,固体物质的化学式为WZY412. X、Y、Z、W是原子序数依次增大的短周期主族元素,其中W的最外层电子数是次外层电子数的3倍,由X、Y、Z、W四种元素形成的离子化合物G结构如下,下列有关说法正确的是
A、同周期中第一电离能大于Y的元素有3种 B、Z的最高价含氧酸酸性是同主族中最强的 C、WZY4•5X2Y中有三种不同结合力的X2Y D、220℃时,固体物质的化学式为WZY412. X、Y、Z、W是原子序数依次增大的短周期主族元素,其中W的最外层电子数是次外层电子数的3倍,由X、Y、Z、W四种元素形成的离子化合物G结构如下,下列有关说法正确的是 A、X与Y、Z、W均能形成10电子和18电子的化合物 B、X、Y、Z三种元素只能形成共价化合物,不能形成离子化合物 C、氢化物的稳定性:Y<Z<W D、构成化合物G的原子最外层均达到8电子稳定结构13. 如图所示的有机化合物是核酸病毒保存液的重要成分之一。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Y同周期,Z的价电子数等于X的原子序数。下列说法中正确的是
A、X与Y、Z、W均能形成10电子和18电子的化合物 B、X、Y、Z三种元素只能形成共价化合物,不能形成离子化合物 C、氢化物的稳定性:Y<Z<W D、构成化合物G的原子最外层均达到8电子稳定结构13. 如图所示的有机化合物是核酸病毒保存液的重要成分之一。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Y同周期,Z的价电子数等于X的原子序数。下列说法中正确的是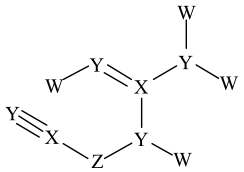 A、第一电离能:X>Y B、W、Y、Z可形成离子化合物 C、分子中可能所有原子均共面 D、X、Y、Z的简单氢化物在水中均是强酸14. X、Y、Z、W、Q为原子序数依次递增的短周期主族元素。基态X原子价电子层有3个单电子,Z与Y可形成原子个数比为1∶1的含非极性共价键的离子化合物。W、Q的最外层电子数之和等于Z的原子序数。下列说法正确的是A、简单离子半径:Z>Y B、X、W单质的晶体类型一定相同 C、简单气态氢化物的稳定性:X>Y D、Q的最高价含氧酸根的空间结构为正四面体形15. 下列事实或现象不能用元素周期律解释的是A、相同温度、相同物质的量浓度时,醋酸的pH大于盐酸 B、醛基的碳氧双键中,氧原子带部分负电荷 C、Mg和水的反应不如Na和水的反应剧烈 D、向NaBr溶液中滴加氯水,再加入四氯化碳,液体分层,下层呈橙红色16. 一种离子液体的结构如图所示,其中Z、X、Y、W为原子序数依次增大的短周期元素,W的最外层电子数是内层电子数的3倍。下列说法正确的是( )
A、第一电离能:X>Y B、W、Y、Z可形成离子化合物 C、分子中可能所有原子均共面 D、X、Y、Z的简单氢化物在水中均是强酸14. X、Y、Z、W、Q为原子序数依次递增的短周期主族元素。基态X原子价电子层有3个单电子,Z与Y可形成原子个数比为1∶1的含非极性共价键的离子化合物。W、Q的最外层电子数之和等于Z的原子序数。下列说法正确的是A、简单离子半径:Z>Y B、X、W单质的晶体类型一定相同 C、简单气态氢化物的稳定性:X>Y D、Q的最高价含氧酸根的空间结构为正四面体形15. 下列事实或现象不能用元素周期律解释的是A、相同温度、相同物质的量浓度时,醋酸的pH大于盐酸 B、醛基的碳氧双键中,氧原子带部分负电荷 C、Mg和水的反应不如Na和水的反应剧烈 D、向NaBr溶液中滴加氯水,再加入四氯化碳,液体分层,下层呈橙红色16. 一种离子液体的结构如图所示,其中Z、X、Y、W为原子序数依次增大的短周期元素,W的最外层电子数是内层电子数的3倍。下列说法正确的是( ) A、原子半径:X> Y>Z> W B、简单气态氢化物的还原性: Y > X C、Z、Y、W可形成盐 D、该物质中所有原子均满足8电子稳定结构17. 世界资源储量最大的滑石矿位于江西上饶,经分析发现滑石中含有4种短周期元素W、X、Y、Z,它们的原子序数依次增大,最外层电子数之和为13,且位于不同的主族,X的某种单质被喻为“地球的保护伞”,W2X2分子中含有18个电子,下列说法正确的是( )A、原子半径大小顺序为Z>Y>X>W B、化合物YX是一种很好的耐火材料 C、Y单质只能与空气中的主要成分氧气反应 D、Z的氧化物的水化物的酸性强于碳酸18. X、Y、Z、W四种短周期元素在周期表中的位置如图所示,元素Z的核电荷数是元素Y的两倍,下列有关说法错误的是( )
A、原子半径:X> Y>Z> W B、简单气态氢化物的还原性: Y > X C、Z、Y、W可形成盐 D、该物质中所有原子均满足8电子稳定结构17. 世界资源储量最大的滑石矿位于江西上饶,经分析发现滑石中含有4种短周期元素W、X、Y、Z,它们的原子序数依次增大,最外层电子数之和为13,且位于不同的主族,X的某种单质被喻为“地球的保护伞”,W2X2分子中含有18个电子,下列说法正确的是( )A、原子半径大小顺序为Z>Y>X>W B、化合物YX是一种很好的耐火材料 C、Y单质只能与空气中的主要成分氧气反应 D、Z的氧化物的水化物的酸性强于碳酸18. X、Y、Z、W四种短周期元素在周期表中的位置如图所示,元素Z的核电荷数是元素Y的两倍,下列有关说法错误的是( )X
Y
Z
W
A、原子半径:X> Y B、简单阴离子还原性:Z> W C、元素X、Y的单质在放电条件下生成红棕色气体 D、四种元素的简单氢化物中,Y的氢化物沸点最高19. W、X、Y、Z为原子序数依次增大的短周期主族元素,W与Z同族,W与X原子序数之和等于Z的原子序数,W、Y、Z的最外层电子数和为11且Y、Z的最外层电子数相差1。下列说法正确的是( )A、W的氢化物的沸点比Z的氢化物的沸点低 B、W与Y可形成化合物 C、Z与X在自然界中形成的晶体为分子晶体 D、W与X只能组成两种化合物20. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的原子半径最小,W与Y同主族,X原子最外层电子数是其次外层电子数的3倍。火山喷口附近有Z的单质存在,四种元素形成的一种化合物Q的结构如图所示。下列说法错误的是( ) A、原子半径: B、Z的最高价氧化物对应的水化物是强酸 C、W与Y形成的化合物属于离子化合物 D、Z的简单气态氢化物比X的简单气态氢化物稳定21. X、Y、Z、W、M为原子序数依次增大的前20号主族元素,其中仅有一种金属元素,且只有两种元素处于同一周期。自然界中Z的单质主要存在于火山口附近,X和Y最外层电子数之和是M最外层电子数的3倍。下列说法一定正确的是( )A、简单离子半径:M>Z>W B、化合物M2YX中只含离子键不含共价键 C、热稳定性:X2Z>XW D、氧化物对应水化物酸性:Z>W
A、原子半径: B、Z的最高价氧化物对应的水化物是强酸 C、W与Y形成的化合物属于离子化合物 D、Z的简单气态氢化物比X的简单气态氢化物稳定21. X、Y、Z、W、M为原子序数依次增大的前20号主族元素,其中仅有一种金属元素,且只有两种元素处于同一周期。自然界中Z的单质主要存在于火山口附近,X和Y最外层电子数之和是M最外层电子数的3倍。下列说法一定正确的是( )A、简单离子半径:M>Z>W B、化合物M2YX中只含离子键不含共价键 C、热稳定性:X2Z>XW D、氧化物对应水化物酸性:Z>W二、多选题
-
22. 短周期元素X、Y、Z、R的原子序数依次增大,离子化合物YR可用于调味和食品保存,X、Y、Z三种元素组成的两种化合物A、B的性质如图,X的基态原子中s能级与p能级上的电子数相等。下列说法正确的是( )
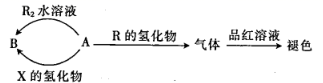 A、X与Z形成的三原子分子为直线形分子 B、简单离子半径:Y<R<Z C、X、Z、R的氢化物的分子间均能形成氢键 D、X、Y、Z、R中,Y的第一电离能最小23. Al、P、S、Cl是周期表中短周期主族元素。下列有关说法正确的是( )A、元素Al在周期表中位于第四周期ⅢA族 B、元素P的简单气态氢化物的化学式为 C、原子半径 D、最高价氧化物的水化物的酸性:24. 短周期主族元素X、Y、Z、W原子序数依次增大,X与Z可以形成两种常见液态化合物,W的原子半径在矩周期主族元素中最大,由Y、Z、W三种元素形成的化合物A的结构如图所示。下列叙述错误的是( )
A、X与Z形成的三原子分子为直线形分子 B、简单离子半径:Y<R<Z C、X、Z、R的氢化物的分子间均能形成氢键 D、X、Y、Z、R中,Y的第一电离能最小23. Al、P、S、Cl是周期表中短周期主族元素。下列有关说法正确的是( )A、元素Al在周期表中位于第四周期ⅢA族 B、元素P的简单气态氢化物的化学式为 C、原子半径 D、最高价氧化物的水化物的酸性:24. 短周期主族元素X、Y、Z、W原子序数依次增大,X与Z可以形成两种常见液态化合物,W的原子半径在矩周期主族元素中最大,由Y、Z、W三种元素形成的化合物A的结构如图所示。下列叙述错误的是( )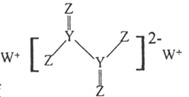 A、Y的氢化物沸点一定低于Z的氢化物 B、X与Z可能形成由极性键与非极性键构成的极性分子 C、化合物 可以与乙二醇在一定条件下发生缩聚反应 D、0.1 化合物A与足量酸性高锰酸钾溶液完全反应转移电子数是0.1
A、Y的氢化物沸点一定低于Z的氢化物 B、X与Z可能形成由极性键与非极性键构成的极性分子 C、化合物 可以与乙二醇在一定条件下发生缩聚反应 D、0.1 化合物A与足量酸性高锰酸钾溶液完全反应转移电子数是0.1三、非选择题
-
25. X、Y、Z为短周期元素,X原子的质子数等于Z与Y的质子数之和;Z与Y位于同一周期,Y原子核外有3个未成对电子,非金属Z的一种固体单质可导电。回答下列问题:
(1)、Y在周期表中的位置是第周期、第族,其原子结构示意图为Y与Z之间形成的化学键属于。(2)、X、Y、Z三种元素中原子半径最大的是(填元素符号);X单质既可与盐酸反应,又可溶于氢氧化钠溶液,产生的气体为 (填分子式),该气体与Y单质反应的化学方程式为。(3)、Z最高价氧化物的电子式为。26. 面对新冠肺炎病毒可以采用的消毒剂常见的有“84”消毒液,医用酒精它们的有效成分分别是NaClO、 ,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:(1)、以上涉及元素包含个主族、个周期;按原子半径由小到大排列依次为(用元素符号表示);有2个未成对电子元素是;非金属性:O>Cl,请列举一个事实。(2)、 是(“电解质”,“非电解质”);75%酒精的“75%”是(“质量分数分数”,“体积分数”), 分子中的氢原子的类型有种(“2”,“3”或“4”)。(3)、NaClO的电子式 , 其溶液中的离子浓度由大到小顺序。某化学工作者在家自制“84”消毒液如图 (4)、①M的化学式 , 铁是极;②请阐述该装置能够制取消毒液的理由:。27. 下表是元素周期表的前三周期,表中的带圈数字表示一种元素,试回答下列问题:
(4)、①M的化学式 , 铁是极;②请阐述该装置能够制取消毒液的理由:。27. 下表是元素周期表的前三周期,表中的带圈数字表示一种元素,试回答下列问题: (1)、②的元素符号是;(2)、写出由①⑥元素的原子组成的化合物的电子式;(3)、③和⑤分别形成的气态氢化物中较稳定的是(填氢化物的化学式);(4)、④的最高价氧化物的水化物的化学式为。28. 、 、 、 、 五种元素的原子序数依次递增。已知:① 位于周期表中第四周期 族,其余的均为短周期主族元素:② 的氧化物是光导纤维的主要成分;③ 原子核外 层电子数为奇数;④ 是形成化合物种类最多的元素;⑤ 原子 轨道的电子数为4。请回答下列问题:(1)、写出一种 元素形成氢化物的化学式。(2)、在1个由 与 形成的 晶胞中(结构如图所示)所包含的 原子数目为个。
(1)、②的元素符号是;(2)、写出由①⑥元素的原子组成的化合物的电子式;(3)、③和⑤分别形成的气态氢化物中较稳定的是(填氢化物的化学式);(4)、④的最高价氧化物的水化物的化学式为。28. 、 、 、 、 五种元素的原子序数依次递增。已知:① 位于周期表中第四周期 族,其余的均为短周期主族元素:② 的氧化物是光导纤维的主要成分;③ 原子核外 层电子数为奇数;④ 是形成化合物种类最多的元素;⑤ 原子 轨道的电子数为4。请回答下列问题:(1)、写出一种 元素形成氢化物的化学式。(2)、在1个由 与 形成的 晶胞中(结构如图所示)所包含的 原子数目为个。 (3)、在[F(NH3)4]2+离子中, 的空轨道接受 的氮原子提供的形成配位键。(4)、常温下 、 和氢元素按原子数目1:1:2形成的气态常见物质 是(写名称), 物质分子中 原子轨道的杂化类型为 , 分子中 键的数目为 。(5)、 、 、 三种元素的第一电离能数值由小到大的顺序为(写元素符号)。29. K、Al、Cu、H、C、O、S、Cl是常见的八种元素。(1)、从明矾[KAl(SO4)2·12H2O]制备 Al、K2SO4和H2SO4的过程如下图所示:
(3)、在[F(NH3)4]2+离子中, 的空轨道接受 的氮原子提供的形成配位键。(4)、常温下 、 和氢元素按原子数目1:1:2形成的气态常见物质 是(写名称), 物质分子中 原子轨道的杂化类型为 , 分子中 键的数目为 。(5)、 、 、 三种元素的第一电离能数值由小到大的顺序为(写元素符号)。29. K、Al、Cu、H、C、O、S、Cl是常见的八种元素。(1)、从明矾[KAl(SO4)2·12H2O]制备 Al、K2SO4和H2SO4的过程如下图所示: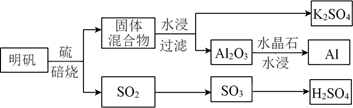
焙烧明矾的化学方程式为。
(2)、K位于元素周期表第周期第族。(3)、S的基态原子核外有个未成对电子;Cl的基态原子核外电子排布式为。(4)、用“>”或“<”填空:第一电离能
离子半径
熔点
酸性
OS
Cl-K+
KClAl2O3
H2SO4HClO4
(5)、SO2的价层电子对个数是 , 该分子为结构为;SO3中硫原子采用杂化方式为。(6)、新制备的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙酸的沸点明显高于乙醛,其主要原因是。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有个铜原子。(7)、Al单质为面心立方晶体,其晶胞参数a=0.405 nm,列式表示Al单质的密度g·cm-3(列出计算式子,不必计算出结果)。30. 清代化学家徐寿创立了化学元素的中文名称和造字原则,推动了化学知识在中国的传播和应用。物质A由原子序数依次增大的短周期元素X、Y、Z组成,其中Z为金属元素,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如图所示:
回答下列问题:
(1)、Y、Z元素的名称为徐寿确定并使用至今,Y在周期表中的位置是。(2)、比较X、Y、Z简单离子的半径大小(用对应离子符号表示)。(3)、在YZO2与YX的混合液中,通入足量CO2是工业制取A的一种方法,写出该反应的化学方程式。(4)、与X同主族的元素溴和碘可以发生下列置换反应:Br2+2I-=2Br-+I2 , I2+2BrO3-=2IO3-+Br2 , 这两个置换反应矛盾吗?简述理由。31. 硫是人类认识最早的元素之一,含硫物质在现代生产和生活中发挥着重要作用。(1)、我国化学家姜雪峰因其在绿色有机硫化学领域的杰出贡献被遴选为“全球青年化学家元素周期表硫元素代表”。①硫元素在元素周期表中的位置是 。
②乙硫醇(CH3CH2SH)是一种含硫有机物,其分子中S-H的极性小于CH3CH2OH分子中O-H的极性,请从原子结构角度解释其原因:。
(2)、自然界的硫循环过程如下图所示。
①上图所涉及的含硫物质中,能使品红溶液褪色的是。
②降解石油(主要成分为CxHy)的过程中,在细菌催化作用下,石油与硫酸盐反应转化为碳酸氢盐,硫酸盐做(填“氧化剂”或“还原剂”)。
③煤炭中的硫化物主要为FeS2(S为-1价)。在潮湿的环境中,FeS2可在氧化亚铁硫杆菌(T.f)的作用下被空气氧化为Fe2(SO4)3 , 该反应的化学方程式为。
32. 有效控制大气温室气体浓度,推动绿色低碳发展,是人类可持续发展的重要战略之一,因此捕集、利用CO2始终是科学研究的热点。(1)、新的研究表明,可以将CO2转化为炭黑回收利用,反应原理如图所示。
①碳在元素周期表中的位置是。
②整个过程中FeO的作用是。
③写出CO2转化为炭黑的总反应化学方程式。
(2)、我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。

①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加助剂效果最好;
②加入助剂能提高单位时间内乙烯产量的根本原因是。
(3)、电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理如右图所示。
①写出阴极CO2还原为HCOO−的电极反应式:。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是。
33. 、 、 、 、 是元素周期表中前四周期的元素,各周期至少含有一种元素,且原子序数依次增大。 、 、 三种元素原子的最外层电子数相同, 与 能够形成原子之比为 的化合物 , 是前四周期基态原子含有未成对电子数目最多的元素, 与 形成的晶体 结构如图所示。试用元素符号回答下列问题: (1)、 、 、 三种元素的电负性由大到小的顺序为。(2)、 与 两种元素能够形成两种常见的化合物,则在这两种化合物分子中,原子的杂化方式分别为和 , 且这两种分子(填选项)。
(1)、 、 、 三种元素的电负性由大到小的顺序为。(2)、 与 两种元素能够形成两种常见的化合物,则在这两种化合物分子中,原子的杂化方式分别为和 , 且这两种分子(填选项)。A 都是极性分子 B 都是非极性分子 C 其中一种是极性分子另一种是非极性分子
(3)、 元素处于周期表的区,其单质晶体堆积模型的名称为。(4)、 元素的基态原子价层电子排布图为。(5)、已知 能溶于某浓度的硝酸中,得到蓝色溶液的同时,会逸出一种与 互为等电子体的纯净气体,则该反应的化学方程式为。经研究证实,所得溶液呈蓝色,是因为溶液中含有由 、 、 三种元素形成的一种配位离子,试写出该离子的结构式。(6)、由晶体 的晶胞可知, 离子呈简单立方堆积模型,形成立方体空隙,则 离子对这些立方体空隙的填充率为 。34. 以氮化镓(GaN)为首的第三代半导体材料适合于制作高温、高频、抗辐射及大功率器件,通常也称为高温半导体材料。回答下列问题:(1)、基态Ga原子价层电子的电子排布图为;第二周期中,第一电离能介于N和B之间的元素有种。(2)、HCN分子中σ键与π键的数目之比为 , 其中σ键的对称方式为。与CN-互为等电子体的一种分子为。(3)、NaN3是汽车安全气囊中的主要化学成分,其中阴离子与CO2互为等电子体,阴离子中心原子的杂化轨道类型为。NF3的空间构型为。(4)、GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因。GaN
GaP
GaAs
熔点
1700℃
1480℃
1238℃
(5)、GaN晶胞结构如图1所示。已知六棱柱底边边长为a cm,阿伏加德罗常数的值为NA。①晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为;
②从GaN晶体中“分割”出的平行六面体如图2。若该平行六面体的体积为
 a3cm3 , GaN晶体的密度为g/cm3(用a、NA表示)。
a3cm3 , GaN晶体的密度为g/cm3(用a、NA表示)。
图1 图2
35. 原子序数依次增大的A,B,C,D,E,F五种元素的原子位于前四周期,A元素原子核外有三种不同能级且各个能级所填充的电子数相同,C原子的核外已成对的电子数是未成对电子数的3倍;D核内质子数比E少1;E与C同主族;F2+的M能层里电子全满。(1)、B元素的名称为 , F元素基态原子的价电子排布式为。(2)、元素A、B、C第一电离能顺序为(填元素符号)。(3)、C与E分别形成的最简单氢化物沸点高低顺序为(用化学式表示),原因是。(4)、D与溴形成的化合物DBr5 , 加压条件下95℃液化,发生完全电离得到一种能够导电的液体,经测定,该熔体中含有一种正四面体结构的阳离子和Br- , 请写出该条件下DBr5电离的电离方程式。该熔体中阳离子的中心原子的杂化方式为。(5)、请写出E的两种常见氧化物的分子空间构型: , 。 (6)、F与E形成的离子晶体晶胞如图所示,该晶体的化学式为(用元素符号表示);若晶体的密度为ρ g/cm3 , 则该晶胞的棱长为pm。
(6)、F与E形成的离子晶体晶胞如图所示,该晶体的化学式为(用元素符号表示);若晶体的密度为ρ g/cm3 , 则该晶胞的棱长为pm。