高考二轮复习知识点:元素周期律和元素周期表的综合应用1
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
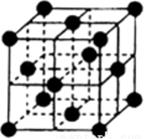
1. X、Y、Z、M、Q五种短周期主族元素,原子序数依次增大。X的核外电子数等于其周期数,分子呈三角锥形,Z的核外电子数等于X、Y核外电子数之和。M与X同主族,Q是同周期中非金属性最强的元素。下列说法正确的是( )A、X与Z形成的10电子微粒有2种 B、Z与Q形成的一种化合物可用于饮用水的消毒 C、与的晶体类型不同 D、由X、Y、Z三种元素组成的化合物的水溶液均显酸性2. X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素的最高正价为 价,Y元素与Z、M元素相邻,且与M元素同主族;化合物 的电子总数为18个;Q元素的原子最外层电子数比次外层少一个电子。下列说法错误的是( )A、原子半径: B、最高价氧化物对应水化物的酸性: C、 易溶于水,其水溶液呈碱性 D、X、Z和Q三种元素形成的化合物一定是共价化合物3. W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。下列叙述正确的是( )A、非金属性:W> X>Y> Z B、原子半径:Z>Y>X>W C、元素X的含氧酸均为强酸 D、Y的氧化物水化物为强碱4. 离子液体是室温下呈液态的离子化合物。由原子序数依次增大的短周期主族元素X、Y、Z、W、R组成的一种离子液体的结构如图所示,W的简单氢化物易液化,可用作制冷剂,R的简单阴离子含10个电子。下列说法正确的是
 A、电负性:R>X>Z B、氢化物的沸点:R>Z C、分子YR3的空间构型为三角锥形 D、最高价含氧酸的酸性:W>Z5. 我国科学家在寻找“点击反应”的砌块过程中,发现一种新的化合物,结构如下图所示,其中X、Y、Z和W是原子序数依次增大的短周期主族元素,Y与W是同一主族元素。下列说法正确的是
A、电负性:R>X>Z B、氢化物的沸点:R>Z C、分子YR3的空间构型为三角锥形 D、最高价含氧酸的酸性:W>Z5. 我国科学家在寻找“点击反应”的砌块过程中,发现一种新的化合物,结构如下图所示,其中X、Y、Z和W是原子序数依次增大的短周期主族元素,Y与W是同一主族元素。下列说法正确的是 A、元素电负性:Z>Y>W B、简单氢化物沸点:X>Y>W C、简单离子半径:Z>Y>X D、X、W氧化物的水化物均为强酸6. W、X、Y、Z、M、N为六种短周期主族元素。W的核外电子数等于其周期数,X、Y、Z是原子序数依次增大的同周期元素且W2Z是最常用的溶剂。W、X、Y、Z的最外层电子数之和与N的质子数相等。只有M是金属元素。下列说法正确的是A、由W、Y、Z三种元素组成的化合物可能是强电解质 B、氢化物的沸点:Z>N>X C、离子半径:N>M>Z>Y D、W和M形成的化合物溶于水显酸性7. 某种由六种元素形成的抗癌药物的结构简式如图所示,其中W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y同主族,Y、Z的最外层电子数之和是X的最外层电子数的2倍,下列叙述错误的是
A、元素电负性:Z>Y>W B、简单氢化物沸点:X>Y>W C、简单离子半径:Z>Y>X D、X、W氧化物的水化物均为强酸6. W、X、Y、Z、M、N为六种短周期主族元素。W的核外电子数等于其周期数,X、Y、Z是原子序数依次增大的同周期元素且W2Z是最常用的溶剂。W、X、Y、Z的最外层电子数之和与N的质子数相等。只有M是金属元素。下列说法正确的是A、由W、Y、Z三种元素组成的化合物可能是强电解质 B、氢化物的沸点:Z>N>X C、离子半径:N>M>Z>Y D、W和M形成的化合物溶于水显酸性7. 某种由六种元素形成的抗癌药物的结构简式如图所示,其中W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y同主族,Y、Z的最外层电子数之和是X的最外层电子数的2倍,下列叙述错误的是 A、W的最简单氢化物与Z的单质混合后可产生白烟 B、简单气态氢化物稳定性:X<W C、WZ3中各原子均满足8电子稳定结构 D、X的一种单质和化合物ZX2均可用于杀菌消毒8. 《神农本草经》中记载白矾的主要成分为。下列说法错误的是A、离子半径: B、碱性: C、热稳定性: D、第一电离能:9. 短周期主族元素W、X、Y、Z、Q原子序数依次增大。W与Q同主族,且Q的原子序数是W的2倍;X的简单离子在同周期元素形成的简单离子中半径最小。下列说法正确的是A、元素最高正价:W = Q B、原子半径:W>X C、核外未成对电子数:Y = Q D、非金属性:Y>Z10. 通过比较与归纳可以加深对化学物质的认识。下列说法一定正确的是A、热稳定性:NH3>PH3>H2S B、酸性:HClO4>H2SO4>H3PO4 C、离子半径:阴离子>阳离子 D、熔沸点:离子化合物>共价化合物11. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外p能级上的电子总数与s能级上的电子总数相等,Y原子核外没有未成对电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是A、简单离子半径X的比Y的小 B、Y的第一电离能比同周期相邻两种元素的大 C、Z的常见氧化物是一种离子晶体 D、W的简单氢化物是非极性分子12. 化合物A主要用作磷化铝中间体,也用于医药,其结构如图所示。已知:W、X、Y、Z为四种短周期主族元素,原子序数依次增大,Z的某种单质是生命活动中不能缺少的物质,下列说法错误的是
A、W的最简单氢化物与Z的单质混合后可产生白烟 B、简单气态氢化物稳定性:X<W C、WZ3中各原子均满足8电子稳定结构 D、X的一种单质和化合物ZX2均可用于杀菌消毒8. 《神农本草经》中记载白矾的主要成分为。下列说法错误的是A、离子半径: B、碱性: C、热稳定性: D、第一电离能:9. 短周期主族元素W、X、Y、Z、Q原子序数依次增大。W与Q同主族,且Q的原子序数是W的2倍;X的简单离子在同周期元素形成的简单离子中半径最小。下列说法正确的是A、元素最高正价:W = Q B、原子半径:W>X C、核外未成对电子数:Y = Q D、非金属性:Y>Z10. 通过比较与归纳可以加深对化学物质的认识。下列说法一定正确的是A、热稳定性:NH3>PH3>H2S B、酸性:HClO4>H2SO4>H3PO4 C、离子半径:阴离子>阳离子 D、熔沸点:离子化合物>共价化合物11. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外p能级上的电子总数与s能级上的电子总数相等,Y原子核外没有未成对电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是A、简单离子半径X的比Y的小 B、Y的第一电离能比同周期相邻两种元素的大 C、Z的常见氧化物是一种离子晶体 D、W的简单氢化物是非极性分子12. 化合物A主要用作磷化铝中间体,也用于医药,其结构如图所示。已知:W、X、Y、Z为四种短周期主族元素,原子序数依次增大,Z的某种单质是生命活动中不能缺少的物质,下列说法错误的是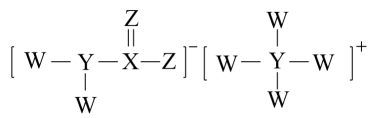 A、原子半径: B、化合物A中Y显价 C、简单氢化物稳定性: D、由W、Y、Z三种元素组成的化合物一定抑制水的电离13. 主族元素X、Y、Z、W分别位于三个短周期,且原子序数依次增大。X、Y可形成化合物A的结构式为:X-Y-Y-X;Y、Z、W可形成具有强氧化性的化合物B,其电子式为
A、原子半径: B、化合物A中Y显价 C、简单氢化物稳定性: D、由W、Y、Z三种元素组成的化合物一定抑制水的电离13. 主族元素X、Y、Z、W分别位于三个短周期,且原子序数依次增大。X、Y可形成化合物A的结构式为:X-Y-Y-X;Y、Z、W可形成具有强氧化性的化合物B,其电子式为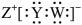 。下列说法错误的是( ) A、原子半径:Z>Y>X B、W的最高价氧化物的水化物为强酸 C、B的浓溶液可用pH试纸测其酸碱性 D、化合物A、B都可用作新型冠状病毒的消毒剂14. 短周期主族元素X、Y、Z、W在周期表中的位置如图所示,其中X、W最低负化合价之和为-4,下列说法错误的是( )
。下列说法错误的是( ) A、原子半径:Z>Y>X B、W的最高价氧化物的水化物为强酸 C、B的浓溶液可用pH试纸测其酸碱性 D、化合物A、B都可用作新型冠状病毒的消毒剂14. 短周期主族元素X、Y、Z、W在周期表中的位置如图所示,其中X、W最低负化合价之和为-4,下列说法错误的是( )Y
Z
X
W
A、原子半径: X>Y B、单质的熔点: X> W C、X与W只能形成一种化合物 D、简单氢化物的稳定性: Z> W15. 下列事实不能用元素周期律解释的是( )A、原子半径:Na>Mg B、非金属性:O>S C、还原性:Cl-<Br- D、酸性:H2SO3>H2CO316. 氮化硅是一种性能优异的半导体材料。下列说法正确的是( )A、硅也是一种半导体材料 B、非金属性: C、原子半径: D、硅位于第3周期第VIA族17. 在考古研究中,通过分析铜器中(铅)同位素的比值,可以推断铜器是否同源。下列说法错误的是A、Pb是第五周期元素 B、含有中子数为122 C、可用质谱法区分和 D、Pb的原子半径比Ge大18. 硒代半胱氨酸(含C、H、N、O、34Se5种元素)是一种氨基酸,其分子空间结构如图,下列说法错误的是 A、Se位于元素周期表中第四周期VIA族 B、图中最大的球代表Se C、硒代半胱氨酸分子中含一个手性碳原子 D、硒代半胱氨酸难溶于水,易溶于苯19. W、X、Y、Z为原子序数依次增大的短周期主族元素,W、Z同主族,Y单质可用作光电池,X的周期序数等于主族序数,Z原子的最外层电子数等于最内层电子数的3倍,下列叙述错误的是A、工业上采用熔融电解法冶炼X的单质 B、含X或Y的某些盐可用于制备胶体 C、简单离子的半径:Z>W>X D、YW2和ZW2都是酸性氧化物,都不与酸反应20. 如图是人体含量较多元素的质量分数图,下列有关这些元素的说法错误的是
A、Se位于元素周期表中第四周期VIA族 B、图中最大的球代表Se C、硒代半胱氨酸分子中含一个手性碳原子 D、硒代半胱氨酸难溶于水,易溶于苯19. W、X、Y、Z为原子序数依次增大的短周期主族元素,W、Z同主族,Y单质可用作光电池,X的周期序数等于主族序数,Z原子的最外层电子数等于最内层电子数的3倍,下列叙述错误的是A、工业上采用熔融电解法冶炼X的单质 B、含X或Y的某些盐可用于制备胶体 C、简单离子的半径:Z>W>X D、YW2和ZW2都是酸性氧化物,都不与酸反应20. 如图是人体含量较多元素的质量分数图,下列有关这些元素的说法错误的是 A、原子半径:N<P B、第一电离能:K>Ca C、基态O原子的价层电子轨道表示式
A、原子半径:N<P B、第一电离能:K>Ca C、基态O原子的价层电子轨道表示式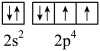 D、图中的七种元素中有2种元素位于周期表第4周期
21. 短周期主族元素X、Y、Z原子序数依次增大,可与C、H形成结构如图的离子液体。已知阳离子中的环状结构与苯类似,下列说法错误的是
D、图中的七种元素中有2种元素位于周期表第4周期
21. 短周期主族元素X、Y、Z原子序数依次增大,可与C、H形成结构如图的离子液体。已知阳离子中的环状结构与苯类似,下列说法错误的是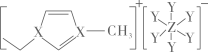 A、原子半径:Z>X>Y B、第一电离能:Y>X>Z C、阳离子中存在π大π键 D、X2Y2电子式:
A、原子半径:Z>X>Y B、第一电离能:Y>X>Z C、阳离子中存在π大π键 D、X2Y2电子式: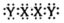 22. “证据推理与模型认知”是化学学科培养的核心素养之一。下列推论合理的是( )
22. “证据推理与模型认知”是化学学科培养的核心素养之一。下列推论合理的是( )选项
已知信息
推论
A.
原子半径:
离子半径:
B.
非金属性:
还原性:
C.
酸性:
酸性:
D.
的分子构型为V形
二甲醚的分子骨架()构型为V型
A、A B、B C、C D、D23. 前四周期主族元素X、Y 、Z、W的原子序数依次增大,它们形成的一种物质的结构如图所示,其中所有原子都形成了8电子稳定结构,四种元素中仅X、Y在同周期。下列推断中错误的是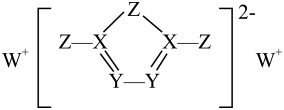 A、简单离子半径:W> Z> Y B、Z单质可溶于由X、Z形成的化合物中 C、第一电离能:Y> X D、Y与氧元素形成的化合物不止三种
A、简单离子半径:W> Z> Y B、Z单质可溶于由X、Z形成的化合物中 C、第一电离能:Y> X D、Y与氧元素形成的化合物不止三种二、多选题
-
24. X、Y、Z、Q、W是原子序数依次增大的前四周期元素,其中X是宇宙中含量最多的元素;在同周期元素中,第一电离能数值比Y大的元素有2种;Z元素原子的价层电子排布是;Q、W元素原子的最外层均只有1个电子,但Q元素原子中只有两种形状的电子云,W元素原子的次外层内的所有轨道的电子均成对。下列说法正确的是( )A、电负性:X<Y<Z B、键角: C、的阴阳离子比为1∶1 D、W元素位于元素周期表的d区25. 下列操作能达到实验目的的是( )
选项
目的
操作
A
除去Cu粉中混有的CuO
加入稀硝酸,过滤、洗涤、干燥
B
探究温度对Fe3+水解程度的影响
向25 mL冷水和沸水中分别滴入5滴饱和FeCl3溶液,比较溶液颜色
C
证明甲苯中的甲基能够活化苯环
分别取甲苯和苯与酸性KMnO4溶液反应,观察酸性KMnO4溶液的褪色情况
D
证明非金属性:Cl>S
向Na2S溶液中滴加新制氯水,观察实验现象
A、A B、B C、C D、D三、非选择题
-
26. 冰壶比赛称为“冰上的国际象棋”,制作冰壶用的标准砥石的化学成分为石英碱长正长岩,常见的组分有钾长石K[AlSi3O8]和钠长石Na[AlSi3O8]等。完成下列填空:(1)、上述所涉及的元素中,具有相同电子数的简单离子半径由大到小的顺序是 , 原子核外有两个未成对电子的元素有。(2)、用一个化学方程式比较钠和铝的金属性的强弱 , 并用原子结构知识的观点解释原因。(3)、我国科学家发展了一种在200℃熔盐体系中,采用金属Al还原二氧化硅或硅酸盐、钾长石等制备纳米硅材料的方法,将该材料应用于锂离子电池负极材料,展示出优异的电化学性能,配平下列方程式。
Al+K[AlSi3O8]+ AlCl3→Si+AlOCl+KAlO2;
上述反应中若产生14g硅,转移的电子数为。
(4)、KAlO2溶液中,n(K+)n(AlO)(选填“>”或“<”),加入KHCO3溶液后,出现白色沉淀,请解释原因。27. 吴梦昊研究团队设计了一系列稳定的由超碱PnH 和超卤素MX 组成的PnH4MX4(Pn=N,P;M=B,Al,Fe;X=Cl,Br)超盐晶体。(1)、基态铁原子价电子排布中未成对电子数成对电子对数之比。(2)、第二周期元素中,第一电离能介于元素B和N之间的元素有种。(3)、超碱PnH 离子中PH 与PH3键角PH PH3(填“大于”或“小于”),请分析原因。(4)、写出与超卤素AlCl 等电子体的两种分子的化学式:。(5)、六方相氮化硼晶体结构与石墨相似(如图),晶体中氮原子的杂化方式为。氮化硼晶体不导电的原因是。 (6)、磷化硼晶胞结构如图甲所示,晶胞中P原子空间堆积方式为;已知晶体中硼和磷原子半径分别为r1pm和r2pm,距离最近的硼和磷原子核间距为二者原子半径之和。则磷化硼晶胞中原子的体积占晶胞体积的百分率为(写出计算式)。
(6)、磷化硼晶胞结构如图甲所示,晶胞中P原子空间堆积方式为;已知晶体中硼和磷原子半径分别为r1pm和r2pm,距离最近的硼和磷原子核间距为二者原子半径之和。则磷化硼晶胞中原子的体积占晶胞体积的百分率为(写出计算式)。 28. 钛及其化合物在工业、医疗、航天等多方面都有广泛的应用,越来越受到人们的关注。(1)、钛在周期表中的位置 , 钛原子核外有种空间运动状态不同的电子, Ti2+电子占据的最高能层的电子排布式为。(2)、已知钛和铝的相对原子半径分别是1. 45和1.43 ,钛的硬度比铝大的原因是。(3)、硫酸氧钛晶体中的阳离子为链状聚合形式的离子,结构如图1所示,该阳离子的化学符号为 , 该晶体中阴离子的空间构型为。
28. 钛及其化合物在工业、医疗、航天等多方面都有广泛的应用,越来越受到人们的关注。(1)、钛在周期表中的位置 , 钛原子核外有种空间运动状态不同的电子, Ti2+电子占据的最高能层的电子排布式为。(2)、已知钛和铝的相对原子半径分别是1. 45和1.43 ,钛的硬度比铝大的原因是。(3)、硫酸氧钛晶体中的阳离子为链状聚合形式的离子,结构如图1所示,该阳离子的化学符号为 , 该晶体中阴离子的空间构型为。 (4)、Ti(BH4)2是一种储氢材料,其中所含元素的电负性由小到大排列顺序为 , B原子的杂化方式是 , 其中的BH 可由BH3和H-结合而成。BH 含有 (填序号)
(4)、Ti(BH4)2是一种储氢材料,其中所含元素的电负性由小到大排列顺序为 , B原子的杂化方式是 , 其中的BH 可由BH3和H-结合而成。BH 含有 (填序号)①σ键 ②π键 ③氢键 ④配位健 ⑤离子键
(5)、单质钛晶体的晶胞结构如图2所示,则钛的这种堆积方式称为 , 若钛原子半径为r pm,NA表示阿伏加德罗常数的值,金属钛的密度为g/cm3(列出计算式即可)29. 明代科学家宋应星在《天工开物》中写道:“凡玉入中国,贵者尽出于田、葱岭”。和田玉的主要化学成分是含水的钙镁硅酸盐。回答下列问题:(1)、基态钙原子核外电子排布式为。(2)、第一电离能MgCa(填“大于”或“小于”),电负性SiO(填“大于”或“小于”)。(3)、天然硅酸盐可用通式aMxOy·bSiO2·cH2O表示,某钙镁硅酸盐(CaMg3Si4H4O14)可表示为。(4)、在硅酸盐中,正硅酸盐以 四面体(如图a)结构存在,二硅酸盐以图b结构存在,环状硅酸盐以图c结构存在。二硅酸根可表示为 , 环状多硅酸根的通式可表示为 , 其中Si原子的杂化形式为 , 原子与原子之间以相结合。 (5)、金属Mg晶体中的原子堆积方式如图所示,这种堆积方式称为。六棱柱底边边长为acm,高为hcm,阿伏加德罗常数的值为NA , Mg的密度为g·cm-3(列出计算式)。
(5)、金属Mg晶体中的原子堆积方式如图所示,这种堆积方式称为。六棱柱底边边长为acm,高为hcm,阿伏加德罗常数的值为NA , Mg的密度为g·cm-3(列出计算式)。 30. 第IVA族元素及其化合物是结构化学研究的热点。几种晶体结构如图所示:
30. 第IVA族元素及其化合物是结构化学研究的热点。几种晶体结构如图所示: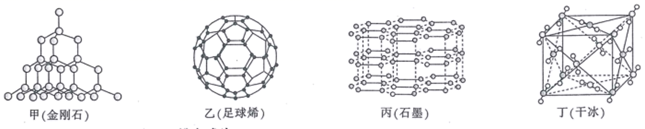 (1)、基态锗(Ge)的核外电子排布式为。(2)、上述四种晶体中,熔点最低的是 , 金刚石中碳原子之间含有的作用力是。(3)、在碳族元素中,最简单气态氢化物中最稳定的是(填分子式)。(4)、与碳同周期的主族元素中,第一电离能最大的是(填元素符号,下同),电负性最小的是。(5)、在碳的氢化物中,既含σ键,又含π键的分子有许多,其中含σ键与π键数目之比为5:1的分子的结构简式为 , (写一种)。(6)、硅晶体结构类似于金刚石(如图甲),则1mol硅晶体中含mol共价键,1mol石墨(如图丙)晶体中含mol共价键。(7)、设NA为阿伏加德罗常数的值,已知干冰(如图丁)的晶胞边长为apm,则干冰的密度为g·cm-3(用含a和NA的代数式表示)。31. 硒是稀散非金属之一,在光敏材料、电解锰行业催化剂和半导体材料等方面有广泛应用,其在元素周期表中相对位置关系如图所示:
(1)、基态锗(Ge)的核外电子排布式为。(2)、上述四种晶体中,熔点最低的是 , 金刚石中碳原子之间含有的作用力是。(3)、在碳族元素中,最简单气态氢化物中最稳定的是(填分子式)。(4)、与碳同周期的主族元素中,第一电离能最大的是(填元素符号,下同),电负性最小的是。(5)、在碳的氢化物中,既含σ键,又含π键的分子有许多,其中含σ键与π键数目之比为5:1的分子的结构简式为 , (写一种)。(6)、硅晶体结构类似于金刚石(如图甲),则1mol硅晶体中含mol共价键,1mol石墨(如图丙)晶体中含mol共价键。(7)、设NA为阿伏加德罗常数的值,已知干冰(如图丁)的晶胞边长为apm,则干冰的密度为g·cm-3(用含a和NA的代数式表示)。31. 硒是稀散非金属之一,在光敏材料、电解锰行业催化剂和半导体材料等方面有广泛应用,其在元素周期表中相对位置关系如图所示:
回答下列问题:
(1)、基态硒原子的核外电子排布式为。单质硒的熔点为221℃,其晶体类型。(2)、根据元素周期律,电负性:SeS,第一电离能GaAs。(填“>”“<”或“=”),Se所在主族元素对应氢化物沸点最低的是(填化学式)。(3)、硒的含氧酸有H2SeO3 , H2SeO4。酸性:H2SeO3H2SeO4(填“>”“<”或“=”)(4)、SeO3是一种无色晶状物,空气中易吸潮。请问Se原子的杂化方式为 , SeO3的空间构型为。(5)、硒化锌材料是一种黄色透明的多晶材料,用于制造透红外线材料及红外线光学仪器,其晶胞如图所示(其中白色球表示硒原子),Zn原子的配位数为 , 已知晶胞边长参数为anm,NA表示阿伏加德罗常数,则紧邻的Se2-与Zn2+之间的距离为nm(列出表达式),硒化锌的密度为g·cm-3(列出计算式)。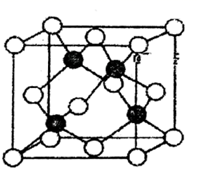 32. 寻找室温超导材料一直是科学家们竞相追求的目标, CaFeAsF 、LaH10、H2S等均是近年来的研究热点。回答下列问题:(1)、基态As原子价层电子的电子排布图(轨道表达式)为 , 基态La原子价电子排布为5d16s2 , 成为阳离子时首先失去轨道电子。(2)、CaFeAsF中,电负性最高的元素是。(3)、Ca与Fe位于同周期且最外层电子构型相同,Ca的熔点和沸点均比Fe的低,这是因为。(4)、H2S的的空间构型为 , 写出一种与H2S互为等电子体的分子的化学式。(5)、含砷化合物(以
32. 寻找室温超导材料一直是科学家们竞相追求的目标, CaFeAsF 、LaH10、H2S等均是近年来的研究热点。回答下列问题:(1)、基态As原子价层电子的电子排布图(轨道表达式)为 , 基态La原子价电子排布为5d16s2 , 成为阳离子时首先失去轨道电子。(2)、CaFeAsF中,电负性最高的元素是。(3)、Ca与Fe位于同周期且最外层电子构型相同,Ca的熔点和沸点均比Fe的低,这是因为。(4)、H2S的的空间构型为 , 写出一种与H2S互为等电子体的分子的化学式。(5)、含砷化合物(以 )中碳原子杂化方式是 , 每个分子中含σ键和π键个数比为。 (6)、Ca、Fe、As构成的超导材料的晶胞结构如图所示,边长为apm,高为cpm,则紧邻的Ca原子之间的距离为 pm,该晶体的密度为 g•cm-3。
)中碳原子杂化方式是 , 每个分子中含σ键和π键个数比为。 (6)、Ca、Fe、As构成的超导材料的晶胞结构如图所示,边长为apm,高为cpm,则紧邻的Ca原子之间的距离为 pm,该晶体的密度为 g•cm-3。 33. 化学工业为疫情防控提供了强有力的物质支撑。氯及其化合物既是重要化工原料,又是广泛使用的高效灭菌消毒剂。回答下列问题:(1)、用氯气制备漂白液的离子方程式是。(2)、TCCA是一种高效含氯消毒漂白剂,贮运稳定,在水中释放有效氯时间长,应用于游泳池等公共场合,其分子结构如图所示:
33. 化学工业为疫情防控提供了强有力的物质支撑。氯及其化合物既是重要化工原料,又是广泛使用的高效灭菌消毒剂。回答下列问题:(1)、用氯气制备漂白液的离子方程式是。(2)、TCCA是一种高效含氯消毒漂白剂,贮运稳定,在水中释放有效氯时间长,应用于游泳池等公共场合,其分子结构如图所示:
已知:X、Y、Z、W属于原子序数递增的短周期元素,Z核外最外层电子数是电子层数的3倍。
①TCCA的分子式是。
②X、Y、Z对应简单氢化物中热稳定性最强的是(用氢化物的化学式表示)。
(3)、ClO2和NaClO2均为重要的杀菌消毒剂,将ClO2通入到NaOH和H2O2混合溶液中,可制备NaClO2。资料:NaClO2晶体易溶于水,难溶于乙醇。NaClO2饱和溶液在温度低于38 ℃时析出NaClO2·3H2O晶体,高于38 ℃时析出NaClO2晶体,高于60 ℃时NaClO2分解成NaClO3和NaCl。
① 写出由ClO2制备NaClO2的离子方程式。
② 从上述NaClO2溶液获得干燥的NaClO2晶体的操作步骤为:将溶液在减压和55 ℃条件下蒸发至大量晶体析出后, , , 低于60℃干燥,得到NaClO2晶体 (补全实验步骤)。
34. X、Y、L、M、N为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、M与N三种元素的质子数均为5的倍数,Y与L同主族。回答下列问题:(1)、X与M组成的最简单化合物的化学式是。(2)、X与N组成的物质是 (填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式是。(3)、Y在周期表中的位置是 , 其含氧酸的化学式是。(4)、M与N形成的化合物中M的化合价是。(5)、在25℃、101kPa下,已知13.5g的L固体单质在氧气中完全燃烧后恢复到原状态,放热419kJ,该反应的热化学方程式是。35. 已知A、B、C、D、E、F为前4周期的6种元素,原子序数依次增大,其中A位于周期表中s区,其原子中电子层数和未成对电子数相同;B原子价电子排布式为nsnnpn , B和E同主族,D原子的最外层电子数是其内层电子数的3倍;F元素位于元素周期表的第4行、第11列。试回答下列问题:(1)、基态F原子的核外电子排布式为 。(2)、下列关于B2A2的说法中正确的是(填选项序号)①B2A2中的所有原子都满足8电子稳定结构
②每个B2A2分子中σ键和π键数目比为1:1
③B2A2是含极性键和非极性键的非极性分子
④B2A2中心原子的杂化类型为sp杂化
(3)、B、C、D三种元素第一电离能由大到小的顺序为(用元素符号表示)。(4)、C的简单气态氢化物与C的最高价氧化物对应的水化物反应生成一种盐H,H晶体中存在的化学键类型有(填选项符号)①离子键 ②共价键 ③氢键 ④配位键 ⑤金属键
(5)、基态E原子的最高能层具有的原子轨道数为;B和E的最高价氧化物中,熔沸点较高的是(写化学式)。(6)、F单质的晶体堆积方式为面心立方最密堆积(如下图),其配位数为 ;若F的相对原子质量为M,它的晶胞棱长为a cm,则F晶体的密度为g·cm-3 。(阿伏加德罗常数为NA)