高考二轮复习知识点:元素周期表的结构及其应用6
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. Q、X、Y、Z是原子序数依次增大的短周期主族元素,Q原子的最外层电子数是内层电子数的2倍,X、Y、Z在周期表中的位置关系如图所示。下列说法正确的是( )
 A、Q和Z可能形成化合物QZ2 B、Y的最高价氧化物的水化物一定是强酸 C、X、Z和氢三种元素不可能组成离子化合物 D、最简单气态氢化物的沸点:Q>X2. 已知下列元素的原子半径:
A、Q和Z可能形成化合物QZ2 B、Y的最高价氧化物的水化物一定是强酸 C、X、Z和氢三种元素不可能组成离子化合物 D、最简单气态氢化物的沸点:Q>X2. 已知下列元素的原子半径:元素
N
S
O
Si
原子半径/10-10 m
0.75
1.02
0.74
1.17
根据以上数据,磷元素的原子半径可能是( )
A、0.80×10-10 m B、1.10×10-10 m C、1.20×10-10 m D、0.70×10-10 m3. 短周期元素X、Y、Z、M的原子序数依次增大,已知元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体。下列叙述错误的是( )A、M元素位于周期表中的第3周期VIA族 B、Z元素最高价氧化物是制造光导纤维的主要原料 C、化合物XM2中含有极性共价键和非极性共价键 D、简单离子半径:Y<M4. A、B、C、D为短周期原子序数依次增大的主族元素。其中:只有D为金属元素;A的某种同素异形体是自然界最硬的物质。下列说法一定正确的是( )A、A,B,C三种元素最高价氧化物的水化物的酸性依次增强 B、简单离子的半径大小顺序为:B>C>D C、B,C分别与D形成的可溶于水的化合物的水溶液可以呈酸性、中性或碱性 D、若B,C能形成化合物BC3 , 则该化合物中B的化合价为-35. 短周期元素R、X、Y、Z的原子序数依次增大。R和X可形成两种液态化合物(常温常压),Y+和X2-具有相同的电子层结构,X和Z位于同一主族。下列说法正确的是( )A、原子半径大小顺序为:r(Y)>r(X)>r(Z)>r(R) B、R与X形成的两种液态化合物中均只含极性共价键 C、Y与X可形成碱性氧化物Y2X2 D、由R、X、Y、Z四种元素形成的常见化合物可抑制水的电离6. 已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C均含有10个电子。它们之间转化关系如图所示。下列说法正确的是( ) A、反应②和③均为吸热反应 B、稳定性:A>C C、原子半径:Z>Y>X D、X、Y、Z可以形成离子化合物7. 短周期主族元素X、Y、Z、W原子序数依次增大,X、W同主族,Y的原子半径是所有短周期主族元素中最大的,Z是地壳中含量最多的金属元素,四种元素原子的最外层电子数总和为16。下列说法错误的是( )A、原子半径: Y>Z>W>X B、工业上获得Y、Z单质的主要方法是电解其熔融的氧化物 C、气态氢化物的稳定性:X>W D、Y、Z、W的最高价氧化物对应水化物之间能两两反应8. 短周期主族元素X、Y、Z、W、Q原子序数依次增大,其中X是组成有机物的必要元素,元素Y的原子最外层电子数是其电子层数的3倍,元素W与X同主族,Z与Q最外层电子数相差6。下列说法正确的是( )A、原子半径:r(Q)>r(W)>r(X)>r(Y) B、W的简单气态氢化物的热稳定性比X的强 C、Y与Z可形成含共价键的离子化合物 D、元素Y、Z、Q组成的化合物水溶液一定呈碱性9. 短周期主族元素X、Y、Z、W质子序数依次增大,其中X的一种单质是自然界硬度最大的物质,Y原子的最外层电子数是内层电子数的3倍,Z是短周期元素中金属性最强的元素,W与X同主族。下列说法正确的是( )A、原子半径:r(X)<r(Y)<r(Z)<r(W) B、X的氢化物的热稳定性比Y的强 C、W的最高价氧化物的水化物是一种强酸 D、Y与Z形成的化合物中可能存在共价健10. A、B、C、D 均为短周期主族元素, 原子序数依次增大,其原子的最外层电子数之和为 18, A 和 C 同主族, B 原子的电子层数与最外层电子数相等,B、 C、 D 的单质均可与 NaOH 溶液反应。下列说法正确的是( )A、简单离子半径: D>B B、简单氢化物的热稳定性: C>A C、AD4 的熔沸点比 CD4的高 D、可电解BD3制备 B 的单质11. 短同期主族元家X、Y、Z、W、Q的原子序数依次增大,原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,乙是同周期中原子半径最大的元素,W的简单离子是同周期中离子半径最小的,X和Z原子序数之和与Q的原子序数相等。下列说法正确的是( )A、气态氢化物的稳定性:X>Y>Q B、X与Q形成的化合物和Z与Q形成的化合物的化学键类型相同 C、Z、W、Q三种元素最高价氧化物对应的水化物之间两两均可反应生成盐和水 D、相同质量的Z和W单质分别与足量稀盐酸反应时,乙的单质制得的氢气多12. W、X、Y.、Z、Q是原子序数依次增大的短周期主族元素,它们原子的最外层电子数之和为21,W与Y同主族,X与Z同主族,X是地壳中含量最多的元素。下列叙述一定正确的是( )A、原子半径是:Y>X>W B、简单氢化物的热稳定性:Z>X C、最高价氧化物对应水化物的酸性:Q>Z D、X与Y形成的化合物只能含有离子键13. W、X、Y、Z为四种短周期主族元素,它们在元素周期表中的相对位置如下图所示,其中Y原子的最外层电子数是其电子层数的2倍。下列说法正确的是( )
A、反应②和③均为吸热反应 B、稳定性:A>C C、原子半径:Z>Y>X D、X、Y、Z可以形成离子化合物7. 短周期主族元素X、Y、Z、W原子序数依次增大,X、W同主族,Y的原子半径是所有短周期主族元素中最大的,Z是地壳中含量最多的金属元素,四种元素原子的最外层电子数总和为16。下列说法错误的是( )A、原子半径: Y>Z>W>X B、工业上获得Y、Z单质的主要方法是电解其熔融的氧化物 C、气态氢化物的稳定性:X>W D、Y、Z、W的最高价氧化物对应水化物之间能两两反应8. 短周期主族元素X、Y、Z、W、Q原子序数依次增大,其中X是组成有机物的必要元素,元素Y的原子最外层电子数是其电子层数的3倍,元素W与X同主族,Z与Q最外层电子数相差6。下列说法正确的是( )A、原子半径:r(Q)>r(W)>r(X)>r(Y) B、W的简单气态氢化物的热稳定性比X的强 C、Y与Z可形成含共价键的离子化合物 D、元素Y、Z、Q组成的化合物水溶液一定呈碱性9. 短周期主族元素X、Y、Z、W质子序数依次增大,其中X的一种单质是自然界硬度最大的物质,Y原子的最外层电子数是内层电子数的3倍,Z是短周期元素中金属性最强的元素,W与X同主族。下列说法正确的是( )A、原子半径:r(X)<r(Y)<r(Z)<r(W) B、X的氢化物的热稳定性比Y的强 C、W的最高价氧化物的水化物是一种强酸 D、Y与Z形成的化合物中可能存在共价健10. A、B、C、D 均为短周期主族元素, 原子序数依次增大,其原子的最外层电子数之和为 18, A 和 C 同主族, B 原子的电子层数与最外层电子数相等,B、 C、 D 的单质均可与 NaOH 溶液反应。下列说法正确的是( )A、简单离子半径: D>B B、简单氢化物的热稳定性: C>A C、AD4 的熔沸点比 CD4的高 D、可电解BD3制备 B 的单质11. 短同期主族元家X、Y、Z、W、Q的原子序数依次增大,原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,乙是同周期中原子半径最大的元素,W的简单离子是同周期中离子半径最小的,X和Z原子序数之和与Q的原子序数相等。下列说法正确的是( )A、气态氢化物的稳定性:X>Y>Q B、X与Q形成的化合物和Z与Q形成的化合物的化学键类型相同 C、Z、W、Q三种元素最高价氧化物对应的水化物之间两两均可反应生成盐和水 D、相同质量的Z和W单质分别与足量稀盐酸反应时,乙的单质制得的氢气多12. W、X、Y.、Z、Q是原子序数依次增大的短周期主族元素,它们原子的最外层电子数之和为21,W与Y同主族,X与Z同主族,X是地壳中含量最多的元素。下列叙述一定正确的是( )A、原子半径是:Y>X>W B、简单氢化物的热稳定性:Z>X C、最高价氧化物对应水化物的酸性:Q>Z D、X与Y形成的化合物只能含有离子键13. W、X、Y、Z为四种短周期主族元素,它们在元素周期表中的相对位置如下图所示,其中Y原子的最外层电子数是其电子层数的2倍。下列说法正确的是( ) A、W单质比X单质更易与氢气化合 B、W的最高价含氧酸可用于制取氢气 C、元素X和钠形成的化合物只含有离子键 D、简单离子半径大小关系为:Y>Z>W>X14. 短周期主族元素X、Y、Z、W原子序数依次增大,X的原子半径小于Y的原子半径,Z的单质是空气中含量最高的气体,W原子最外层比Y原子最外层少1个电子,W的单质制得的金属容器常温下可盛装浓硫酸。下列说法正确的是( )A、原子半径:r(Y)<r(Z)<r(W) B、X、Y形成的化合物只含有极性键 C、Z、W的简单离子具有相同的电子层结构 D、Y的最高价氧化物的水化物酸性比Z的强15. 四种短周期主族元素W、X、Y、Z原子序数依次增大,它们原子最外层电子数之和为18。X的核电荷数是Z的核电荷数的一半,W的单质是空气中含量最多的气体。下列说法正确的是( )A、原子半径:r(Z)<r(X)<r(W)<r(Y) B、W的简单气态氢化物的热稳定性比X的弱 C、Y与X形成的化合物中只含有离子键 D、同周期元素中Z的最高价氧化物对应水化物的酸性最强16. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的某种单质是自然界中最硬的物质,X的某种单质是生物呼吸必需的气体,Y是活泼的金属元素,Z元素原子的K层和M层电子数相同。下列说法正确的是( )A、X、Y、Z的简单离子半径由大到小的顺序是Y>Z>X B、含有Y的盐溶液可能呈酸性、碱性或中性 C、W的简单氢化物的热稳定性比X的强 D、WX2跟X、Y形成的化合物发生的反应都不是氧化还原反应17. 四种短周期元素在周期表中的位置如右图,其中Y元素原子电子层数等于最外层电子数。下列说法错误的是( )
A、W单质比X单质更易与氢气化合 B、W的最高价含氧酸可用于制取氢气 C、元素X和钠形成的化合物只含有离子键 D、简单离子半径大小关系为:Y>Z>W>X14. 短周期主族元素X、Y、Z、W原子序数依次增大,X的原子半径小于Y的原子半径,Z的单质是空气中含量最高的气体,W原子最外层比Y原子最外层少1个电子,W的单质制得的金属容器常温下可盛装浓硫酸。下列说法正确的是( )A、原子半径:r(Y)<r(Z)<r(W) B、X、Y形成的化合物只含有极性键 C、Z、W的简单离子具有相同的电子层结构 D、Y的最高价氧化物的水化物酸性比Z的强15. 四种短周期主族元素W、X、Y、Z原子序数依次增大,它们原子最外层电子数之和为18。X的核电荷数是Z的核电荷数的一半,W的单质是空气中含量最多的气体。下列说法正确的是( )A、原子半径:r(Z)<r(X)<r(W)<r(Y) B、W的简单气态氢化物的热稳定性比X的弱 C、Y与X形成的化合物中只含有离子键 D、同周期元素中Z的最高价氧化物对应水化物的酸性最强16. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的某种单质是自然界中最硬的物质,X的某种单质是生物呼吸必需的气体,Y是活泼的金属元素,Z元素原子的K层和M层电子数相同。下列说法正确的是( )A、X、Y、Z的简单离子半径由大到小的顺序是Y>Z>X B、含有Y的盐溶液可能呈酸性、碱性或中性 C、W的简单氢化物的热稳定性比X的强 D、WX2跟X、Y形成的化合物发生的反应都不是氧化还原反应17. 四种短周期元素在周期表中的位置如右图,其中Y元素原子电子层数等于最外层电子数。下列说法错误的是( ) A、Z位于元素周期表中第三周期、第IVA族 B、Y的最高价氧化物不能和X的简单氢化物反应 C、M的非金属性比Z的弱 D、原子半径比较:X<M18. V、W、X、Y、Z五种短周期主族元素,原子序数依次增大,X的最外层电子数是内层电子数的三倍,W的气态氢化物和最高价氧化物对应的水化物反应生成一种盐,Y是同周期中原子半径最大的元素,Z的原子序数等于V、W、X的原子序数之和。下列说法错误的是( )A、简单离子的半径:W>Y B、V、X可形成原子个数比为1:1、2:1的化合物 C、简单气态氢化物的热稳定性X<W D、X、Z同主族,Y、Z同周期19. X、Y、Z、W均为短周期元素且原子序数依次增大,X 是宇宙中含量最多的元素,Y 与W 同主族且可形成WY2 和WY3 型化合物,Z 与Y 形成的化合物是光纤制品的基本原料。下列说法正确的是( )A、原子半径:X<Y<Z<W B、W 的含氧酸一定是强酸 C、Y 与Z 形成晶体的基本结构单元为四面体 D、X 与Y 只能形成一种化合物20. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3∶4,W的最外层为7电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是( )A、四种元素W的金属性最强 B、原子半径大小:X<Y,Z>W C、Z2Y 和ZWY3形成的化合物种类相同 D、W单质的制备实验室常常选用电解的方法21. 短周期主族元素X、Y、Z、M,X、Y、Z在周期表中的位置关系如图,X和Y能形成两种化合物,M与Y同周期,且M是同周期中原子半径最大的元素。下列说法错误的是( )
A、Z位于元素周期表中第三周期、第IVA族 B、Y的最高价氧化物不能和X的简单氢化物反应 C、M的非金属性比Z的弱 D、原子半径比较:X<M18. V、W、X、Y、Z五种短周期主族元素,原子序数依次增大,X的最外层电子数是内层电子数的三倍,W的气态氢化物和最高价氧化物对应的水化物反应生成一种盐,Y是同周期中原子半径最大的元素,Z的原子序数等于V、W、X的原子序数之和。下列说法错误的是( )A、简单离子的半径:W>Y B、V、X可形成原子个数比为1:1、2:1的化合物 C、简单气态氢化物的热稳定性X<W D、X、Z同主族,Y、Z同周期19. X、Y、Z、W均为短周期元素且原子序数依次增大,X 是宇宙中含量最多的元素,Y 与W 同主族且可形成WY2 和WY3 型化合物,Z 与Y 形成的化合物是光纤制品的基本原料。下列说法正确的是( )A、原子半径:X<Y<Z<W B、W 的含氧酸一定是强酸 C、Y 与Z 形成晶体的基本结构单元为四面体 D、X 与Y 只能形成一种化合物20. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3∶4,W的最外层为7电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是( )A、四种元素W的金属性最强 B、原子半径大小:X<Y,Z>W C、Z2Y 和ZWY3形成的化合物种类相同 D、W单质的制备实验室常常选用电解的方法21. 短周期主族元素X、Y、Z、M,X、Y、Z在周期表中的位置关系如图,X和Y能形成两种化合物,M与Y同周期,且M是同周期中原子半径最大的元素。下列说法错误的是( )Z
X
Y
A、X、Y、Z元素的气态氢化物中,Y的氢化物的沸点最高 B、Z和M组成的化合物为离子化合物,它与盐酸反应能生成两种盐 C、四种元素简单离子的半径由大到小依次为:Y>Z>X>M D、含Y元素的所有18电子微粒均可与Cl2发生反应22. 短周期元素X、Y、Z、W在周期表中位置如图,其中W原子的次外层电子数是最内层电子数与最外层电子数的电子数之和。下列说法错误的是( )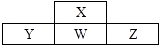 A、最简单的氢化物的沸点:X>W B、元素的非金属性:Z>W>Y C、简单离子的半径大小:Y>W>Z D、氧化物对应水化物的酸性:Y<W<Z23. X、Y、Z、W、Q是原子序数依次递增的短周期元素,在元素周期表中的相对位置如图所示。已知X、Y的原子序数之和等于W,下列说法正确的是( )
A、最简单的氢化物的沸点:X>W B、元素的非金属性:Z>W>Y C、简单离子的半径大小:Y>W>Z D、氧化物对应水化物的酸性:Y<W<Z23. X、Y、Z、W、Q是原子序数依次递增的短周期元素,在元素周期表中的相对位置如图所示。已知X、Y的原子序数之和等于W,下列说法正确的是( )X
Y
Z
W
Q
A、X和W不可能存在于同一离子化合物中 B、QY2、Y3和Q2均可用于自来水消毒 C、最高价氧化物对应水化物的酸性:Q>Z>W D、W、X、Y元素的原子半径及它们的气态氢化物的稳定性均依次递减小24. 下表是部分短周期主族元素的相关信息。下列说法错误的是( )元素编号
元素性质或原子结构
X
周期序数=主族序数=原子序数
Y
原子最外层电子数为a,次外层电子数为b
Z
原子L层电子数为a+b,M层电子数为a-b
M
是地壳中含量最多的金属元素
W
位于第三周期,最外层电子数是电子层数的2倍
A、上述五种元素分布在三个不同周期 B、最简单氢化物的稳定性:Y>Z C、M、W的最高价氧化物对应的水化物之间不能发生化学反应 D、Y、M、W分别形成的单核离子中,M形成的离子半径最小25. 短周期主族元素W、X、Y、Z的原子序数依次增大:W、X、Y、Z组成的单质可发生如图所示的化学反应;B是生活中最常见的液体;常温下Y、Z组成的二元化合物的水溶液pH=7。下列说法错误的是( ) A、A与B的反应一定是化合反应 B、离子半径:Z>X>Y>W C、W、Y、Z均存在两种或两种以上的氧化物 D、将等物质的量的A,C溶于同一烧杯水中,所得溶液的pH一定大于726. 短周期元素W、X、Y、Z的原子序数依次增大,W的一种核素在考古时常用来鉴定一些文物的年代,X2-和Y3+具有相同的电子层结构,Z原子的最外层电子数是其电子层数的2倍。下列相关说法错误的是( )A、简单氢化物的稳定性:W<X B、单核阴离子还原性:Z>X C、电解Y的熔融氧化物可制备Y单质 D、WZ2分子中只存在共价键27. X、Y、Z、M是原子序数依次增大的短周期主族元素,Y的最外层电子数是内层电子数的3倍,Y与Z 形成的化合物Z2Y3中,元素质量比m(Y):m(Z)=8:9;X原子的最外层电子数为M原子和Z原子最外层电子数的和的一半。下列说法正确的是( )A、X的最高价氧化物的水化物一定为强酸 B、气态氢化物的沸点:Y<M C、原子半径Z>M>X>Y D、Z是地壳中含量最多的元素28. X、Y、Z、W为原子序数依次增大的短周期主族元素,Y 与W 同主族。物质A、B、C均由其中三种元素组成,且为中学常见强电解质,可发生反应A +2B= C+2H2O。下列推断正确的是( )A、Y与Z位于同一周期 B、这些元素形成的18电子分子有2种 C、1molC中含有的离子数目为2NA D、单质氧化性:Y<W
A、A与B的反应一定是化合反应 B、离子半径:Z>X>Y>W C、W、Y、Z均存在两种或两种以上的氧化物 D、将等物质的量的A,C溶于同一烧杯水中,所得溶液的pH一定大于726. 短周期元素W、X、Y、Z的原子序数依次增大,W的一种核素在考古时常用来鉴定一些文物的年代,X2-和Y3+具有相同的电子层结构,Z原子的最外层电子数是其电子层数的2倍。下列相关说法错误的是( )A、简单氢化物的稳定性:W<X B、单核阴离子还原性:Z>X C、电解Y的熔融氧化物可制备Y单质 D、WZ2分子中只存在共价键27. X、Y、Z、M是原子序数依次增大的短周期主族元素,Y的最外层电子数是内层电子数的3倍,Y与Z 形成的化合物Z2Y3中,元素质量比m(Y):m(Z)=8:9;X原子的最外层电子数为M原子和Z原子最外层电子数的和的一半。下列说法正确的是( )A、X的最高价氧化物的水化物一定为强酸 B、气态氢化物的沸点:Y<M C、原子半径Z>M>X>Y D、Z是地壳中含量最多的元素28. X、Y、Z、W为原子序数依次增大的短周期主族元素,Y 与W 同主族。物质A、B、C均由其中三种元素组成,且为中学常见强电解质,可发生反应A +2B= C+2H2O。下列推断正确的是( )A、Y与Z位于同一周期 B、这些元素形成的18电子分子有2种 C、1molC中含有的离子数目为2NA D、单质氧化性:Y<W二、多选题
-
29. [选修3--物质结构与性质]下列叙述正确的有( )A、第四周期元素中,锰原子价电子层中未成对电子数最多 B、第二周期主族元素的原子半径随核电荷数增大依次减小 C、卤素氢化物中,HCl的沸点最低的原因是其分子间的范德华力最小 D、价层电子对相斥理论中,Π键电子对数不计入中心原子的价层电子对数
三、非选择题
-
30. 由S、Cl 及Fe、Co、Ni 等过渡元素组成的新型材料有着广泛的用途,回答下列问题:(1)、钴元素基态原子的电子排布式为 , P、S、Cl的第一电离能由大到小顺序为。(2)、SCl2 分子中的中心原子杂化轨道类型是 , 该分子空间构型为。(3)、Fe、Co、Ni 等过渡元素易与CO 形成配合物,化学式遵循18 电子规则: 中心原子的价电子数加上配体提供的电子数之和等于18,如Ni 与CO 形成配合物化学式为Ni (CO)4 , 则Fe 与CO 形成配合物化学式为。Ni(CO)4中σ键与π键个数比为 , 已知: Ni(CO)4熔点-19.3℃,沸点43℃,则Ni (CO)4为晶体。(4)、已知NiO 的晶体结构如图1所示。

①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO 晶体中镍原子填充在氧原子形成的体空隙中。
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm 和69pm。则熔点 :MgO NiO( 填“ >”、“<”或“=”),理由是。
③一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充O2-形成的正三角形空隙中(如图2),已知O2-的半径为am,每平方米面积上分散的NiO 的质量为g。(用a、NA表示)
31. X、Y、Z、M、W、Q、R是7种短周期元素,其原子半径及主要化合价如下:元素代号
X
Y
Z
M
W
Q
R
原子半径/nm
0.186
0.143
0.104
0.099
0.070
0.066
0.032
主要化合价
+1
+3
+6,﹣2
+7,﹣1
+5,﹣3
﹣2
+1
完成下列填空:
(1)、上述元素中,金属性最强的在周期表中的位置是;X、Y、Q各自形成的简单离子中,离子半径由大到小的顺序是(填离子符号)。W和R按原子个数比1﹕4构成的阳离子所含的化学键是。
(2)、表中所列4种第三周期元素的最高价氧化物的水化物碱性最弱的是(填化学式),其电离方程式为。
(3)、M与Z相比,非金属性较强的是(填元素名称),请从原子结构的角度说明理由。(4)、在稀硫酸中,KMnO4和H2O2能发生氧化还原反应,反应方程式如下: KMnO4+
KMnO4+  H2O2+
H2O2+  H2SO4 →
H2SO4 →  K2SO4+
K2SO4+  MnSO4+
MnSO4+  O2↑+
O2↑+  H2O
H2O请配平 , 当有0.5 mol H2O2参加此反应,电子转移的个数为。
32. 我国考古人员在秦陵挖掘的宝剑,到现们还是锋利无比,原因是剑锋上面覆盖了一层铬。(1)、写出Cr的外围电子排布式。与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是。(2)、根据下表Cr原子的能级电离能(I:k]/mol)数据,解释原子逐级电离能增大的原因:。I1
I2
I3
I4
I5
I6
I7
652.9
1590.6
2987
4743
6702
8744.9
15455
(3)、CrCl3·6H2O有三种水合异构体,蓝绿色的[Cr(H2O)5Cl]Cl2·6H2O,绿色的[Cr(H2O)4Cl2]Cl·6H2O和紫色的 , 其中Cr的配体水分子也可以被NH3置换,如[Cr(NH3)5Cl]2+ , 则NH3的VSEPR模型为 , N的杂化方式为 , 写出NH3的一种等电子体。(4)、CrO3能将CH3CH2OH氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是。(5)、Cr晶体的堆积模型是体心立方堆积。①下列金属晶体也采取这种堆积模型的是
A.Na
B.Po
C.Mg
D.Cu
②晶胞中Cr的配位数为
③已知Cr的相对原子质量为M,Cr的密度为ρg/cm3 , 阿伏加德罗常数用NA表示,则Cr的原子半径是 pm.(写出表达式即可)
33. 短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素是碳元素。请回答下列问题: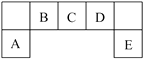 (1)、B元素在周期表中的位置:;请写出该原子的电子式:;其原子核外电子能量最高的能级是:。(2)、比较A、C、D元素简单离子半径的大小:>> (填微粒符号)。(3)、F与D同主族且相邻,请比较D的氢化物和F的氢化物稳定性大小: (用化学式表示)。(4)、E单质常用湿润的淀粉碘化钾试纸检验。有学生对淀粉碘化钾进行了实验探究。在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,立刻会看到溶液变蓝色,这是因为(请结合氧化还原反应知识解释相关现象,下同)。在所形成的蓝色溶液中,再滴加亚硫酸钠溶液,发现蓝色逐渐消失,这是因为。据此分析,I2、ClO-、SO42-氧化性有弱到强的顺序排列为。34. 工业上可用微生物处理含KCN的废水。第一步是微生物在氧气充足的条件下,将KCN转化成KHCO3和NH3(最佳pH:6.7~7.2);第二步是把氨转化为硝酸:NH3+202 HNO3+H2O
(1)、B元素在周期表中的位置:;请写出该原子的电子式:;其原子核外电子能量最高的能级是:。(2)、比较A、C、D元素简单离子半径的大小:>> (填微粒符号)。(3)、F与D同主族且相邻,请比较D的氢化物和F的氢化物稳定性大小: (用化学式表示)。(4)、E单质常用湿润的淀粉碘化钾试纸检验。有学生对淀粉碘化钾进行了实验探究。在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,立刻会看到溶液变蓝色,这是因为(请结合氧化还原反应知识解释相关现象,下同)。在所形成的蓝色溶液中,再滴加亚硫酸钠溶液,发现蓝色逐渐消失,这是因为。据此分析,I2、ClO-、SO42-氧化性有弱到强的顺序排列为。34. 工业上可用微生物处理含KCN的废水。第一步是微生物在氧气充足的条件下,将KCN转化成KHCO3和NH3(最佳pH:6.7~7.2);第二步是把氨转化为硝酸:NH3+202 HNO3+H2O请完成下列填空:
(1)、写出第一步反应的化学反应方程式 , 第二步反应的还原产物是(填写化学式)。(2)、在KCN中,属于短周期且原子半径最大的元素是 , 氮原子最外层电子的运动状态有种。水的电子式是。(3)、比较碳和氮元素非金属性强弱,化学反应方程式为。(4)、室握下,0.1mol/LK2CO3、KCN、KHCO3溶液均呈碱性且pH依次减小,在含等物质的量的KCN、KHCO3混合溶液中,阴离子(除OH-)浓度由大到小的顺序是。(5)、工业上还常用氯氧化法处凡含KCN的废水:KCN+2KOH+Cl2=KOCN+2KCl+H2O,2KOCN+4KOH+3Cl2→N2+6KCl+2CO2+2H2O。两扮相比,微生物处理法的优点与缺点是(各写一条)。优点:;缺点:。
35.某合成氨厂利用附近化工厂副产品CaSO4设计了以下制备(NH4)2SO4的工艺流程:

请回答以下问题:
(1)、天然气中的H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: .(2)、工业上在500℃左右使用铁触媒作为催化剂合成NH3:
①铁触媒中含有Fe3+ , 则Fe在元素周期表中的位置为
②500℃时,合成塔中的反应为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ/mol在密闭条下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是(填字母编号).
 (3)、沉淀池中反应的化学方程式为(4)、在上述流程中可以循环使用的X是(填化学式),从(NH4)2SO4溶液中获得(NH4)2SO4晶体操作的步骤是加热浓缩、、过滤、洗涤、干燥.
(3)、沉淀池中反应的化学方程式为(4)、在上述流程中可以循环使用的X是(填化学式),从(NH4)2SO4溶液中获得(NH4)2SO4晶体操作的步骤是加热浓缩、、过滤、洗涤、干燥.
-