高考二轮复习知识点:元素周期表的结构及其应用5
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外电子数之和为21.下列关系正确的是( )
W
X
Y
Z
A、氢化物沸点:W<Z B、氧化物对应水化物的酸性:Y>W C、化合物熔点:Y2X3<YZ3 D、简单离子的半径:Y<X2. X、Y、Z、Q、E、M六种元素中,X的原子的基态价电子排布式为2s2 , Y的基态原子核外有5种运动状态不同的电子,Z元素的两种同位素原子通常作为示踪原子研究生物化学反应和测定文物的年代,Q是元素周期表中电负性最大的元素,E的阳离子通常存在于硝石、明矾和草木灰中,M的原子序数比E大1。下列说法正确的是( )A、EYQ4 中阴离子中心原子的杂化方式为sp3杂化 B、X、Y元素的第一电离能大小关系:X<Y C、ZO32-的空间构型为V形 D、MZ2仅含离子键,可用于制备乙炔3. 短周期主族元素W、X、Y、Z、R原子序数依次增大。考古时利用W的一种同位素测定一些文物的年代,X是地壳中含量最多的元素,Y、Z的质子数分别是W、X的质子数的2倍。下列说法错误的是( )A、Y单质可以与WX2发生置换反应 B、可以用澄清的石灰水鉴别WX2与ZX2 C、原子半径:Y>Z>R;简单离子半径:Z>X>Y D、工业上常用电解熔融的Y与R形成的化合物的方法制取Y4. 均为短周期主族元素,三种元素位于同一周期, 两元素的最外层电子数之和与Z的最外层电子数相等,Y的最外层电子数是内层电子数的3倍。下列说法正确的是( )A、原子半径: B、最简单氢化物的热稳定性: C、XZ为共价化合物 D、 的单质均不能与水发生反应5. X、Y、Z、M、R、Q是短周期主族元素,已知常温下X单质为黄色固体,Y是无机非金属材料的主角,Z焰色反应呈黄色。部分信息如下表:X
Y
Z
M
R
Q
原子半径/nm
0.104
0.117
0.186
0.074
0.099
0.143
主要化合价
-2
+4,-4
+1
-2
-1,+7
+3
下列说法正确的是:( )
A、R在元素周期表中的位置是第二周期ⅥA族 B、X、Y均可跟M形成化合物,但它们的成键类型不相同 C、Z、R、Q最高价氧化物的水化物能相互反应 D、Y元素氧化物是用于制造半导体器件、太阳能电池的材料6. X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,X、W为同一主族元素,Y是地壳中含量最高的元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断不正确的是( ) A、反应③为工业制粗硅的原理 B、Z位于元素周期表第三周期ⅡA族 C、4种元素的原子中,Y原子的半径最小 D、工业上通过电解乙来制取Z7. 短周期元素 X、Y、Z、M的原子序数依次增大,它们组成一种团簇分子Z2M2Y4(YX)2 , 结构如图所示。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的 ,下列说法正确的是( )
A、反应③为工业制粗硅的原理 B、Z位于元素周期表第三周期ⅡA族 C、4种元素的原子中,Y原子的半径最小 D、工业上通过电解乙来制取Z7. 短周期元素 X、Y、Z、M的原子序数依次增大,它们组成一种团簇分子Z2M2Y4(YX)2 , 结构如图所示。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的 ,下列说法正确的是( ) A、简单离子半径: Z>M>Y B、常温下Z和M的单质均能溶于浓硝酸 C、X与Y结合形成的化合物是离子化合物 D、工业上常用电解Z的氯化物的熔融液来制取Z单质8. 短周期主族元素W、X、Y、Z的原子序数依次增大,由这四种元素形成的一种盐溶液,遇到FeCl3溶液呈现血红色,该盐溶液与NaOH在加热条件下会生成一种能使湿润的红色石蕊试纸变蓝的气体。下列说法正确的是( )A、W和X形成的化合物在常温下均为气态 B、X元素可以形成多种具有广泛用途的单质 C、X和Z的最高价氧化物对应水化物都是强酸 D、Y的简单离子与Z的简单离子具有相同的电子层结构9. 短周期主族元素X、Y、Z、W、Q原子序数依次增大,Y元素最外层电子数是其电子层数的3倍,Q与Y同主族,X与Y构成的化合物可引起光化学烟雾,Z、W、Q的最高价氧化物的水化物两两之间均能发生反应。下列说法正确的是( )A、简单氢化物的沸点:Y<Q B、W的氧化物可作耐高温材料 C、简单离子半径最大的为Z D、气态氢化物的稳定性:Y<X10. 硒是人体必需的微量元素,图是硒在周期表中的信息,关于硒元素的说法错误的是( )
A、简单离子半径: Z>M>Y B、常温下Z和M的单质均能溶于浓硝酸 C、X与Y结合形成的化合物是离子化合物 D、工业上常用电解Z的氯化物的熔融液来制取Z单质8. 短周期主族元素W、X、Y、Z的原子序数依次增大,由这四种元素形成的一种盐溶液,遇到FeCl3溶液呈现血红色,该盐溶液与NaOH在加热条件下会生成一种能使湿润的红色石蕊试纸变蓝的气体。下列说法正确的是( )A、W和X形成的化合物在常温下均为气态 B、X元素可以形成多种具有广泛用途的单质 C、X和Z的最高价氧化物对应水化物都是强酸 D、Y的简单离子与Z的简单离子具有相同的电子层结构9. 短周期主族元素X、Y、Z、W、Q原子序数依次增大,Y元素最外层电子数是其电子层数的3倍,Q与Y同主族,X与Y构成的化合物可引起光化学烟雾,Z、W、Q的最高价氧化物的水化物两两之间均能发生反应。下列说法正确的是( )A、简单氢化物的沸点:Y<Q B、W的氧化物可作耐高温材料 C、简单离子半径最大的为Z D、气态氢化物的稳定性:Y<X10. 硒是人体必需的微量元素,图是硒在周期表中的信息,关于硒元素的说法错误的是( )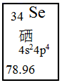 A、位于第四周期 B、质量数为34 C、原子最外层有6个电子 D、相对原子质量为78.9611. 科学家合成出了一种高效电解质(如图所示),其中W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,X和Q位于同一主族,Y和Z的原子序数之和与Q相等。下列说法正确的是( )
A、位于第四周期 B、质量数为34 C、原子最外层有6个电子 D、相对原子质量为78.9611. 科学家合成出了一种高效电解质(如图所示),其中W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,X和Q位于同一主族,Y和Z的原子序数之和与Q相等。下列说法正确的是( ) A、Q的氧化物对应水化物为强酸 B、阴离子中所有原子均满足8电子稳定结构 C、元素非金属性的顺序为Z>Y>X D、W和X形成的化合物溶于水呈碱性12. W、X、Y、Z均为短周期元素,原子序数依次增加,W的原子核最外层电子数是次外层的2倍,X−、Y+具有相同的电子层结构,Z的阴离子不能发生水解反应。下列说法正确的是( )A、原子半径:Y>Z>X>W B、简单氢化物的稳定性:X>Z>W C、最高价氧化物的水化物的酸性:W>Z D、X可分别与W、Y形成化合物,其所含的化学键类型相同13. X、Y、Z、W为原子序数依次增大的短周期元素,X的单质在标准状况下为气体且密度约为1.428 g·L-1 , Y的氢氧化物是一种强碱,Z与Y位于同周期且Z原子的最外层电子数是内层电子数的一半,W与X同一主族。下列说法正确的是( )A、原子半径:W>Z>Y>X B、Y、W不可能形成化合物Y2W2 C、简单氢化物的稳定性:X>Z>W D、Y2X2可与WX2发生氧化还原反应14. 短周期主族元素 X、Y、Z、W、Q 的原子序数依次增大,其中 X 原子的质子总数与电子 层数相等,X、Z 同主族,Y、W 同主族,且 Y、W 形成的一种化合物甲是常见的大气污 染物。下列说法正确的是( )A、简单离子半径:Z<Y<W<Q B、Y 能分别与 X、Z、W 形成具有漂白性的化合物 C、非金属性:W<Q,故 W、Q 的氢化物的水溶液的酸性:W<Q D、电解 Z 与 Q 形成的化合物的水溶液可制得 Z 的单质15. X、Y、Z、W、R是5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍, Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )A、元素Y、Z、W离子具有相同的电子层结构,其半径依次增大 B、元素Z、W、R的最高价氧化物对应水化物两两之间可以反应 C、元素X与元素Y可以形成两种共价化合物,且这两种化合物只有一种类型的共价键 D、元素Y、R分别与元素X形成的化合物的热稳定性:XmY<XnR16. 短周期主族元素W,X,Y,Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的。由W,Y,Z三种元素形成的一种液态化合物甲溶于水后,可观察到剧烈反应,液面上有白雾形成,并有能使品红溶液褪色的有刺激性气味的气体逸出,向溶液中滴加AgNO3溶液。有不溶于稀硝酸的白色沉淀析出。下列说法错误的是( )A、Y的简单氢化物的热稳定性比Z的弱 B、W与X的简单离子具有相同的电子层结构 C、化合物甲已被用作某种锂电池的还原剂 D、Z2W是某种氧化性弱酸的酸酐17. W、X、Y、Z四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。化合物XW3能作制冷剂且其浓溶液可检验Z单质是否泄露,化合物YZ3能促进水的电离,则下列说法错误的是( )A、简单离子半径:r(Z)>r(X)>r(Y) B、Y的最高价氧化物对应的水化物为强碱 C、X2W4分子中既含极性键,又含非极性键 D、化合物XW3的水溶液能抑制水的电离18. 短周期主族元素W、X、Y和Z的原子序数依次增大,W的气态氢化物的水溶液可使酚酞变红,并且可与X的氢化物形成一种共价化合物。Y的离子半径是同周期主族元素中最小的,Z原子最外层电子数是其内层电子数的3/5,下列说法中一定正确的是( )A、W的氧化物对应水化物为强酸,具有强氧化性。 B、简单离子半径:Y<W<X<Z C、简单氢化物沸点:Z<X D、工业上一般采取电解Y的熔融氯化物来生产Y的单质19. 主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为9;W与Y同族;W与Z形成的离子化合物可与水反应,其生成的气体可使酸性高锰酸钾溶液退色。下列说法正确的是( )A、生物分子以W为骨架 B、X的氧化物常用于焊接钢轨 C、Z的硫化物常用于点豆腐 D、Y的氧化物是常见的半导体材料20. 短周期元素W、X、Y、Z、Q的原子序数依次增大,W的阴离子的核外电子数与氦相同。X的一种核素在考古时常用来鉴定一些文物的年代,Y在地壳中含量最多,Z原子半径为短周期中最大,Q存在由多原子分子构成的单质。下列说法错误的是( )A、W与X可形成3种以上化合物 B、W、X、Y只能形成1种二元酸 C、Y与Z可形成既含共价键又含离子键的化合物 D、X、Q的最高价氧化物对应水化物的酸性:Q>X21. 短周期元素X、Y、Z、W原子序数依次增加,其中只有Z为金属元素,X、W为同一主族元素,X元素原子的L层电子是K层的两倍;点燃条件下,Z的单质在 X与Y形成的最高价化合物甲中能发生反应生成化合物乙和X的单质。下列判断错误的是( )A、W的单质可做半导体材料 B、Z可能位于元素周期表第三周期ⅡA族 C、4种元素的原子中,Y原子的半径最小 D、工业上通过电解化合物乙来制取Z的单质22. X、Y、Z、W为短周期主族元素。X、Z、W形成的一种离子是检验Fe3+的常用试剂,X、Y形成的化合物YX3 , 常用作汽车安全气囊的气体发生剂,W的单质在加热条件下可与X、Z的最高价含氧酸反应。下列叙述正确的是( )A、原子半径:Z>Y>W>X B、YX3属于离子化合物 C、Y、Z形成的化合物中只含有离子键 D、Z的氧化物对应的水化物属于强酸23. 如图所示的X、Y、Z、W四种短周期元素的原子最外层电子数之和为22,下列说法正确的是( )
A、Q的氧化物对应水化物为强酸 B、阴离子中所有原子均满足8电子稳定结构 C、元素非金属性的顺序为Z>Y>X D、W和X形成的化合物溶于水呈碱性12. W、X、Y、Z均为短周期元素,原子序数依次增加,W的原子核最外层电子数是次外层的2倍,X−、Y+具有相同的电子层结构,Z的阴离子不能发生水解反应。下列说法正确的是( )A、原子半径:Y>Z>X>W B、简单氢化物的稳定性:X>Z>W C、最高价氧化物的水化物的酸性:W>Z D、X可分别与W、Y形成化合物,其所含的化学键类型相同13. X、Y、Z、W为原子序数依次增大的短周期元素,X的单质在标准状况下为气体且密度约为1.428 g·L-1 , Y的氢氧化物是一种强碱,Z与Y位于同周期且Z原子的最外层电子数是内层电子数的一半,W与X同一主族。下列说法正确的是( )A、原子半径:W>Z>Y>X B、Y、W不可能形成化合物Y2W2 C、简单氢化物的稳定性:X>Z>W D、Y2X2可与WX2发生氧化还原反应14. 短周期主族元素 X、Y、Z、W、Q 的原子序数依次增大,其中 X 原子的质子总数与电子 层数相等,X、Z 同主族,Y、W 同主族,且 Y、W 形成的一种化合物甲是常见的大气污 染物。下列说法正确的是( )A、简单离子半径:Z<Y<W<Q B、Y 能分别与 X、Z、W 形成具有漂白性的化合物 C、非金属性:W<Q,故 W、Q 的氢化物的水溶液的酸性:W<Q D、电解 Z 与 Q 形成的化合物的水溶液可制得 Z 的单质15. X、Y、Z、W、R是5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍, Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )A、元素Y、Z、W离子具有相同的电子层结构,其半径依次增大 B、元素Z、W、R的最高价氧化物对应水化物两两之间可以反应 C、元素X与元素Y可以形成两种共价化合物,且这两种化合物只有一种类型的共价键 D、元素Y、R分别与元素X形成的化合物的热稳定性:XmY<XnR16. 短周期主族元素W,X,Y,Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的。由W,Y,Z三种元素形成的一种液态化合物甲溶于水后,可观察到剧烈反应,液面上有白雾形成,并有能使品红溶液褪色的有刺激性气味的气体逸出,向溶液中滴加AgNO3溶液。有不溶于稀硝酸的白色沉淀析出。下列说法错误的是( )A、Y的简单氢化物的热稳定性比Z的弱 B、W与X的简单离子具有相同的电子层结构 C、化合物甲已被用作某种锂电池的还原剂 D、Z2W是某种氧化性弱酸的酸酐17. W、X、Y、Z四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。化合物XW3能作制冷剂且其浓溶液可检验Z单质是否泄露,化合物YZ3能促进水的电离,则下列说法错误的是( )A、简单离子半径:r(Z)>r(X)>r(Y) B、Y的最高价氧化物对应的水化物为强碱 C、X2W4分子中既含极性键,又含非极性键 D、化合物XW3的水溶液能抑制水的电离18. 短周期主族元素W、X、Y和Z的原子序数依次增大,W的气态氢化物的水溶液可使酚酞变红,并且可与X的氢化物形成一种共价化合物。Y的离子半径是同周期主族元素中最小的,Z原子最外层电子数是其内层电子数的3/5,下列说法中一定正确的是( )A、W的氧化物对应水化物为强酸,具有强氧化性。 B、简单离子半径:Y<W<X<Z C、简单氢化物沸点:Z<X D、工业上一般采取电解Y的熔融氯化物来生产Y的单质19. 主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为9;W与Y同族;W与Z形成的离子化合物可与水反应,其生成的气体可使酸性高锰酸钾溶液退色。下列说法正确的是( )A、生物分子以W为骨架 B、X的氧化物常用于焊接钢轨 C、Z的硫化物常用于点豆腐 D、Y的氧化物是常见的半导体材料20. 短周期元素W、X、Y、Z、Q的原子序数依次增大,W的阴离子的核外电子数与氦相同。X的一种核素在考古时常用来鉴定一些文物的年代,Y在地壳中含量最多,Z原子半径为短周期中最大,Q存在由多原子分子构成的单质。下列说法错误的是( )A、W与X可形成3种以上化合物 B、W、X、Y只能形成1种二元酸 C、Y与Z可形成既含共价键又含离子键的化合物 D、X、Q的最高价氧化物对应水化物的酸性:Q>X21. 短周期元素X、Y、Z、W原子序数依次增加,其中只有Z为金属元素,X、W为同一主族元素,X元素原子的L层电子是K层的两倍;点燃条件下,Z的单质在 X与Y形成的最高价化合物甲中能发生反应生成化合物乙和X的单质。下列判断错误的是( )A、W的单质可做半导体材料 B、Z可能位于元素周期表第三周期ⅡA族 C、4种元素的原子中,Y原子的半径最小 D、工业上通过电解化合物乙来制取Z的单质22. X、Y、Z、W为短周期主族元素。X、Z、W形成的一种离子是检验Fe3+的常用试剂,X、Y形成的化合物YX3 , 常用作汽车安全气囊的气体发生剂,W的单质在加热条件下可与X、Z的最高价含氧酸反应。下列叙述正确的是( )A、原子半径:Z>Y>W>X B、YX3属于离子化合物 C、Y、Z形成的化合物中只含有离子键 D、Z的氧化物对应的水化物属于强酸23. 如图所示的X、Y、Z、W四种短周期元素的原子最外层电子数之和为22,下列说法正确的是( ) A、X、Y、W三种元素最低价氢化物的沸点依次升高 B、Z、X、W三种元素氧化物对应水化物的酸性依次增强 C、由X、W和氢三种元素形成的化合物中只含共价键 D、X、Z形成的二元化合物是一种新型无机非金属材料24. 四种短周期主族元素A、B、M、N的原子序数依次增大,其原子的最外层电子数之和为19,B和A元素原子核的质子数之比为2:1,B和M的电子数之差为4。下列说法正确的是( )A、原子半径大小:N>M>B>A B、A,M,N三种元素形成的气态氢化物中最稳定的是N的气态氢化物 C、由A元素形成的单质的熔沸点都很高,硬度都很大 D、M、N所形成的氧化物的水化物都是强酸25. 短周期主族元素W、X,Y、Z的原子序数依次增大,四种原子的最外层电子数之和为18,W与Y同主族,X原子的最外层电子数等于周期数,Z的单质在常温下为气体,下列说法正确的是( )A、最简单氢化物的稳定性:Z>W>Y B、原子半径:Y>X>W C、X与Z形成的化合物的水溶液能使红色石蕊试纸变蓝 D、Y的氧化物既能与碱反应,也能与酸反应,属于两性氧化物26. 短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数。X与Y位于不同周期,X与W的最高化合价之和为8,元素Z的单质是目前使用量最大的主族金属元素单质。下列说法中正确的是( )A、化合物YX4W溶于水后,得到的溶液呈碱性 B、化合物YW3为共价化合物,电子式为
A、X、Y、W三种元素最低价氢化物的沸点依次升高 B、Z、X、W三种元素氧化物对应水化物的酸性依次增强 C、由X、W和氢三种元素形成的化合物中只含共价键 D、X、Z形成的二元化合物是一种新型无机非金属材料24. 四种短周期主族元素A、B、M、N的原子序数依次增大,其原子的最外层电子数之和为19,B和A元素原子核的质子数之比为2:1,B和M的电子数之差为4。下列说法正确的是( )A、原子半径大小:N>M>B>A B、A,M,N三种元素形成的气态氢化物中最稳定的是N的气态氢化物 C、由A元素形成的单质的熔沸点都很高,硬度都很大 D、M、N所形成的氧化物的水化物都是强酸25. 短周期主族元素W、X,Y、Z的原子序数依次增大,四种原子的最外层电子数之和为18,W与Y同主族,X原子的最外层电子数等于周期数,Z的单质在常温下为气体,下列说法正确的是( )A、最简单氢化物的稳定性:Z>W>Y B、原子半径:Y>X>W C、X与Z形成的化合物的水溶液能使红色石蕊试纸变蓝 D、Y的氧化物既能与碱反应,也能与酸反应,属于两性氧化物26. 短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数。X与Y位于不同周期,X与W的最高化合价之和为8,元素Z的单质是目前使用量最大的主族金属元素单质。下列说法中正确的是( )A、化合物YX4W溶于水后,得到的溶液呈碱性 B、化合物YW3为共价化合物,电子式为 C、Y、Z形成的一种化合物强度高,热膨胀系数小,是良好的耐热冲击材料
D、原子半径大小:W>Z>Y>X
27. 卤族元素有关性质比较正确的是( )A、稳定性:HF>HCl>HBr>HI B、氧化性:F2<Cl2<Br2<I2 C、熔沸点:F2>Cl2>Br2>I2 D、还原性:F﹣>Cl﹣>Br﹣>I﹣28. 短周期非金属元素甲~戊在元素周期表中位置如表所示,分析正确的是( )
C、Y、Z形成的一种化合物强度高,热膨胀系数小,是良好的耐热冲击材料
D、原子半径大小:W>Z>Y>X
27. 卤族元素有关性质比较正确的是( )A、稳定性:HF>HCl>HBr>HI B、氧化性:F2<Cl2<Br2<I2 C、熔沸点:F2>Cl2>Br2>I2 D、还原性:F﹣>Cl﹣>Br﹣>I﹣28. 短周期非金属元素甲~戊在元素周期表中位置如表所示,分析正确的是( )甲
乙
丙
丁
戊
A、非金属性:甲<丙 B、戊可能是硫元素 C、最外层电子数:乙<丙 D、原子半径:乙<丁<戊29. W、X、Y、Z是四种短周期非金属元素,原子序数依次增大。W是原子半径最小的元素,X、Y原子核外L层的电子数之比为3∶4,X与Z同主族,W、X、Y、Z的最外层电子数之和为17。下列说法正确的是( )A、单质的沸点:X>Z B、X与W形成的化合物中一定只有极性键 C、氢化物的热稳定性:Z>Y D、W、X、Y可形成离子化合物二、非选择题
-
30. X、Y、Z、W、Q、R 是周期表中前 36 号元素,核电荷数依次增大,其中 X、Y、Z、 W 都是元素周期表中短周期元素。X 为非金属元素,且 X 原子的核外成对电子数是未成对电子数的 2 倍,Z 的次外层电子数是最外层电子数的 ,W 原子的 s 电子与 p 电子数相等,Q 是前四周期中电负性最小的元素,R 的原子序数为 29。 回答下列问题:(1)、X的最高价氧化物对应的水化物分子中,中心原子采取杂化。(2)、化合物 XZ 与 Y 的单质分子互为 , 1mol XZ 中含有π键的数目为。(3)、W 的稳定离子核外有种运动状态的电子。W元素的第一电离能比其同周期 相邻元素的第一电离能高,其原因是:。(4)、Q 的晶体结构如图所示,则在单位晶胞中 Q 原子的个数为 , 晶体的配位数是。
 (5)、R元素的基态原子的核外电子排布式为;Y 与 R 形成某 种化合物的晶胞结构如图所示,已知该晶体的密度为ρg·cm-3 , 阿伏加德罗常数的数值为 NA , 则该晶体中 R 原子和 Y 原子之间的最短距离为cm。(只写计算式)
(5)、R元素的基态原子的核外电子排布式为;Y 与 R 形成某 种化合物的晶胞结构如图所示,已知该晶体的密度为ρg·cm-3 , 阿伏加德罗常数的数值为 NA , 则该晶体中 R 原子和 Y 原子之间的最短距离为cm。(只写计算式) 31. 下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素。
31. 下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素。 (1)、②、⑥两元素的气态氢化物中更稳定的是 (写化学式)。(2)、在上述六种元素中,原子半径最大的是(写元素符号)。(3)、写出①的气态氢化物与它的最高价氧化物对应的水化物发生反应的离子方程式为。32. 呋喃(
(1)、②、⑥两元素的气态氢化物中更稳定的是 (写化学式)。(2)、在上述六种元素中,原子半径最大的是(写元素符号)。(3)、写出①的气态氢化物与它的最高价氧化物对应的水化物发生反应的离子方程式为。32. 呋喃( )和吡咯(
)和吡咯(  )是较常见的杂环化合物呋喃通过下列反应可转化为吡咯:
)是较常见的杂环化合物呋喃通过下列反应可转化为吡咯: 
回答下列问题:
(1)、呋喃和吡咯所含元素中:电负性最大的是(填元素符号),第一电离能最大的元素的基态原子电子排布图是。(2)、呋喃分子中,碳原子的杂化方式是 , 1mol吡咯分子中含molσ键。(3)、NH3与H2O可与Zn2+形成配合物[Zn(NH3)3(H2O)]2+。与Zn2+形成配位键的原子是(填元素符号);H2O的空间构型为;写出一种与NH3互为等电子体的阳离子:(填化学式)。(4)、NH3的相对分子质量比N2O的小,但其沸点却比N2O的高,其主要原因是。(5)、ZnO晶体随着环境条件的改变能形成不同结构的晶体,其中一种的晶胞结构如图所示,已知该ZnO晶体密度为ag·cm-3 , NA表示阿伏加德罗常数。则该晶体中与Zn2+等距离且最近的Zn2+共有个,该ZnO晶胞中相邻两个O2-之间的距离为nm。 33. 下表是元素周期表的一部分,表中的每个编号表示一种元素。请根据要求回答问题。
33. 下表是元素周期表的一部分,表中的每个编号表示一种元素。请根据要求回答问题。 (1)、①的原子核外最外层电子数为。(2)、③、⑥两种元素中,原子半径较小的是(填元素符号)。(3)、气态氢化物的热稳定性⑤⑥(填“>“或”<“)。
(1)、①的原子核外最外层电子数为。(2)、③、⑥两种元素中,原子半径较小的是(填元素符号)。(3)、气态氢化物的热稳定性⑤⑥(填“>“或”<“)。
(4)、②的最高价氧化物对应的水化物的化学式是。34. 下表列出了①~⑥六种元素在元素周期表中的位置。
请回答下列问题:
(1)、表中④的元素符号是;(2)、①元素的最高价氧化物的化学式为;(3)、②和⑤的最简单氢化物稳定性最强的是(填化学式)。(4)、③的最高价氧化物对应的水化物与⑥的氢化物在溶液中相互反应的离子方程式是。35. X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。(1)、R元素在周期表中的位置是 , 其基态原子的价层电子排布图为。(2)、下图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是(填标号)。 (3)、化合物(XH2=X=O)分子中X原子杂化轨道类型是 , 1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为。(4)、Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为。(5)、某R的氧化物晶胞结构如下图所示,该物质的化学式为。已知该晶体密度为ρg/cm3 , 距离最近的两个原子的距离为d pm,则R的相对原子质量为。 (阿伏加德罗常数为NA)
(3)、化合物(XH2=X=O)分子中X原子杂化轨道类型是 , 1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为。(4)、Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为。(5)、某R的氧化物晶胞结构如下图所示,该物质的化学式为。已知该晶体密度为ρg/cm3 , 距离最近的两个原子的距离为d pm,则R的相对原子质量为。 (阿伏加德罗常数为NA) (6)、X形成的一种常见单质,性质硬而脆,原因是。
(6)、X形成的一种常见单质,性质硬而脆,原因是。