高考二轮复习知识点:元素周期表的结构及其应用4
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. NA是阿伏加德罗常数的值,下列说法正确的是( )A、16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA B、22.4L(标准状况)氩气含有的质子数为18NA C、92.0g甘油(丙三醇)中含有羟基数为1.0NA D、1.0molCH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA2. 二氧化碳甲烷化可以缓解能源危机。CO2在催化剂的作用下与H2制备甲烷的反应机理如图所示。下列说法错误的是( )
 A、Ni属于d区元素,Cu属于ds区元素 B、Ni和La2O3是该反应的催化剂,二者不能改变反应物的平衡转化率 C、H2→2H·的过程吸收热量,使用恰当的催化剂可以使该过程放热 D、该过程总反应的化学方程式为:4H2+CO2 CH4+2H2O3. 表中元素①~⑧均为短周期元素:
A、Ni属于d区元素,Cu属于ds区元素 B、Ni和La2O3是该反应的催化剂,二者不能改变反应物的平衡转化率 C、H2→2H·的过程吸收热量,使用恰当的催化剂可以使该过程放热 D、该过程总反应的化学方程式为:4H2+CO2 CH4+2H2O3. 表中元素①~⑧均为短周期元素:元素
①
②
③
④
⑤
⑥
⑦
⑧
原子半径/
0.066
0.160
0.152
0.077
0.099
0.186
0.070
0.082
最外层电子数
6
2
3
常见化合价
+1
-4,+4
-1,+7
-3、+5
焰色实验
黄色
下列说法错误的是( )
A、③单质能在①或⑦的单质中燃烧 B、②和⑥元素原子的失电子能力强弱可通过单质与水反应比较 C、⑤分别与⑦、⑧形成的最简单分子的空间构型相同 D、第一电离能大小顺序:4. 一种用于合成治疗免疫疾病药的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述错误的是( ) A、Y的氢化物的熔点一定低于Z的氢化物的熔点 B、Z元素能形成两种氢化物 C、WZX与WXQ化学键类型相同 D、W2Q2Z3溶液与Q的最高价氧化物对应的水化物反应有黄色浑浊和无色气体产生5. 短周期主族元素X、Y、Z位于同一周期,它们的原子最外层电子数之和为11,Y的族序数等于其周期序数,Z的阳离子半径在同周期元素的阳离子中最大。下列说法正确的是( )A、化合物Z2O2是只含离子键的离子化合物 B、工业上制备Y的单质可以电解熔融的YX3 C、最高价氧化物对应水化物的碱性:Z>Y D、常温下,Y和Z的单质均能溶于浓硫酸6. 短周期主族元素A、B、C、D原子序数依次增大,A、B的简单离子具有相同的电子层结构, B的原子半径是短周期主族元素原子中最大的,C的原子序数是A的2倍,D与B形成的离子化合物的水溶液呈中性。下列说法一定正确的是( )A、A与C在周期表中位于同一主族 B、氢元素与A能形成的化合物不止一种 C、B的简单离子的半径比A的大 D、C最高价氧化物对应水化物一定是一种强酸7. 主族元素V、W、X、Y、Z的原子序数依次增大,且均不大于20,ZX3Y4W12是硅酸盐,X2+和W2-的电子层结构相同,V与Y的质子数之和等于Z的质子数。下列判断正确的是( )A、Y在周期表中位于第3周期第IV族 B、V2W 含极性键和非极性键 C、最简氢化物的热稳定性:Y>V D、原子半径:Z>Y>X>W8. 已知X、Y、Z、W是四种原子序数依次增大的短周期元素,其中只有W是金属。X、Z是人体中含量最高的物质的两种组成元素,Y与Z处于相邻位置。则下列说法中正确的是( )A、由W、Y、Z三种元素组成的盐的水溶液一定是中性的 B、X和Y的单质之间的化合反应不需要任何条件即可发生 C、X、Z、W组成的化合物可能不溶于水 D、W的氢氧化物一定是强碱9. “21世纪是钛的世纪”,钛是一种性能非常优越的金属,在能源、航天、医疗等方面有重要应用。已知钛原子序数为22,位于第四周期,最外层有2个电子。则其次外层电子数为( )A、2 B、8 C、10 D、1810. 第75号元素铼是广泛用于航空发动机涡轮叶片的稀土元素。从信息中不能获取的是( )A、质量数 B、周期表中位置 C、质子数 D、核外电子排布11. 常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为0.01 mol/L)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是( )
A、Y的氢化物的熔点一定低于Z的氢化物的熔点 B、Z元素能形成两种氢化物 C、WZX与WXQ化学键类型相同 D、W2Q2Z3溶液与Q的最高价氧化物对应的水化物反应有黄色浑浊和无色气体产生5. 短周期主族元素X、Y、Z位于同一周期,它们的原子最外层电子数之和为11,Y的族序数等于其周期序数,Z的阳离子半径在同周期元素的阳离子中最大。下列说法正确的是( )A、化合物Z2O2是只含离子键的离子化合物 B、工业上制备Y的单质可以电解熔融的YX3 C、最高价氧化物对应水化物的碱性:Z>Y D、常温下,Y和Z的单质均能溶于浓硫酸6. 短周期主族元素A、B、C、D原子序数依次增大,A、B的简单离子具有相同的电子层结构, B的原子半径是短周期主族元素原子中最大的,C的原子序数是A的2倍,D与B形成的离子化合物的水溶液呈中性。下列说法一定正确的是( )A、A与C在周期表中位于同一主族 B、氢元素与A能形成的化合物不止一种 C、B的简单离子的半径比A的大 D、C最高价氧化物对应水化物一定是一种强酸7. 主族元素V、W、X、Y、Z的原子序数依次增大,且均不大于20,ZX3Y4W12是硅酸盐,X2+和W2-的电子层结构相同,V与Y的质子数之和等于Z的质子数。下列判断正确的是( )A、Y在周期表中位于第3周期第IV族 B、V2W 含极性键和非极性键 C、最简氢化物的热稳定性:Y>V D、原子半径:Z>Y>X>W8. 已知X、Y、Z、W是四种原子序数依次增大的短周期元素,其中只有W是金属。X、Z是人体中含量最高的物质的两种组成元素,Y与Z处于相邻位置。则下列说法中正确的是( )A、由W、Y、Z三种元素组成的盐的水溶液一定是中性的 B、X和Y的单质之间的化合反应不需要任何条件即可发生 C、X、Z、W组成的化合物可能不溶于水 D、W的氢氧化物一定是强碱9. “21世纪是钛的世纪”,钛是一种性能非常优越的金属,在能源、航天、医疗等方面有重要应用。已知钛原子序数为22,位于第四周期,最外层有2个电子。则其次外层电子数为( )A、2 B、8 C、10 D、1810. 第75号元素铼是广泛用于航空发动机涡轮叶片的稀土元素。从信息中不能获取的是( )A、质量数 B、周期表中位置 C、质子数 D、核外电子排布11. 常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为0.01 mol/L)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是( ) A、简单离子半径:Z>Y>W>X B、W的气态氢化物空间构型一定是三角锥型 C、X可形成两种氧化物 D、Z的单质具有强氧化性和漂白性12. 短周期元素W、X、Y和Z在元素周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
A、简单离子半径:Z>Y>W>X B、W的气态氢化物空间构型一定是三角锥型 C、X可形成两种氧化物 D、Z的单质具有强氧化性和漂白性12. 短周期元素W、X、Y和Z在元素周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )W
X
Y
Z
A、非金属性:W > X B、简单离子的半径:Y < X C、气态氢化物的热稳定性:W > X D、最高价氧化物对应水化物的酸性:Y > W13. 一种由短周期主族元素组成的化合物(如图所示),可用于制备各种高性能防腐蚀材料。其中W、X、Y、Z的原子序数依次增大且占据三个不同周期。下列说法错误的是( ) A、简单离子半径:Z>X>Y B、工业上电解熔融态X与Y组成的化合物制备单质Y C、Z的最高价氧化物对应的水化物为强酸 D、该化合物中Z不满足8电子稳定结构14. 一种新型漂白剂 如图 可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( )
A、简单离子半径:Z>X>Y B、工业上电解熔融态X与Y组成的化合物制备单质Y C、Z的最高价氧化物对应的水化物为强酸 D、该化合物中Z不满足8电子稳定结构14. 一种新型漂白剂 如图 可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( ) A、W、X元素的简单离子半径相比,W简单离子的半径小 B、该化合物中W、Y、Z元素的粒子均满足8电子稳定结构 C、W、Z元素的简单离子均能促进水的电离 D、工业电解熔融的WX来制得W15. 下列叙述正确的是( )A、第二周期主族元素原子半径从左到右依次减小 B、第三周期元素的氯化物所属晶体类型相同 C、短周期第IA族与VIIA族元素构成的物质均含离子键 D、元素周期表中位于金属与非金属分界线附近的元素属于过渡元素16. X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,其单质与水反应后溶液能使酚酞试液变为浅红色,X、W为同一主族元素,Y是地壳中含量最高的元素。甲、乙、丙分别为X、Z、W形成的最高价氧化物。下列判断错误的是( )
A、W、X元素的简单离子半径相比,W简单离子的半径小 B、该化合物中W、Y、Z元素的粒子均满足8电子稳定结构 C、W、Z元素的简单离子均能促进水的电离 D、工业电解熔融的WX来制得W15. 下列叙述正确的是( )A、第二周期主族元素原子半径从左到右依次减小 B、第三周期元素的氯化物所属晶体类型相同 C、短周期第IA族与VIIA族元素构成的物质均含离子键 D、元素周期表中位于金属与非金属分界线附近的元素属于过渡元素16. X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,其单质与水反应后溶液能使酚酞试液变为浅红色,X、W为同一主族元素,Y是地壳中含量最高的元素。甲、乙、丙分别为X、Z、W形成的最高价氧化物。下列判断错误的是( ) A、W位于元素周期表第三周期ⅣA族 B、原子半径:r(Z)˃r(W)>r(Y)>r(X) C、丁为CO,反应③为工业制粗硅的原理 D、X、W简单氢化物的沸点: X < W17. 已知:锶(38Sr)与镁元素同主族,与碘元素同周期。下列说法错误的是( )A、Sr位于元素周期表第五周期第ⅡA族 B、原子半径: C、相同条件下,Sr与水反应比Rb的更剧烈 D、碱性:18. 镓(31Ga)与K位于元素周期表中同一周期,下列关于Ga的说法错误的是( )A、质子数为31 B、原子半径比K的大 C、位于元素周期表第ⅢA族 D、 的碱性比 强19. 短周期元素R、X、Y、Z、W原子序数依次递增,R、Z、W不同周期,原子序数:X+Z=W+2R。近日,我国学者以XZ2和Y2为主要原料合成了物质M,其结构简式如图。下列说法正确的是( )
A、W位于元素周期表第三周期ⅣA族 B、原子半径:r(Z)˃r(W)>r(Y)>r(X) C、丁为CO,反应③为工业制粗硅的原理 D、X、W简单氢化物的沸点: X < W17. 已知:锶(38Sr)与镁元素同主族,与碘元素同周期。下列说法错误的是( )A、Sr位于元素周期表第五周期第ⅡA族 B、原子半径: C、相同条件下,Sr与水反应比Rb的更剧烈 D、碱性:18. 镓(31Ga)与K位于元素周期表中同一周期,下列关于Ga的说法错误的是( )A、质子数为31 B、原子半径比K的大 C、位于元素周期表第ⅢA族 D、 的碱性比 强19. 短周期元素R、X、Y、Z、W原子序数依次递增,R、Z、W不同周期,原子序数:X+Z=W+2R。近日,我国学者以XZ2和Y2为主要原料合成了物质M,其结构简式如图。下列说法正确的是( ) A、气态氢化物稳定性:Y>Z B、X、Y的氧化物的水化物均为弱酸 C、X、Y、Z分别与R可形成18e-分子 D、工业上,电解熔融W与Z的化合物制得W的单质20. 科学家合成一种化合物是很多表面涂层的重要成分,其结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,只有X、Y在同一周期。下列说法正确的是( )
A、气态氢化物稳定性:Y>Z B、X、Y的氧化物的水化物均为弱酸 C、X、Y、Z分别与R可形成18e-分子 D、工业上,电解熔融W与Z的化合物制得W的单质20. 科学家合成一种化合物是很多表面涂层的重要成分,其结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,只有X、Y在同一周期。下列说法正确的是( )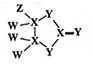 A、X的氢化物均为气体 B、原子半径:X<Y C、Y与W形成的所有化合物仅含有极性共价键 D、ZY2 作为一种高效安全绿色杀菌剂,在自来水消毒等方面应用广泛21. 下列说法正确的是( )A、H2S的还原性和热稳定性都比HCl强 B、元素硅、锗都位于金属元素与非金属元素的交界处,其单质都可以用作半导体材料 C、若X+和Y—的核外电子层结构相同,则原子序数:Y>X D、同主族元素Ca和Ba分别位于第四周期和第六周期,碱性:Ca(OH)2>Ba(OH)222. 117号元素Ts的原子最外层电子数是7,下列说法错误的是( )A、Ts是第七周期第ⅦA族元素 B、还原性:I−<Ts− C、原子半径:I<Ts D、中子数为176的Ts的核素符号:23. X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物 的结构式如图所示。下列说法错误的是( )
A、X的氢化物均为气体 B、原子半径:X<Y C、Y与W形成的所有化合物仅含有极性共价键 D、ZY2 作为一种高效安全绿色杀菌剂,在自来水消毒等方面应用广泛21. 下列说法正确的是( )A、H2S的还原性和热稳定性都比HCl强 B、元素硅、锗都位于金属元素与非金属元素的交界处,其单质都可以用作半导体材料 C、若X+和Y—的核外电子层结构相同,则原子序数:Y>X D、同主族元素Ca和Ba分别位于第四周期和第六周期,碱性:Ca(OH)2>Ba(OH)222. 117号元素Ts的原子最外层电子数是7,下列说法错误的是( )A、Ts是第七周期第ⅦA族元素 B、还原性:I−<Ts− C、原子半径:I<Ts D、中子数为176的Ts的核素符号:23. X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物 的结构式如图所示。下列说法错误的是( ) A、Z与W形成的化合物熔点高 B、Y与Z能形成多种化合物 C、X的氢化物的沸点一定小于Z的氢化物 D、化合物 中所有原子均满足8电子稳定结构24. 如图是一种新型离子化合物,该物质由两种阳离子和两种阴离子构成,其中有一种 18 电子离子和两种 10 电子离子。W、X、Y、Z 均为短周期元素,且均不在同一主族。下列说法错误的是( )
A、Z与W形成的化合物熔点高 B、Y与Z能形成多种化合物 C、X的氢化物的沸点一定小于Z的氢化物 D、化合物 中所有原子均满足8电子稳定结构24. 如图是一种新型离子化合物,该物质由两种阳离子和两种阴离子构成,其中有一种 18 电子离子和两种 10 电子离子。W、X、Y、Z 均为短周期元素,且均不在同一主族。下列说法错误的是( )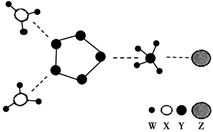 A、X 与 W 形成的化合物沸点高于 X 同族元素与 W 形成的化合物 B、Z 的最高价氧化物对应水化物的酸性比 Y 的强 C、Y 气态氢化物的稳定性比 X 的强 D、如图化合物中,存在极性共价键和非极性共价键25. 下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是( )A、4.03 米大口径碳化硅反射镜 B、2022 年冬奥会聚氨酯速滑服 C、能屏蔽电磁波的碳包覆银纳米线 D、“玉兔二号”钛合金筛选网轮26. 短周期主族元素X、Y、Z、.W原子序数依次增大,X的单质在空气中的体积分数最大,Y在周期表中所处的族序数等于周期数, Z的原子序数是X的两倍,Y、Z的最外层电子数之和与W的相等。下列说法错误的是( )A、原子半径: r(Y)>r(Z)>r(X) B、X的简单气态氢化物的热稳定性比Z的强 C、Z的最高价氧化物对应水化物的酸性比W的弱 D、Y、W形成的化合物是目前工业上电解制备Y单质的原料27. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其电子层数的2倍,Y是地壳中含量最多的金属元素,Z与X属于同一主族,W原子的最外层电子数与Y原子的最外层电子数相差3。下列说法正确的是( )A、原子半径:r(W)>r(Z)>r(Y)>r(X) B、X和W组成的化合物中只含共价键 C、Z的最高价氧化物对应的水化物的酸性比X的强 D、Y的简单阳离子和W的简单阴离子具有相同的电子层结构28. 化合物
A、X 与 W 形成的化合物沸点高于 X 同族元素与 W 形成的化合物 B、Z 的最高价氧化物对应水化物的酸性比 Y 的强 C、Y 气态氢化物的稳定性比 X 的强 D、如图化合物中,存在极性共价键和非极性共价键25. 下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是( )A、4.03 米大口径碳化硅反射镜 B、2022 年冬奥会聚氨酯速滑服 C、能屏蔽电磁波的碳包覆银纳米线 D、“玉兔二号”钛合金筛选网轮26. 短周期主族元素X、Y、Z、.W原子序数依次增大,X的单质在空气中的体积分数最大,Y在周期表中所处的族序数等于周期数, Z的原子序数是X的两倍,Y、Z的最外层电子数之和与W的相等。下列说法错误的是( )A、原子半径: r(Y)>r(Z)>r(X) B、X的简单气态氢化物的热稳定性比Z的强 C、Z的最高价氧化物对应水化物的酸性比W的弱 D、Y、W形成的化合物是目前工业上电解制备Y单质的原料27. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其电子层数的2倍,Y是地壳中含量最多的金属元素,Z与X属于同一主族,W原子的最外层电子数与Y原子的最外层电子数相差3。下列说法正确的是( )A、原子半径:r(W)>r(Z)>r(Y)>r(X) B、X和W组成的化合物中只含共价键 C、Z的最高价氧化物对应的水化物的酸性比X的强 D、Y的简单阳离子和W的简单阴离子具有相同的电子层结构28. 化合物 是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z 为原子序数依次增大的短周期元素。下列叙述正确的是( ) A、原子半径:X>Y>Z B、元素的非金属性:X<Y<Z C、该化合物中Z的化合价均呈-2 价 D、该化合物中 X、Y、Z都满足 8 电子稳定结构29. 短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z 为原子序数依次增大的短周期元素。下列叙述正确的是( ) A、原子半径:X>Y>Z B、元素的非金属性:X<Y<Z C、该化合物中Z的化合价均呈-2 价 D、该化合物中 X、Y、Z都满足 8 电子稳定结构29. 短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( ) A、Y单质的熔点高于X单质 B、元素非金属性强弱的顺序为W>Y>Z C、Z元素在自然界中既有游离态也有化合态 D、1moIW 和X形成的化合物中可能含有4mol离子
A、Y单质的熔点高于X单质 B、元素非金属性强弱的顺序为W>Y>Z C、Z元素在自然界中既有游离态也有化合态 D、1moIW 和X形成的化合物中可能含有4mol离子二、非选择题
-
30. 有八种短周期主族元素 ,其中 随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。 的最高价氧化物对应水化物溶液(浓度均为 )的 与原子序数的关系如图2所示。

根据上述信息回答下列问题:
(1)、g在元素周期表中的位置是。(2)、比较 的简单离子半径大小为<<(用离子符号表示); 的最高价氧化物对应的水化物酸性较强的是(用化学式表示)。(3)、下列可作为比较e和f金属性强弱的依据是___________(填字母)。A、测等浓度相应氯化物水溶液的 B、测两种元素单质的硬度和熔、沸点 C、比较单质作还原剂时失去的电子数目的多少 D、比较单质与同浓度盐酸反应的剧烈程度(4)、由元素 组成的剧毒化合物 不慎泄露时,通常用过氧化氢溶液处理,以减少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为。31. 云南师范大学杨智教授合成了一种以醚键桥联型双吡啶羧酸为配体的金属镍配合物(分子式为C12H10N2NiO7·2H2O)。本配合物具有一定的光催化效果,在光催化还原二氧化碳方面具有潜在的应用价值。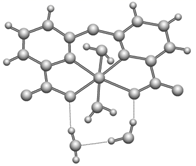 (1)、基态Ni原子的电子排布式为 , 元素周期表中与镍位置相邻的某元素原子的最外层只有一个电子,则该元素位于元素周期表的区,此区元素的价电子层结构特点是(n-1)dns。(2)、该配合物的配位原子为 , 配位原子轨道杂化类型为。(3)、NH3、PH3、AsH3的沸点由高到低的顺序为 , 用物质结构理论加以解释:。NH3、PH3、AsH3分子的键角分别为107.3°、93.3°、91.8°,其键角逐渐减小的原因是。(4)、NiO晶体的结构与NaCl相同,已知NiO晶体的密度约为6.7 g·cm-3 , 则可计算出Ni2+与最邻近的O2-的距离为cm(写出计算式,无需化简)。32. 铜及其化合物是生活、生产中运用广泛的材料。(1)、铜元素位于周期表第列,铜易导电的原因是 , 基态 原子中核外能量不同的电子有种。(2)、铜的第二电离能(填“大于”或“小于”)锌的第二电离能,其原因是。(3)、合成氨工业常用醋酸二氨合铜(I) 溶液吸收对氨合成的催化剂有毒害作用的
(1)、基态Ni原子的电子排布式为 , 元素周期表中与镍位置相邻的某元素原子的最外层只有一个电子,则该元素位于元素周期表的区,此区元素的价电子层结构特点是(n-1)dns。(2)、该配合物的配位原子为 , 配位原子轨道杂化类型为。(3)、NH3、PH3、AsH3的沸点由高到低的顺序为 , 用物质结构理论加以解释:。NH3、PH3、AsH3分子的键角分别为107.3°、93.3°、91.8°,其键角逐渐减小的原因是。(4)、NiO晶体的结构与NaCl相同,已知NiO晶体的密度约为6.7 g·cm-3 , 则可计算出Ni2+与最邻近的O2-的距离为cm(写出计算式,无需化简)。32. 铜及其化合物是生活、生产中运用广泛的材料。(1)、铜元素位于周期表第列,铜易导电的原因是 , 基态 原子中核外能量不同的电子有种。(2)、铜的第二电离能(填“大于”或“小于”)锌的第二电离能,其原因是。(3)、合成氨工业常用醋酸二氨合铜(I) 溶液吸收对氨合成的催化剂有毒害作用的①比较 和 的沸点大小,并说明原因:。
② 中C的杂化类型为。
(4)、晶胞的两个基本要素。
①原子坐标参数:晶胞内部各微粒的相对位置。 的晶胞结构如图所示,其中原子坐标参数: ; ; 。则D处微粒的坐标参数为。
②晶胞参数:描述晶胞的大小和形状。若 与 的最短距离为 ,则晶胞的边长为 ,设 为阿伏加德罗常数的值,该化合物的密度为(用含a、 的代数式表示)g∙cm-3。
33. 硫及其化合物在生产、生活中用途广泛。(1)、S在元素周期表中的位置。(2)、 是工业制备 的主要反应之一、①提高 平衡转化率,可采取的措施。
② ℃时,2L密闭容器中,充入 和 , 随时间的变化如表:
时间/s
0
1
2
3
4
5
……
2
1.4
1.0
0.65
0.4
0.4
……
℃时,该反应的化学平衡常数(K)的代数式是。
(3)、工业上用 溶液吸收烟气中的低浓度 ,形成吸收液后再采用阳离子膜电解法控制电压,电解吸收液可制成产品S和 。工作原理示意图如图1,阴极区和阳极区的pH随时间的变化关系如图2:
①阳极反应的电极反应物是。
②结合电极反应式,说明阴极区pH升高的原因。
34. A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素。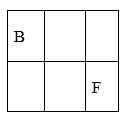 (1)、BF2的结构式为。(2)、D和F的氢化物中沸点较高的是(填化学式)。(3)、实验室制取G2气体的离子方程式为。(4)、在微电子工业中,C的最简单气态氢化物可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为。(5)、FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为。(6)、火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为。35. 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
(1)、BF2的结构式为。(2)、D和F的氢化物中沸点较高的是(填化学式)。(3)、实验室制取G2气体的离子方程式为。(4)、在微电子工业中,C的最简单气态氢化物可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为。(5)、FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为。(6)、火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为。35. 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
已知:① 是一种不溶于水易溶于强酸的沉淀;②已知 , 的 。
(1)、Ni的原子序数为28,则它在周期表中的位置为 , 写出H2O2的结构式。(2)、步骤②,向滤液I中加入适量 溶液的目的是除去Cu2+和 ,其中除去Cu2+的离子方程式为;加 之前需控制pH不能太低的目的是。(3)、步骤③的目的是除去Fe和Cr,温度不能太高的原因是。若在 时,调pH=4除去铁,此时溶液中 。(4)、粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度镍,下列叙述正确的是___(已知:氧化性Fe2+<Ni2+<Cu2+)A、粗镍作阳极,纯镍作阴极 B、阳极发生还原反应,其电极反应式: C、电解过程中,阳极质量的减少与阴极质量的增加相等 D、电解后,溶液中存在的金属阳离子只有Cu2+和 E、电解后,电解槽底部的阳极泥中只有Cu和Pt