高考二轮复习知识点:元素周期表的结构及其应用3
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. X、Y、Z、W、M是五种常见的短周期主族元素,其原子半径随原子序数的变化如图所示,已知Y的原子核外电子总数是W的4倍,M、X的最外层电子数之和与W的最外层电子数相等。下列说法错误的是( )
 A、M与X形成的化合物能与水剧烈反应 B、X和W的最高价氧化物对应水化物的碱性强弱: C、W与Z形成的气态分子中各原子最外层均达到 稳定结构 D、X与Y形成的化合物 中含有共价键2. 某种锂盐的结构如图所示,其阴离子由W、X、Y、Z四种同周期主族元素构成,X原子的最外层电子数是W原子的次外层电子数的3倍,化合物中除Li+外其它原子均满足8电子稳定结构。下列说法正确的是( )
A、M与X形成的化合物能与水剧烈反应 B、X和W的最高价氧化物对应水化物的碱性强弱: C、W与Z形成的气态分子中各原子最外层均达到 稳定结构 D、X与Y形成的化合物 中含有共价键2. 某种锂盐的结构如图所示,其阴离子由W、X、Y、Z四种同周期主族元素构成,X原子的最外层电子数是W原子的次外层电子数的3倍,化合物中除Li+外其它原子均满足8电子稳定结构。下列说法正确的是( )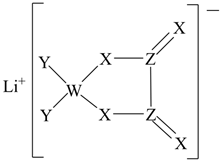 A、W位于第2周期IVA族 B、原子半径:Z>X>Y C、元素电负性:Y>Z>X D、最高化合价:Y>Z>W3. 铜的某种氧化物的晶胞结构如图所示。下列说法错误的是( )
A、W位于第2周期IVA族 B、原子半径:Z>X>Y C、元素电负性:Y>Z>X D、最高化合价:Y>Z>W3. 铜的某种氧化物的晶胞结构如图所示。下列说法错误的是( )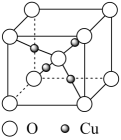 A、Cu位于元素周期表ds区 B、该晶胞中Cu的配位数为4 C、该物质的化学式为Cu2O D、该晶体属于离子晶体4. 下图是元素周期表的部分结构,其中W、X、Y、Z均为短周期主族元素,下列说法一定正确的是( )
A、Cu位于元素周期表ds区 B、该晶胞中Cu的配位数为4 C、该物质的化学式为Cu2O D、该晶体属于离子晶体4. 下图是元素周期表的部分结构,其中W、X、Y、Z均为短周期主族元素,下列说法一定正确的是( ) A、最高正价:W与Y相同 B、简单氢化物的沸点:W大于Y C、简单离子半径:X小于Z D、最高价氧化物的水化物的酸性:X小于Z5. X、Y、Z、R、W为原子序数依次增大的短周期元素,Z、W为同族元素,R是短周期中原子半径最大的主族元素。其中,X、Y、Z、W形成的化合物可表示为[YX4]+[XWZ4]-。下列说法错误的是( )A、R与X、Y、Z、W均可形成离子化合物 B、简单气态氢化物的稳定性:Z>Y C、X、Y、Z三种元素形成物质的水溶液只能呈酸性 D、[YX4]+为正四面体构型6. 前20号主族元素W、X、Y、Z的原子序数依次增大。已知X的单质既可与强碱反应,又可与强酸反应,W与Y位于同一主族,Z的K层电子数与N层相等, W、X、Y、Z四种元素的最外层电子数之和为13.下列说法正确的是( )A、原子半径由小到大的顺序: X< Y B、Y的最高价氧化物不能与酸溶液反应 C、X的单质不能从CuSO4溶液中置换出Cu D、ZW2既含非极性共价键又含离子键7. 在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出了如图CO2的转化过程。下列说法不正确的是( )
A、最高正价:W与Y相同 B、简单氢化物的沸点:W大于Y C、简单离子半径:X小于Z D、最高价氧化物的水化物的酸性:X小于Z5. X、Y、Z、R、W为原子序数依次增大的短周期元素,Z、W为同族元素,R是短周期中原子半径最大的主族元素。其中,X、Y、Z、W形成的化合物可表示为[YX4]+[XWZ4]-。下列说法错误的是( )A、R与X、Y、Z、W均可形成离子化合物 B、简单气态氢化物的稳定性:Z>Y C、X、Y、Z三种元素形成物质的水溶液只能呈酸性 D、[YX4]+为正四面体构型6. 前20号主族元素W、X、Y、Z的原子序数依次增大。已知X的单质既可与强碱反应,又可与强酸反应,W与Y位于同一主族,Z的K层电子数与N层相等, W、X、Y、Z四种元素的最外层电子数之和为13.下列说法正确的是( )A、原子半径由小到大的顺序: X< Y B、Y的最高价氧化物不能与酸溶液反应 C、X的单质不能从CuSO4溶液中置换出Cu D、ZW2既含非极性共价键又含离子键7. 在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出了如图CO2的转化过程。下列说法不正确的是( ) A、铜元素位于周期表中的 ds 区 B、步骤④中有化学键的断裂和形成 C、甲酸乙酯是该过程的催化剂 D、反应过程中,催化剂参与反应,改变了反应历程8. 短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为18,X、Z基态原子的p轨道上均有2个未成对电子,W与X位于同一主族。下列说法正确的是( )A、WX2分子为极性分子 B、元素电负性:Z>W C、原子半径:r(W)>r(Z)>r(Y) D、最高价氧化物水化物的酸性:Z>W9. 下图是短周期主族元素的单质及其化合物(或其溶液)的转化关系。已知X、Y、Z原子序数依次增大,A~F均为化合物,F为不含金属元素的含氧酸盐。下列说法正确的是( )
A、铜元素位于周期表中的 ds 区 B、步骤④中有化学键的断裂和形成 C、甲酸乙酯是该过程的催化剂 D、反应过程中,催化剂参与反应,改变了反应历程8. 短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为18,X、Z基态原子的p轨道上均有2个未成对电子,W与X位于同一主族。下列说法正确的是( )A、WX2分子为极性分子 B、元素电负性:Z>W C、原子半径:r(W)>r(Z)>r(Y) D、最高价氧化物水化物的酸性:Z>W9. 下图是短周期主族元素的单质及其化合物(或其溶液)的转化关系。已知X、Y、Z原子序数依次增大,A~F均为化合物,F为不含金属元素的含氧酸盐。下列说法正确的是( ) A、原子半径:X<Y<Z B、物质的稳定性:A>C C、E和F中存在的化学键类型完全相同 D、常温下,可以用铁质容器盛装E的浓溶液10. A、B、C、D、E五种元素原子序数逐渐增大,且均小于18,A的一种原子核内没有中子;在元素周期表中,C与B、E均相邻,B、C和E三种元素的原子最外层电子数之和为17;其中A与D为同族元素,原子半径A<C<B<E<D.下列说法正确的是( )A、B和E所形成的含氧酸均为强酸 B、BC和E三种元素可能位于同一周期 C、元素C的气态氢化物的沸点比元素E的气态氢化物的沸点高 D、D的最高价氧化物对应水化物中含有离子键和非极性共价键11. 短周期主族元素W、X、Y、Z的原子序数依次增大,W原子的最外层电子数是内层电子总数的一半,W、Z同主族;X与Y在周期表中处于相邻位置,Y的简单氢化物的水溶液可用于刻蚀玻璃,下列说法正确的是( )A、Y是形成最高价含氧酸酸性最强的元素 B、W常用作手机电池的电极材料 C、简单离子半径Y<Z D、X、Z两种元素形成的化合物只含离子键12. W、X、Y、Z为四种原子序数依次增大的短周期非金属主族元素,其中只有X、Y位于同周期,四种元素可形成航天飞船的火箭推进剂[XW4]+[ZY4]- , W与X的最外层电子数之和等于Y的最外层电子数。下列说法不正确的是( )A、W、X、Y、Z的最高正价均等于其最外层电子数 B、X的液态简单氢化物常用来做制冷剂,与其存在分子间氢键有关 C、简单阴离子还原性:W>X>Y D、W、X、Z均可与Y形成两种或两种以上的化合物13. X、Y、Z、W是原子序数依次增大的4种短周期主族元素。X广泛存在于无机物和有机物中,Y是地壳中含量最多的元素,Z的单质常温下和氢气混合会发生爆炸,工业上电解W的熔融氧化物来制取W。下列有关说法一定正确的是( )A、原子半径:W>X>Y>Z B、简单氢化物的沸点:Z>Y C、Z和W的简单离子都能促进水的电离 D、W分别与X、Y、Z形成的化合物中化学键类型相同14. T、W、X、Y、Z是原子序数依次增大的五种短周期主族元素且分布于三个周期,W元素可形成硬度最大的单质,X是地壳中含量最多的元素,Y与X同主族。下列说法错误的是( )A、原子半径:r(Z)>r(Y)>r(X)>r(W)>r(T) B、Y、Z的最高价氧化物对应水化物的酸性:Y<Z C、第一电离能:W<X D、W、X可分别与T形成含有非极性键的极性分子15. X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。说法错误的是( )
A、原子半径:X<Y<Z B、物质的稳定性:A>C C、E和F中存在的化学键类型完全相同 D、常温下,可以用铁质容器盛装E的浓溶液10. A、B、C、D、E五种元素原子序数逐渐增大,且均小于18,A的一种原子核内没有中子;在元素周期表中,C与B、E均相邻,B、C和E三种元素的原子最外层电子数之和为17;其中A与D为同族元素,原子半径A<C<B<E<D.下列说法正确的是( )A、B和E所形成的含氧酸均为强酸 B、BC和E三种元素可能位于同一周期 C、元素C的气态氢化物的沸点比元素E的气态氢化物的沸点高 D、D的最高价氧化物对应水化物中含有离子键和非极性共价键11. 短周期主族元素W、X、Y、Z的原子序数依次增大,W原子的最外层电子数是内层电子总数的一半,W、Z同主族;X与Y在周期表中处于相邻位置,Y的简单氢化物的水溶液可用于刻蚀玻璃,下列说法正确的是( )A、Y是形成最高价含氧酸酸性最强的元素 B、W常用作手机电池的电极材料 C、简单离子半径Y<Z D、X、Z两种元素形成的化合物只含离子键12. W、X、Y、Z为四种原子序数依次增大的短周期非金属主族元素,其中只有X、Y位于同周期,四种元素可形成航天飞船的火箭推进剂[XW4]+[ZY4]- , W与X的最外层电子数之和等于Y的最外层电子数。下列说法不正确的是( )A、W、X、Y、Z的最高正价均等于其最外层电子数 B、X的液态简单氢化物常用来做制冷剂,与其存在分子间氢键有关 C、简单阴离子还原性:W>X>Y D、W、X、Z均可与Y形成两种或两种以上的化合物13. X、Y、Z、W是原子序数依次增大的4种短周期主族元素。X广泛存在于无机物和有机物中,Y是地壳中含量最多的元素,Z的单质常温下和氢气混合会发生爆炸,工业上电解W的熔融氧化物来制取W。下列有关说法一定正确的是( )A、原子半径:W>X>Y>Z B、简单氢化物的沸点:Z>Y C、Z和W的简单离子都能促进水的电离 D、W分别与X、Y、Z形成的化合物中化学键类型相同14. T、W、X、Y、Z是原子序数依次增大的五种短周期主族元素且分布于三个周期,W元素可形成硬度最大的单质,X是地壳中含量最多的元素,Y与X同主族。下列说法错误的是( )A、原子半径:r(Z)>r(Y)>r(X)>r(W)>r(T) B、Y、Z的最高价氧化物对应水化物的酸性:Y<Z C、第一电离能:W<X D、W、X可分别与T形成含有非极性键的极性分子15. X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。说法错误的是( ) A、Q位于第三周期IA族 B、X,Y,Z三种元素组成的化合物可能是盐或碱 C、简单离子半径:M-﹥Q+﹥R2+ D、Z与M的最高价氧化物对应水化物均为强酸16. 已知前四周期元素X、Y、Z、M、Q和R在周期表中的相对位置如下所示,其中M的单质为淡黄色固体,常存在于火山喷口附近。下列说法错误的是( )
A、Q位于第三周期IA族 B、X,Y,Z三种元素组成的化合物可能是盐或碱 C、简单离子半径:M-﹥Q+﹥R2+ D、Z与M的最高价氧化物对应水化物均为强酸16. 已知前四周期元素X、Y、Z、M、Q和R在周期表中的相对位置如下所示,其中M的单质为淡黄色固体,常存在于火山喷口附近。下列说法错误的是( )Q
R
Z
M
X
Y
A、的还原性强于 B、能从中置换出 C、X、Y的单质可以作半导体材料 D、Y、Z、M的氧化物对应水化物的酸性依次增强17. 短周期主族元素X、Y、Z、W、Q、R的原子序数依次增大,其中只有Z和W是金属元素。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z的原子半径是短周期主族元素中最大的,Q与Y同族。下列说法一定正确的是( )A、简单离子半径的大小顺序:W>Q>R>Y B、W的最高价氧化物的水化物是两性氢氧化物 C、X的最简单氢化物沸点低于Y的最简单氢化物沸点 D、Z2Y2和QY2均具有漂白性,且漂白原理相同18. 已知X、Y、Z、W为原子序数依次增大的短周期元素,X、W不在同一周期,且W的最外层电子数是Y最外层电子数的 , 其形成的一种化合物结构如图所示,下列叙述错误的是( ) A、原子半径W>X>Y>Z B、X的氧化物水化物可能是弱酸 C、简单氢化物水溶液的pH: X>Y>Z D、WY2性质活泼,溶于水可得到对应酸溶液19. 化合物ZYX4的结构如图所示,其中X、Y、Z是原子序数依次增大的短周期元素, X是周期表中原子半径最小的元素。下列叙述中错误的是 ( )
A、原子半径W>X>Y>Z B、X的氧化物水化物可能是弱酸 C、简单氢化物水溶液的pH: X>Y>Z D、WY2性质活泼,溶于水可得到对应酸溶液19. 化合物ZYX4的结构如图所示,其中X、Y、Z是原子序数依次增大的短周期元素, X是周期表中原子半径最小的元素。下列叙述中错误的是 ( ) A、是短周期元素中金属性最强的元素 B、的最高价氧化物对应水化物呈弱酸性 C、与能形成使湿润的红色石蕊试纸变蓝的气体 D、化合物可能有强还原性20. 某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍;W的最高价氧化物对应的水化物具有两性,W、X.Y三种简单离子的核外电子排布相同。下列说法正确的是( )A、X与Y、Y与Z均可形成X2Y2、Z2Y2型化合物 B、离子半径:X>W>Y>Z C、X、Y、Z组成的化合物中只含有离子键 D、常温常压下熔点:X2Y<Z2Y21. X、Y、Z、W是四种短周期主族元素,其在元素周期表中的相对位置如图所示。Z的最高正价与最低负价的代数和为4。下列说法正确的是( )
A、是短周期元素中金属性最强的元素 B、的最高价氧化物对应水化物呈弱酸性 C、与能形成使湿润的红色石蕊试纸变蓝的气体 D、化合物可能有强还原性20. 某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍;W的最高价氧化物对应的水化物具有两性,W、X.Y三种简单离子的核外电子排布相同。下列说法正确的是( )A、X与Y、Y与Z均可形成X2Y2、Z2Y2型化合物 B、离子半径:X>W>Y>Z C、X、Y、Z组成的化合物中只含有离子键 D、常温常压下熔点:X2Y<Z2Y21. X、Y、Z、W是四种短周期主族元素,其在元素周期表中的相对位置如图所示。Z的最高正价与最低负价的代数和为4。下列说法正确的是( )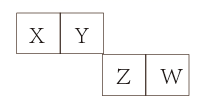 A、电负性: B、元素Y的最简单氢化物的中心原子Y采用 杂化 C、元素X和Z形成的化合物中可能所有原子都达到了8电子稳定结构 D、元素Z的氧化物对应水化物的酸性比Y的强22. 优氯净(C3N3O3Cl2Na)是常用的杀菌消毒剂。下列有关优氯净组成元素说法正确的是( )A、电负性:χ(O)>χ(N)>χ(C) B、原子半径:r(Cl)>r(Na)>r(O) C、O在周期表中的位置:第2周期IVA族 D、简单气态氢化物的热稳定性:NH3>H2O23. 现有5种短周期主族元素A、B、C、D、E,原子序数依次增大。其中A元素与其他元素都不在同一周期,A元素和B元素形成的一种碱性气体。A元素和C元素原子序数之和等于D元素原子序数。E元素最外层电子数是D元素最外层电子数的2倍,且E元素最高价氧化物对应水化物为一种强酸。下列说法正确的是( )A、简单离子半径大小:C>D>E B、E元素同一主族下一周期的元素可用于半导体材料 C、B元素对应简单氢化物沸点大于E元素对应简单氢化物,则非金属性B>E D、A和B元素组成的化合物BA5 , 属于共价化合物24. 根据物质的组成、结构等信息可以预测其性质或用途。下列预测中,明显不合理的是( )A、根据化合价预测,高铜酸钠( )与 可生成硫酸盐 B、根据组成预测,铝酸三钙( )溶于足量盐酸,生成白色沉淀 C、根据在周期表中位置预测,单质砷(第ⅤA族)是重要的半导体材料 D、根据结构预测,葡萄糖[ ]溶液中加入新制氢氧化铜,溶液呈绛蓝色25. 化学与科学、技术、生活密切相关,下列说法正确的是( )A、“中国天眼”的球面射电板由铝合金板制成,铝合金比纯铝的熔点低、硬度大 B、工业上常用硫化物沉淀法处理重金属废水,且不会产生二次污染 C、“神舟十一号”飞船使用的半导体材料GaAs可用SiO2代替 D、ⅢB族的17种稀土元素均属于d区元素26. 如表所示为元素周期表的一部分,其中X、Y、Z、W为短周期元素,T的单质常温下为液体。下列说法错误的是( )
A、电负性: B、元素Y的最简单氢化物的中心原子Y采用 杂化 C、元素X和Z形成的化合物中可能所有原子都达到了8电子稳定结构 D、元素Z的氧化物对应水化物的酸性比Y的强22. 优氯净(C3N3O3Cl2Na)是常用的杀菌消毒剂。下列有关优氯净组成元素说法正确的是( )A、电负性:χ(O)>χ(N)>χ(C) B、原子半径:r(Cl)>r(Na)>r(O) C、O在周期表中的位置:第2周期IVA族 D、简单气态氢化物的热稳定性:NH3>H2O23. 现有5种短周期主族元素A、B、C、D、E,原子序数依次增大。其中A元素与其他元素都不在同一周期,A元素和B元素形成的一种碱性气体。A元素和C元素原子序数之和等于D元素原子序数。E元素最外层电子数是D元素最外层电子数的2倍,且E元素最高价氧化物对应水化物为一种强酸。下列说法正确的是( )A、简单离子半径大小:C>D>E B、E元素同一主族下一周期的元素可用于半导体材料 C、B元素对应简单氢化物沸点大于E元素对应简单氢化物,则非金属性B>E D、A和B元素组成的化合物BA5 , 属于共价化合物24. 根据物质的组成、结构等信息可以预测其性质或用途。下列预测中,明显不合理的是( )A、根据化合价预测,高铜酸钠( )与 可生成硫酸盐 B、根据组成预测,铝酸三钙( )溶于足量盐酸,生成白色沉淀 C、根据在周期表中位置预测,单质砷(第ⅤA族)是重要的半导体材料 D、根据结构预测,葡萄糖[ ]溶液中加入新制氢氧化铜,溶液呈绛蓝色25. 化学与科学、技术、生活密切相关,下列说法正确的是( )A、“中国天眼”的球面射电板由铝合金板制成,铝合金比纯铝的熔点低、硬度大 B、工业上常用硫化物沉淀法处理重金属废水,且不会产生二次污染 C、“神舟十一号”飞船使用的半导体材料GaAs可用SiO2代替 D、ⅢB族的17种稀土元素均属于d区元素26. 如表所示为元素周期表的一部分,其中X、Y、Z、W为短周期元素,T的单质常温下为液体。下列说法错误的是( ) A、X、Y的单质均存在同素异形体 B、Y、Z的简单氢化物的稳定性依次递增 C、R的单质可用于制造半导体材料 D、Y、Z、W元素简单阴离子的半径大小:Y>Z>W27. 化合物M的结构如图。X、Y、Z、W为原子序数依次增大的短周期主族元素,Z原子最外层电子数是其电子层数的3倍。下列说法正确的是( )
A、X、Y的单质均存在同素异形体 B、Y、Z的简单氢化物的稳定性依次递增 C、R的单质可用于制造半导体材料 D、Y、Z、W元素简单阴离子的半径大小:Y>Z>W27. 化合物M的结构如图。X、Y、Z、W为原子序数依次增大的短周期主族元素,Z原子最外层电子数是其电子层数的3倍。下列说法正确的是( ) A、化合物M中各原子最外层均为2或8电子稳定结构 B、X与Y、Z、W都形成共价化合物 C、化合物WYX4 , 具有较强的氧化性 D、X、Y、Z三种元素可以形成 和
A、化合物M中各原子最外层均为2或8电子稳定结构 B、X与Y、Z、W都形成共价化合物 C、化合物WYX4 , 具有较强的氧化性 D、X、Y、Z三种元素可以形成 和二、多选题
-
28. 今年是门捷列夫发现元素周期律150周年,联合国将2019年定为“国际化学元素周期表年”。下列有关化学元素周期表的说法正确的是( )A、元素周期表共有18列 B、ⅦA 族元素的非金属性自上而下依次减弱 C、主族元素均呈现与其族数相同的最高化合价 D、第二周期主族元素的原子半径自左向右依次增大
三、非选择题
-
29. Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3 , 还含有少量Fe3O4、FeO、CoO、Al2O3)为原料制备Mn2O3的工艺流程如图。已知:

①25℃时相关物质的Ksp见下表。
物质
Fe(OH)2
Fe(OH)3
Al(OH)3
Mn(OH)2
Co(OH)2
Ksp
1×10-16.3
1×10-38.6
1×10-32.3
1×10-12.7
1.09×10-15
②氢氧化氧锰(MnOOH)难溶于水和碱性溶液;“沉淀池I”的条件下,Co2+不能被二氧化锰氧化。
(1)、Mn元素位于元素周期表第周期第族。(2)、向“沉淀池I”中加入MnO2 , MnO2的作用是;“滤渣2”的主要成分是(填化学式)。(3)、MnSO4转化为MnOOH的离子方程式为。(4)、MnSO4转化为MnOOH中“III.实验操作”包含过滤、洗涤、干燥。检验MnOOH是否洗涤干净,具体操作为。(5)、高纯度的MnOOH转化为Mn2O3的化学方程式为。(6)、在“沉淀池I”中,滴加氨水调节溶液的pH,使溶液中铝、铁元素完全沉淀,则理论上pH的最小值为(当溶液中某离子浓度c≤1.0×10-5mol·L-1时,可认为该离子沉淀完全)。30. 了解原子结构特点、理解元素周期律和物质的结构对学习物质的性质和用途至关重要。(1)、氧、氟、氮三种元素都可形成简单离子, 它们的离子半径最小的是(填离子符号),硅元素在元素周期表中的位置是。下列能表示硫原子3p轨道电子状态的是(填标号)。A.
 B.
B. C.
C. D.
D. (2)、写出化合物CO2的电子式 , CO2和SiO2是同一主族元素的最高正价氧化物, 常温下CO2为气体,SiO2为高熔点固体。请分析原因:。(3)、比较硫和氯性质的强弱。
(2)、写出化合物CO2的电子式 , CO2和SiO2是同一主族元素的最高正价氧化物, 常温下CO2为气体,SiO2为高熔点固体。请分析原因:。(3)、比较硫和氯性质的强弱。热稳定性: H2SHCl (选填 “<”、“> ” 或 “=”, 下同); 酸性:HClO4H2SO4;用一个离子方程式说明氯元素和硫元素非金属性的相对强弱:。
(4)、红酒中添加一定量的SO2可以防止酒液氧化, 这利用了SO2的性;已知 NaHSO3溶液呈酸性,而既能电离又能水解,说明在NaHSO3溶液中 c(H2SO3)c()(选填 “<”、“> ” 或 “=” )(5)、请预测:第二周期非金属元素形成的氢化物中化学键极性最大的是(填分子式),该物质在CCl4中的溶解度比在水中的溶解度(填 “大” 或 “小”)。31. 化合物X是由四种短周期元素组成的白色晶体,生活中常用作去污剂,消毒剂,某学习小组开展如下探究实验。
已知:气体A是两种气体的混合物,气体B、C均为纯净物,且B可使带火星的木条复燃。
回答下列问题:
(1)、固体A的化学式是 , 碱石灰吸收的气体是。(2)、化合物X是固体A与另一种常见化合物在稳定剂作用下两者化合而成,写出X的化学式。(3)、上图中气体C通入澄清石灰水生成10.0g沉淀的离子方程式是。(4)、常用硫酸酸化的高锰酸钾溶液来检测X的去污消毒品质,写出检验反应的化学反应方程式。(5)、X制备过程中以Na2SiO3为稳定剂,设计实验方案验证产品中是否混有 SiO。32. 四羰基镍[Ni(CO)4]主要用于制高纯镍粉,也用于制造塑料中间体。回答下列问题:(1)、Ni在周期表中的位置。Ni基态原子排布式中3d能级上未成对电子数为(2)、Ni(CO)4中三种元素电负性由小到大的顺序为(3)、Ni(CO)4为正四面体的配合物。它不溶于水,易溶于乙醇、乙醚等有机溶剂,原因是。1 mol Ni(CO)4中含有mol σ键。(4)、已知碳的一种单质结构如图1所示,层间距离为335 pm,层内的碳原子的核间距为142 pm。
①该单质的晶体类型为
②从图1中取出该物质的晶胞如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图2中原子1的坐标为(0,0,0),原子2的坐标为(1,1,1),则原子3和原子4的坐标分别为、。

③根据图1中所给的数据,阿伏加德罗常数的值为NA , 石墨的密度为g/cm3。(列出计算式)
33. Cr、Mn、Fe都属于黑色金属,回答下列问题。(1)、基态Cr原子的价层电子排布式是 , 基态Mn原子核外有种不同能量的电子,Fe元素位于周期表中区。(2)、纳米Fe因其表面活性常用作有机催化剂,如图所示:
①化合物M的熔沸点明显低于化合物N,其主要原因是。
②化合物N中C原子的杂化类型为 , 元素C、N、O的第一电离能由小到大的顺序为。
(3)、一种属于立方晶系的硫锰矿,其晶胞如图所示(●=Mn, =S)。在该晶胞中,硫原子的堆积方式为。
=S)。在该晶胞中,硫原子的堆积方式为。

a.简单立方堆积 b.体心立方堆积 c.面心立方最密堆积
(4)、已知上述晶胞中最近两个硫原子之间的距离为dÅ(1Å=10-10m),晶体密度为ρg·cm-3 , 则阿伏加德罗常数的值NA=(要求化简)。(5)、Cr是周期表中第VIB族元素,化合价可以是0~+6的整数价态。回答下列问题,某化合物的化学式为Na3CrO8 , 其阴离子结构可表示为 ,则Cr的化合价为。 呈四面体构型,结构为
,则Cr的化合价为。 呈四面体构型,结构为  , 由两个 四面体组成,这两个 四面体通过共用一个顶角氧原子彼此连接,结构为
, 由两个 四面体组成,这两个 四面体通过共用一个顶角氧原子彼此连接,结构为  。则由n(n>1)个 通过顶角氧原子连续的链式结构的化学式为。 34. X、Y、Z、W为元素周期表前四周期的元素,原子序数依次增大,X原子核外有6种不同运动状态的电子;Y原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;W位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题:(1)、X在元素周期表中的位置是。(2)、元素的第一电离能:XY(填“>”或“<”,下同);最简单气态氢化物的沸点:XY。(3)、Y的最高价氧化物对应水化物中酸根离子的空间构型是(用文字描述)。(4)、Z3+基态核外电子排布式为 , 用硫氰化钾溶液检验Z3+的离子方程式为 , 1molSCN-中含有molσ键,molπ键,与其互为等电子体的分子是(写两种分子式)。(5)、与W晶体的金属堆积相同的是___。A、Na B、Zn C、Ag D、Mg(6)、Fe、Co、Ni是三种重要的金属元素,三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为。CoO的面心立方晶胞如图,设阿伏加德罗常数的值为NA , 则CoO晶体的密度为g·cm-3。
。则由n(n>1)个 通过顶角氧原子连续的链式结构的化学式为。 34. X、Y、Z、W为元素周期表前四周期的元素,原子序数依次增大,X原子核外有6种不同运动状态的电子;Y原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;W位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题:(1)、X在元素周期表中的位置是。(2)、元素的第一电离能:XY(填“>”或“<”,下同);最简单气态氢化物的沸点:XY。(3)、Y的最高价氧化物对应水化物中酸根离子的空间构型是(用文字描述)。(4)、Z3+基态核外电子排布式为 , 用硫氰化钾溶液检验Z3+的离子方程式为 , 1molSCN-中含有molσ键,molπ键,与其互为等电子体的分子是(写两种分子式)。(5)、与W晶体的金属堆积相同的是___。A、Na B、Zn C、Ag D、Mg(6)、Fe、Co、Ni是三种重要的金属元素,三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为。CoO的面心立方晶胞如图,设阿伏加德罗常数的值为NA , 则CoO晶体的密度为g·cm-3。 35. 有8种短周期主族元素x、y、z、d、e、f、g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示,z、e、g、h的最高价氧化物对应水化物溶液(浓度均为0.01mol/L)的pH与原子序数的关系如图2所示。
35. 有8种短周期主族元素x、y、z、d、e、f、g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示,z、e、g、h的最高价氧化物对应水化物溶液(浓度均为0.01mol/L)的pH与原子序数的关系如图2所示。
根据判断出的元素回答下列问题:
(1)、f在周期表中的位置是;(2)、y、z、d的氢化物中最稳定的是(写化学式);(3)、x与y形成的多种化合物中,最简单的化合物的空间构型是;(4)、描述e的单质在空气中燃烧的现象:;(5)、锌元素对婴儿及青少年的智力和身体发育有重要的作用,被称为生命火花。利用恒电势电解e的溴化物(eBr)的水溶液间接将葡萄糖[ ]氧化为葡萄糖酸[ ],进而制取葡萄糖酸锌,装置如图所示。
①钛网与直流电源的极相连;
②石墨电极的电极反应式为;
③写出生成葡萄糖酸的化学反应方程式:。
-