高考二轮复习知识点:元素周期表的结构及其应用2
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. W、X、Y、Z为原子序数依次增大的短周期主族元素,Y的原子序数等于W与X的原子序数之和,Z的最外层电子数为K层的一半,W与X可形成原子个数比为2:1的 分子。下列说法正确的是( )A、简单离子半径: B、W与Y能形成含有非极性键的化合物 C、X和Y的最简单氢化物的沸点: D、由W、X、Y三种元素所组成化合物的水溶液均显酸性2. 元素周期表的第四周期为长周期,该周期中的副族元素共有A、32种 B、18种 C、10种 D、7种3. 铁铝铅榴石主要成分为 , 其组成也可写成的氧化物形式:。下列说法正确的是A、组成元素均位于元素周期表的p区 B、晶体硅的熔点比二氧化硅晶体高 C、基态铝原子核外电子有7种不同的空间运动状态 D、中Fe(II)与Fe(III)的个数比为2:14. 下列叙述正确的是( )A、和互称为同素异形体 B、元素周期表中位于金属与非金属分界线附近的元素属于过渡元素 C、合成氨工业中采用循环操作,主要是为了提高氮气和氢气的利用率 D、聚乳酸(
 )降解的产物为丙酸
5. 中国科学院院士张青莲教授曾主持测定的铟()等9种元素相对原子质量的新值,被采用为国际新标准。In与Al同主族。下列说法正确的是( )A、In是第四周期ⅢA族元素 B、与互为同素异形体 C、原子半径: D、碱性:6. 一种新型漂白剂由短周期元素W、X、Y、Z组成,其结构如图所示,其中W、Y、Z三种元素分别位于不同的短周期且不同主族,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子层结构相同。下列叙述错误的是( )
)降解的产物为丙酸
5. 中国科学院院士张青莲教授曾主持测定的铟()等9种元素相对原子质量的新值,被采用为国际新标准。In与Al同主族。下列说法正确的是( )A、In是第四周期ⅢA族元素 B、与互为同素异形体 C、原子半径: D、碱性:6. 一种新型漂白剂由短周期元素W、X、Y、Z组成,其结构如图所示,其中W、Y、Z三种元素分别位于不同的短周期且不同主族,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子层结构相同。下列叙述错误的是( ) A、元素的非金属性X>Y B、该漂白剂的漂白原理与漂白粉相似 C、工业上通常采用电解W的氯化物的水溶液制备单质W D、该漂白剂中X、Y原子最外层均满足8电子稳定结构7. 一种用于合成治疗免疫疾病药的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述错误的是( )
A、元素的非金属性X>Y B、该漂白剂的漂白原理与漂白粉相似 C、工业上通常采用电解W的氯化物的水溶液制备单质W D、该漂白剂中X、Y原子最外层均满足8电子稳定结构7. 一种用于合成治疗免疫疾病药的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述错误的是( ) A、Y的氢化物的熔点一定低于 Z的氢化物的熔点 B、Z元素能形成多种氢化物 C、WZX与WXQ化学键类型相同 D、W2Q2Z3溶液与Q的最高价氧化物对应水化物的稀溶液反应有黄色浑浊和无色气体产生8. 一种由短周期元素组成的化合物,其结构如下图所示。X、Y、Z、Q、R位于同一周期,且原子序数依次递增,Z、Q的核电荷数之和等于R的最外层电子数的2倍。下列判断错误的是( )
A、Y的氢化物的熔点一定低于 Z的氢化物的熔点 B、Z元素能形成多种氢化物 C、WZX与WXQ化学键类型相同 D、W2Q2Z3溶液与Q的最高价氧化物对应水化物的稀溶液反应有黄色浑浊和无色气体产生8. 一种由短周期元素组成的化合物,其结构如下图所示。X、Y、Z、Q、R位于同一周期,且原子序数依次递增,Z、Q的核电荷数之和等于R的最外层电子数的2倍。下列判断错误的是( ) A、离子半径: X<R<Q B、使用ZQ2跨临界可直接制冰,利用了ZQ2晶体易升华的性质 C、元素的非金属性: Z<Q<R D、化合物YR3中各原子最外层均满足8电子稳定结构9. a、b、c、d是原子序数依次增大的短周期元素,甲、乙、丙、丁、戊、己是由这四种元素组成的单质或化合物。它们之间有如下反应:①甲+乙→戊+己;②甲+丙→丁+己。已知己是由c元素形成的常见单质,常温时,0.01mol/L戊溶液的pH=12。下列说法中错误的是( )A、b是第二周期元素 B、甲中有非极性共价键,且1mol甲中含有4mol离子 C、己在自然界中有同素异形体 D、c、d形成的简单离子,它们的电子层结构相同10. W、X、Y、Z为原子序数依次增大的短周期主族元素,其中X、Z同主族且两者的单质在常温下均为气体,Y的最外层电子数等于其电子层数,W与Y的族序数之和等于X的族序数。下列有关说法错误的是( )A、熔融态下YZ3不导电,其属于非电解质 B、原子半径;Y>Z> W> X C、简单氢化物的沸点和热稳定性均存在:X> Z D、W与X组成的二元化合物中可能同时含有极性共价键和非极性共价键11. 科学家为了解决电池的导电性问题,合成出了一种高效化合物,其结构如图1所示,其中W、Y、Z、X、Q均为短周期主族元素,其原子半径与原子序数的关系如图2,Z和Q位于同一主族。下列说法错误的是 ( )
A、离子半径: X<R<Q B、使用ZQ2跨临界可直接制冰,利用了ZQ2晶体易升华的性质 C、元素的非金属性: Z<Q<R D、化合物YR3中各原子最外层均满足8电子稳定结构9. a、b、c、d是原子序数依次增大的短周期元素,甲、乙、丙、丁、戊、己是由这四种元素组成的单质或化合物。它们之间有如下反应:①甲+乙→戊+己;②甲+丙→丁+己。已知己是由c元素形成的常见单质,常温时,0.01mol/L戊溶液的pH=12。下列说法中错误的是( )A、b是第二周期元素 B、甲中有非极性共价键,且1mol甲中含有4mol离子 C、己在自然界中有同素异形体 D、c、d形成的简单离子,它们的电子层结构相同10. W、X、Y、Z为原子序数依次增大的短周期主族元素,其中X、Z同主族且两者的单质在常温下均为气体,Y的最外层电子数等于其电子层数,W与Y的族序数之和等于X的族序数。下列有关说法错误的是( )A、熔融态下YZ3不导电,其属于非电解质 B、原子半径;Y>Z> W> X C、简单氢化物的沸点和热稳定性均存在:X> Z D、W与X组成的二元化合物中可能同时含有极性共价键和非极性共价键11. 科学家为了解决电池的导电性问题,合成出了一种高效化合物,其结构如图1所示,其中W、Y、Z、X、Q均为短周期主族元素,其原子半径与原子序数的关系如图2,Z和Q位于同一主族。下列说法错误的是 ( ) A、简单离子的半径: B、第一电离能: C、简单氢化物分子的键角: D、W、X、Q均可与Z形成两种常见的二元化合物12. 我国科学家开发出一种离子液体(EMIES),该物质由原子序数依次增大的短周期元素X、Y、Z、R、W组成,结构如图所示,只有Y、Z、R位于同一周期,R、W原子的最外层电子数相等。下列说法正确的是( )
A、简单离子的半径: B、第一电离能: C、简单氢化物分子的键角: D、W、X、Q均可与Z形成两种常见的二元化合物12. 我国科学家开发出一种离子液体(EMIES),该物质由原子序数依次增大的短周期元素X、Y、Z、R、W组成,结构如图所示,只有Y、Z、R位于同一周期,R、W原子的最外层电子数相等。下列说法正确的是( ) A、原子半径:Y>Z>R>W>X B、W的氧化物对应的水化物一定是强酸 C、EMIES中,Z、Y原子的最外层都达到8电子结构 D、由X、Z、R三种元素组成的化合物只有两种13. 已知某微粒的核外电子排布式是1s22s22p63s23p4 , 下列判断错误的是( )A、该元素在周期表的位置是第三周期IVA族 B、该元素最高价是+6,最低价是-2 C、该微粒原子核外有16种运动状态不同的电子 D、该微粒原子核外有5种能量不同的电子14. X、Y、Z、W是原子序数依次增大的短周期元素。W与X位于同一主族; X、 Y、Z三种元素形成的化合物具有强氧化性,能灭活新冠病毒,其结构如图所示。下列叙述错误的是( )
A、原子半径:Y>Z>R>W>X B、W的氧化物对应的水化物一定是强酸 C、EMIES中,Z、Y原子的最外层都达到8电子结构 D、由X、Z、R三种元素组成的化合物只有两种13. 已知某微粒的核外电子排布式是1s22s22p63s23p4 , 下列判断错误的是( )A、该元素在周期表的位置是第三周期IVA族 B、该元素最高价是+6,最低价是-2 C、该微粒原子核外有16种运动状态不同的电子 D、该微粒原子核外有5种能量不同的电子14. X、Y、Z、W是原子序数依次增大的短周期元素。W与X位于同一主族; X、 Y、Z三种元素形成的化合物具有强氧化性,能灭活新冠病毒,其结构如图所示。下列叙述错误的是( ) A、该化合物含极性键和非极性键 B、该化合物中各元素原子均达稳定结构 C、Z、W形成的简单离子半径,Z大于W D、由X、Y、Z、W四种元素形成的化合物一定能与X、Z、W形成的化合物反应15. 2020年12月17日凌晨,嫦娥五号返回器携带月球样品返回地球。月壤元素X、Y、Z和M均属于短周期主族元素,其原子序数依次增大。X与Z同主族,Y、Z和M同周期。Y在短周期中原子半径最大,淡黄色的M单质常出现在地球火山口附近。四种元素的最外层电子数之和为15。下列说法正确的是( )A、简单氢化物热稳定性: X>Z,且都比NH3弱 B、最高价氧化物的熔点: M>Z>X C、与M同周期相邻的元素的最高价含氧酸均为强酸 D、含Y和M的简单化合物中阴阳离子半径之比小于116. 如图是部分短周期元素的主要化合价与原子序数的关系,下列说法正确的是( )
A、该化合物含极性键和非极性键 B、该化合物中各元素原子均达稳定结构 C、Z、W形成的简单离子半径,Z大于W D、由X、Y、Z、W四种元素形成的化合物一定能与X、Z、W形成的化合物反应15. 2020年12月17日凌晨,嫦娥五号返回器携带月球样品返回地球。月壤元素X、Y、Z和M均属于短周期主族元素,其原子序数依次增大。X与Z同主族,Y、Z和M同周期。Y在短周期中原子半径最大,淡黄色的M单质常出现在地球火山口附近。四种元素的最外层电子数之和为15。下列说法正确的是( )A、简单氢化物热稳定性: X>Z,且都比NH3弱 B、最高价氧化物的熔点: M>Z>X C、与M同周期相邻的元素的最高价含氧酸均为强酸 D、含Y和M的简单化合物中阴阳离子半径之比小于116. 如图是部分短周期元素的主要化合价与原子序数的关系,下列说法正确的是( ) A、最高正化合价:X>Z>Y B、气态氢化物的沸点:X<W C、氧化物对应水化物的碱性:Y>Z D、R和Z二者最高价氧化物对应的水化物在水中不能发生反应17. 化合物M可用于口腔清洁,其结构式如图所示。已知W、X、Y、Z是原子序数依次增大的前20号主族元素,X与Y同主族。下列说法错误的是( )
A、最高正化合价:X>Z>Y B、气态氢化物的沸点:X<W C、氧化物对应水化物的碱性:Y>Z D、R和Z二者最高价氧化物对应的水化物在水中不能发生反应17. 化合物M可用于口腔清洁,其结构式如图所示。已知W、X、Y、Z是原子序数依次增大的前20号主族元素,X与Y同主族。下列说法错误的是( ) A、M与乙醇的消毒原理相同 B、简单离子的半径,Y>Z>X C、元素的电负性:X>Y>W D、ZW仅含离子键,可与H2O发生反应18. 短周期元素X、Y、Z、W原子序数依次增大,它们原子的最外层电子数之和为14,X与Z同主族,Y与W同主族,且X的原子半径小于Y,W原子序数为Y原子序数的2倍。下列叙述错误的是( )A、在同周期元素最高价氧化物对应水化物中,W的酸性最强 B、Z与Y可形成Z2Y、Z2Y2离子化合物 C、热稳定性:X2W<X2Y D、常见简单离子半径:Z<Y<W19. W、X、Y、Z为原子序数依次增大的短周期主族元素。W、Z同主族,Y单质可用作光电池,X的周期序数等于主族序数,Z原子的最外层电子数等于最内层电子数的3倍。下列叙述错误的是( )A、简单离子的半径:Z>W>X B、YW2和ZW2都是酸性氧化物,都不与酸反应 C、含X或Y的某些盐可用于制备胶体 D、工业上采用熔融电解法冶炼X的单质20. 由短周期主族元素W、X、Y、Z构成的一种阴离子(如下图),W、X、Y、Z的原子序数依次增大,Z元素无正化合价。下列说法正确的是( )
A、M与乙醇的消毒原理相同 B、简单离子的半径,Y>Z>X C、元素的电负性:X>Y>W D、ZW仅含离子键,可与H2O发生反应18. 短周期元素X、Y、Z、W原子序数依次增大,它们原子的最外层电子数之和为14,X与Z同主族,Y与W同主族,且X的原子半径小于Y,W原子序数为Y原子序数的2倍。下列叙述错误的是( )A、在同周期元素最高价氧化物对应水化物中,W的酸性最强 B、Z与Y可形成Z2Y、Z2Y2离子化合物 C、热稳定性:X2W<X2Y D、常见简单离子半径:Z<Y<W19. W、X、Y、Z为原子序数依次增大的短周期主族元素。W、Z同主族,Y单质可用作光电池,X的周期序数等于主族序数,Z原子的最外层电子数等于最内层电子数的3倍。下列叙述错误的是( )A、简单离子的半径:Z>W>X B、YW2和ZW2都是酸性氧化物,都不与酸反应 C、含X或Y的某些盐可用于制备胶体 D、工业上采用熔融电解法冶炼X的单质20. 由短周期主族元素W、X、Y、Z构成的一种阴离子(如下图),W、X、Y、Z的原子序数依次增大,Z元素无正化合价。下列说法正确的是( ) A、X与Y的氢化物沸点:Y>X B、原子半径大小关系是:Z>Y>X>W C、上图中各原子均满足8电子稳定结构 D、W的最高价氯化物对应的水化物是一种一元强酸21. 前四周期主族元素X、Y、Z、W的原子序数依次增大,且位于周期表4个不同的周期。Y的电负性仅次于氟元素,常温下Z单质是气体,基态W原子的外围电子排布为ns2np5。下列有关说法正确的是( )A、W位于元素周期表中第四周期VA族 B、Z的最高价氧化物的水化物为弱酸 C、X与Y组成的化合物分子间可形成氢键 D、Z和W形成的化合物中W显负价22. 常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH和原子半径、原子序数的关系如下图所示。下列说法错误的是( )
A、X与Y的氢化物沸点:Y>X B、原子半径大小关系是:Z>Y>X>W C、上图中各原子均满足8电子稳定结构 D、W的最高价氯化物对应的水化物是一种一元强酸21. 前四周期主族元素X、Y、Z、W的原子序数依次增大,且位于周期表4个不同的周期。Y的电负性仅次于氟元素,常温下Z单质是气体,基态W原子的外围电子排布为ns2np5。下列有关说法正确的是( )A、W位于元素周期表中第四周期VA族 B、Z的最高价氧化物的水化物为弱酸 C、X与Y组成的化合物分子间可形成氢键 D、Z和W形成的化合物中W显负价22. 常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH和原子半径、原子序数的关系如下图所示。下列说法错误的是( ) A、X与Y形成的化合物的水溶液呈酸性 B、单质的沸点:Y>Z C、简单离子半径:Y>Z>W>X D、ZO2可作为自来水的消毒剂23. 铁、氮气、丙酮和乙醇可参与制备铁氮化合物(FexNy),以下说法错误的是( )A、Fe元素位于元素周期表的第VIIIB族 B、丙酮中碳原子采用sp2和sp3杂化 C、1个N2分子中有1个σ键和2个π键 D、乙醇的沸点高于丙烷,是因为乙醇分子间存在氢键24. 春节期间,王亚平在太空绘制奥运五环,环中的试剂涉及X、Y、Z、W四种元素,已知X、Y、Z、W分布于前三个周期且原子序数依次增大,W在短周期主族元素中原子半径最大,X与W同一主族,Z元素的最外层电子数是电子层数的3倍,也是其它三种元素的最外层电子数之和,下列说法正确的是( )A、工业上常采用电解饱和溶液的方法制备W B、氢化物的沸点:Z>Y C、简单离子半径:W>Z D、空间站可采用W2Z2提供用于呼吸的气体并净化空气25. 1919年卢瑟福用α粒子(He)轰击某原子核实现了首次人工核转变,核反应为He+X →Y+H。已知:Y 元素原子的最外层电子数为其内层电子总数的3倍。下列说法正确的是( )A、16Y2和17Y2互为同素异形体 B、X、Y的非金属性:X>Y C、最简单氢化物的沸点:Y<X D、仅由上述主族元素形成的化合物中可能含离子键26. 短周期主族元素X、Y、Z、W、R的原子序数依次增加,X、Y、W位于不同周期,原子序数:3Y=Z+R,常温下X与Y可组成两种液态二元化合物。某种缓冲溶液的主要成分结构如图。下列说法错误的是( )
A、X与Y形成的化合物的水溶液呈酸性 B、单质的沸点:Y>Z C、简单离子半径:Y>Z>W>X D、ZO2可作为自来水的消毒剂23. 铁、氮气、丙酮和乙醇可参与制备铁氮化合物(FexNy),以下说法错误的是( )A、Fe元素位于元素周期表的第VIIIB族 B、丙酮中碳原子采用sp2和sp3杂化 C、1个N2分子中有1个σ键和2个π键 D、乙醇的沸点高于丙烷,是因为乙醇分子间存在氢键24. 春节期间,王亚平在太空绘制奥运五环,环中的试剂涉及X、Y、Z、W四种元素,已知X、Y、Z、W分布于前三个周期且原子序数依次增大,W在短周期主族元素中原子半径最大,X与W同一主族,Z元素的最外层电子数是电子层数的3倍,也是其它三种元素的最外层电子数之和,下列说法正确的是( )A、工业上常采用电解饱和溶液的方法制备W B、氢化物的沸点:Z>Y C、简单离子半径:W>Z D、空间站可采用W2Z2提供用于呼吸的气体并净化空气25. 1919年卢瑟福用α粒子(He)轰击某原子核实现了首次人工核转变,核反应为He+X →Y+H。已知:Y 元素原子的最外层电子数为其内层电子总数的3倍。下列说法正确的是( )A、16Y2和17Y2互为同素异形体 B、X、Y的非金属性:X>Y C、最简单氢化物的沸点:Y<X D、仅由上述主族元素形成的化合物中可能含离子键26. 短周期主族元素X、Y、Z、W、R的原子序数依次增加,X、Y、W位于不同周期,原子序数:3Y=Z+R,常温下X与Y可组成两种液态二元化合物。某种缓冲溶液的主要成分结构如图。下列说法错误的是( ) A、R的最高价氧化物对应的水化物为强酸 B、简单氢化物的稳定性:Y<Z C、X、W均能与Y形成具有漂白性的化合物 D、简单离子半径:Y>Z>W27. W、X、Y、Z是原子序数依次增大的4种短周期元素,X、Y、Z位于同一周期,XZ3与YW3之间能以配位键相结合,XY的熔点高、硬度大。下列说法正确的是( )A、XZ3与YW3都为极性分子 B、同周期中第一电离能小于X的元素有2种 C、同周期中Z元素的电负性最强 D、与Y同主族元素中,Y单质的性质最活泼28. 下图为元素周期表前四周期的一部分。
A、R的最高价氧化物对应的水化物为强酸 B、简单氢化物的稳定性:Y<Z C、X、W均能与Y形成具有漂白性的化合物 D、简单离子半径:Y>Z>W27. W、X、Y、Z是原子序数依次增大的4种短周期元素,X、Y、Z位于同一周期,XZ3与YW3之间能以配位键相结合,XY的熔点高、硬度大。下列说法正确的是( )A、XZ3与YW3都为极性分子 B、同周期中第一电离能小于X的元素有2种 C、同周期中Z元素的电负性最强 D、与Y同主族元素中,Y单质的性质最活泼28. 下图为元素周期表前四周期的一部分。X
W
Y
Z
下列有关W、X、Y、Z四种元素的说法中,正确的是( )
A、电负性:Z>X B、单质熔点:Y>Z C、原子半径:Y>W D、第一电离能:Y>W29. 短周期非金属元素X、Y、Z、W的原子序数依次增大,基态X原子的未成对电子数是其所在周期中最多的,基态W原子的电子总数是其最高能级电子数的4倍。四种元素与Xe元素组成的某化合物的结构如图所示。下列说法错误的是( ) A、W的常见氧化物是酸性氧化物 B、最简单氢化物的沸点:Z>Y>X C、气态氢化物的还原性W> Z D、X和W的最高价氧化物对应水化物的浓溶液都具有强氧化性
A、W的常见氧化物是酸性氧化物 B、最简单氢化物的沸点:Z>Y>X C、气态氢化物的还原性W> Z D、X和W的最高价氧化物对应水化物的浓溶液都具有强氧化性二、非选择题
-
30. 耐HF腐蚀的催化剂 , 可应用于氟化工行业中的氯循环(如图)。
 (1)、Ru的价电子排布式为 , 该元素位于第周期族。(2)、上述转化过程中涉及的有机反应类型有。(3)、可通过液化分离出HCl中大多数的HF,从结构角度解释两者沸点差异的原因。(4)、、、的晶体结构如图(和中实线部分为晶胞)
(1)、Ru的价电子排布式为 , 该元素位于第周期族。(2)、上述转化过程中涉及的有机反应类型有。(3)、可通过液化分离出HCl中大多数的HF,从结构角度解释两者沸点差异的原因。(4)、、、的晶体结构如图(和中实线部分为晶胞)
①晶胞中有个Ru,O在晶胞的位置为。
②已知与载体晶体结构(堆积方式、晶胞参数)越相似,催化效果越好。载体中掺杂的原因是。
31. 我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。(1)、镓的原子结构示意图为 , 镓元素在元素周期表中的位置是。 (2)、GaAs的熔点为1238℃且熔融状态不导电,据此判断它是__(填“共价”或“离子”)化合物。(3)、镓与氨气在1100℃下反应生成氮化镓和氢气,该可逆反应每生成1molH2放出10.3kJ热量。该反应的热化学方程式是。(已知金属镓的熔点是29.8℃,沸点是2403℃;氮化镓的熔点为1700℃)(4)、As与P同族且相邻。磷的最外层电子轨道表示式。预测As的氢化物分子的空间结构 , 其沸点比NH3的(填“高”或“低”),理由是。(5)、下列说法错误的是。
, 镓元素在元素周期表中的位置是。 (2)、GaAs的熔点为1238℃且熔融状态不导电,据此判断它是__(填“共价”或“离子”)化合物。(3)、镓与氨气在1100℃下反应生成氮化镓和氢气,该可逆反应每生成1molH2放出10.3kJ热量。该反应的热化学方程式是。(已知金属镓的熔点是29.8℃,沸点是2403℃;氮化镓的熔点为1700℃)(4)、As与P同族且相邻。磷的最外层电子轨道表示式。预测As的氢化物分子的空间结构 , 其沸点比NH3的(填“高”或“低”),理由是。(5)、下列说法错误的是。a.镓的金属性比铝的强 b.砷化镓具有半导体性质
c.As与H2在低温时可剧烈化合为AsH3 d.酸性:H2SO4>H3PO4>H3AsO4
亚砷酸(H3AsO3)可以用于治疗白血病。亚砷酸溶液中各种微粒物质的量分数与溶液pH关系如图所示。
 (6)、人体血液的pH在7.35—7.45之间,患者用药后人体中含As元素的主要微粒是。通常情况下,H2AsO电离程度水解程度(填“>、<、=”)。(7)、以酚酞作指示剂,将KOH溶液滴入亚砷酸溶液,滴定终点发生的离子反应是。交点b的溶液中:c(K+)2c(HAsO)+4c(AsO)(填“>、<、=”)。32. [化学——选修 3:物质结构与性质]
(6)、人体血液的pH在7.35—7.45之间,患者用药后人体中含As元素的主要微粒是。通常情况下,H2AsO电离程度水解程度(填“>、<、=”)。(7)、以酚酞作指示剂,将KOH溶液滴入亚砷酸溶液,滴定终点发生的离子反应是。交点b的溶液中:c(K+)2c(HAsO)+4c(AsO)(填“>、<、=”)。32. [化学——选修 3:物质结构与性质]铁是一种常见的金属,在生产生活中用途广泛。
(1)、铁在元素周期表中的位置是 , 其基态原子的电子排布式为;铁原子外电子发生跃迁时会吸收或释放不同的光,可以用摄取铁元素的原子光谱。(2)、Fe(CO)5与NH3在一定条件下可合成一种具有磁性的氮化铁(Fe3N),NH3分子的立体构型为;1 mol Fe(CO)5分子中含有σ键为mol。
(3)、把氯气通入黄血盐{ K4[Fe(CN)6]}溶液中,得到赤血盐{ K3[Fe(CN)6]},该反应的化学方程式为;CN-中碳原子的杂化轨道类型为。C、N、O元素的第一电离能的大小顺序为
(4)、FeCl可与KSCN溶液发生显色反应。SCN-与N2O互为等电子体,则SCN-的电子式为(5)、某离子型铁的氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为已知该晶体的密度为dg·cm-3 ,阿伏加德罗常数的值为NA , 则该晶体的晶胞参数a=pm。(用含d和NA的代数式表示)。
 33. 镍、砷是近年来颇受材料化学研究领域关注的元素。(1)、Ni在周期表中的位置 , Ni2+价电子轨道表示式为。(2)、NiO晶体结构与NaCl相似,在氧气中加热,部分Ni2+被氧化为Ni3+ , 成为NixO(x<1),出现晶体空位。氧化过程如图,图a中Ni的配位数为 , 图b中x为 , n(Ni2+):n(Ni3+)=。
33. 镍、砷是近年来颇受材料化学研究领域关注的元素。(1)、Ni在周期表中的位置 , Ni2+价电子轨道表示式为。(2)、NiO晶体结构与NaCl相似,在氧气中加热,部分Ni2+被氧化为Ni3+ , 成为NixO(x<1),出现晶体空位。氧化过程如图,图a中Ni的配位数为 , 图b中x为 , n(Ni2+):n(Ni3+)=。 (3)、砷存在多种同素异形体——黄砷、黑砷、灰砷
(3)、砷存在多种同素异形体——黄砷、黑砷、灰砷①黄砷结构与白磷相似,黄砷的空间构型为 , 第三周期,第一电离能介于Al和P之间的元素有种。
②近年来,黑砷在催化电解水方面的研究受到关注,其晶体结构与石墨类似。根据图中信息,下列说法正确的有(填标号)。

a.黑砷中As—As键的键能均相同
b.黑砷与C60都属于混合型晶体
c.黑砷单层中As原子与As—As键的个数比为2:3
d.黑砷层与层之间的作用力为范德华力
34. 铑的配合物Rh(PPh3)Cl可催化丙烯与氢气的加成,反应过程为:CH3CH=CH2+H2 CH3CH2CH3 , 回答下列问题:(1)、基态Rh原子的价电子排布式为4d85s1 , 铑在周期表的位置是 , 其原子中的未成对电子数为。(2)、1mol丙烯(CH3CH=CH2)中σ键的数目为 , 其结构简式中打点的C原子与H原子间的σ键可称为sp2-sσ键,则丙烯分子中C原子之间的所有σ键可称为。(3)、第一电离能PCl(填“大于”或“小于”),PPh3是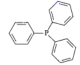 的缩写,该分子的立体构型是。比较PPh3与PH3的沸点大小,并说明原因。 (4)、RhCl3的晶胞结构中Rh3+的位置如图所示(Cl-未画出):
的缩写,该分子的立体构型是。比较PPh3与PH3的沸点大小,并说明原因。 (4)、RhCl3的晶胞结构中Rh3+的位置如图所示(Cl-未画出):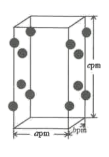
①晶胞中含有的Cl-数目为;
②若阿伏加德罗常数为NA , 则晶体的密度为g·cm-3.(列出计算式)
35. C、S、Cr、Cu及其化合物在化工、材料等方面应用十分广泛。回答下列问题:(1)、二甲基亚砜( )所含元素的电负性由大到小的顺序为。所含碳原子和硫原子的杂化类型分别为、。 (2)、25℃时,顺-丁烯二酸(
)所含元素的电负性由大到小的顺序为。所含碳原子和硫原子的杂化类型分别为、。 (2)、25℃时,顺-丁烯二酸( )和反-丁烯二酸(
)和反-丁烯二酸(  )的电离平衡常数如下表。
)的电离平衡常数如下表。 物质
电离平衡常数
顺-丁烯二酸
K1=1.17×10-2
K2=2.6×10-7
反-丁烯二酸
K1=9.3×10-4
K2=2.9×10-5
结合氢键,分析顺-丁烯二酸的K1明显大于反-丁烯二酸的原因是。
(3)、元素Cr位于元素周期表中区,其基态原子次外层电子数目为个,其基态原子价层电子的空间运动状态有种。(4)、某晶体晶胞结构如图所示,其中Cu均匀分散在立方体内,NA为阿伏加德罗常数的值。
①该化合物中铜粒子的价电子排布式为 , a、b氧粒子的坐标参数依次为(0,0,0)、( , , ),则d点粒子的坐标参数为。
②若a、b间的距离=xcm,计算该晶胞的密度g/cm3(写表达式)。