高考二轮复习知识点:元素周期表的结构及其应用1
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 甲~戊均为短周期元素,在元素周期表中的相对位置如图2所示;戊的最高价氧化物对应的水化物为强酸。下列说法不正确的是( )
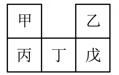 A、原子半径:丁>戊>乙 B、非金属性:戊>丁>丙 C、甲的氢化物遇氯化氢一定有白烟产生 D、丙的最高价氧化物对应的水化物一定能与强碱反应2. 常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是
A、原子半径:丁>戊>乙 B、非金属性:戊>丁>丙 C、甲的氢化物遇氯化氢一定有白烟产生 D、丙的最高价氧化物对应的水化物一定能与强碱反应2. 常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是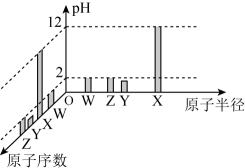 A、第一电离能: B、含有极性共价键和非极性共价键 C、工业上通过电解XZ的水溶液来制取X的单质 D、Z的单质具有强氧化性和漂白性3. 高铁酸钾()是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转化为胶体,下列说法不正确的是A、高铁酸钾中铁元素的化合价为+6价 B、Fe元素位于周期表ds区 C、高铁酸钾属于强电解质 D、用对饮用水处理时,能起到消毒杀菌和吸附杂质的双重作用4. 一种麻醉剂的结构式如图所示。元素X的原子核只有1个质子,元素Y 、Z、W的原子序数依次增大,且均位于X的下一周期,元素E的原子比元素W的原子多8个电子。下列说法错误的是
A、第一电离能: B、含有极性共价键和非极性共价键 C、工业上通过电解XZ的水溶液来制取X的单质 D、Z的单质具有强氧化性和漂白性3. 高铁酸钾()是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转化为胶体,下列说法不正确的是A、高铁酸钾中铁元素的化合价为+6价 B、Fe元素位于周期表ds区 C、高铁酸钾属于强电解质 D、用对饮用水处理时,能起到消毒杀菌和吸附杂质的双重作用4. 一种麻醉剂的结构式如图所示。元素X的原子核只有1个质子,元素Y 、Z、W的原子序数依次增大,且均位于X的下一周期,元素E的原子比元素W的原子多8个电子。下列说法错误的是 A、Y的简单氢化物沸点比Z的低 B、简单离子半径:Z>W>E C、ZW2中,Z的化合价为+2价 D、X、Z、E能形成具有漂白性的化合物5. X、Y、Z为原子序数依次增大的主族元素,Y与Z同主族。W为第四周期元素,最外层电子数为1,价层电子数为11,四种元素组成的某蓝色晶体基本结构单元的结构简式如下图所示。下列说法错误的是
A、Y的简单氢化物沸点比Z的低 B、简单离子半径:Z>W>E C、ZW2中,Z的化合价为+2价 D、X、Z、E能形成具有漂白性的化合物5. X、Y、Z为原子序数依次增大的主族元素,Y与Z同主族。W为第四周期元素,最外层电子数为1,价层电子数为11,四种元素组成的某蓝色晶体基本结构单元的结构简式如下图所示。下列说法错误的是 A、原子半径Z>Y>X B、Y的第一电离能比同周期相邻元素小 C、单质W和Z在加热条件下生成化合物WZ D、Y的简单氢化物的热稳定性强于Z的简单氢化物6. 一种钠盐的结晶水合物的阴离子由短周期元素X、Y、Z组成,其结构如图,已知:Z为第二周期元素,三种元素原子序数之和小于20,下列说法正确的是
A、原子半径Z>Y>X B、Y的第一电离能比同周期相邻元素小 C、单质W和Z在加热条件下生成化合物WZ D、Y的简单氢化物的热稳定性强于Z的简单氢化物6. 一种钠盐的结晶水合物的阴离子由短周期元素X、Y、Z组成,其结构如图,已知:Z为第二周期元素,三种元素原子序数之和小于20,下列说法正确的是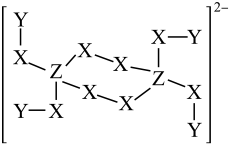 A、X、Y、Z三种元素中原子半径最大的是X B、NaZY4是一种强还原剂,其固体溶于水可产生Y2 C、Z原子的L层上有5个电子 D、X的氢化物中不可能存在非极性共价键7. 下列物质性质的变化规律与化学键强弱无关的是A、HF、HCl、HBr的热稳定性依次减弱 B、NaF、NaCl、NaBr的熔点依次降低 C、Li、Na、K的熔点逐渐降低 D、SiF4、SiCl4、SiBr4的熔、沸点逐渐升高8. X、Y、Z、W、R五种前20号主族元素,原子序数依次增大。基态X原子中有3个未成对电子,Z是元素周期表中电负性最大的元素,Y和W同主族,常温下的最高价氧化物对应的水化物溶液的pH=12。下列说法正确的是A、简单离子半径:r(W)<r(R) B、最高正价:X<Y<Z C、第一电离能: D、简单氢化物的键角:Y>W9. 短周期元素X、Y、Z、W的原子序数依次增大,Z是地壳中含量最多的元素,W的单质常温下是黄绿色气体。由这四种元素组成的化合物A是一种重要的脱氢剂,化合物A与氢气反应可以生成化合物B,其过程如图所示。下列说法错误的是
A、X、Y、Z三种元素中原子半径最大的是X B、NaZY4是一种强还原剂,其固体溶于水可产生Y2 C、Z原子的L层上有5个电子 D、X的氢化物中不可能存在非极性共价键7. 下列物质性质的变化规律与化学键强弱无关的是A、HF、HCl、HBr的热稳定性依次减弱 B、NaF、NaCl、NaBr的熔点依次降低 C、Li、Na、K的熔点逐渐降低 D、SiF4、SiCl4、SiBr4的熔、沸点逐渐升高8. X、Y、Z、W、R五种前20号主族元素,原子序数依次增大。基态X原子中有3个未成对电子,Z是元素周期表中电负性最大的元素,Y和W同主族,常温下的最高价氧化物对应的水化物溶液的pH=12。下列说法正确的是A、简单离子半径:r(W)<r(R) B、最高正价:X<Y<Z C、第一电离能: D、简单氢化物的键角:Y>W9. 短周期元素X、Y、Z、W的原子序数依次增大,Z是地壳中含量最多的元素,W的单质常温下是黄绿色气体。由这四种元素组成的化合物A是一种重要的脱氢剂,化合物A与氢气反应可以生成化合物B,其过程如图所示。下列说法错误的是 A、工业上可采用电解饱和食盐水的方法制备W的单质 B、Y的最高价氧化物的水化物是强电解质 C、Y、Z与氢三种元素形成化合物的晶体类型一定是分子晶体 D、用FeCl3溶液可鉴别A和B10. 氨硼烷(BH3NH3)分子结构和乙烷相似,是一种固体储氢材料。下列关于氨硼烷的说法错误的是A、N和B元素均位于元素周期表的p区 B、第一电离能:N<B C、分子中N原子与B原子间形成了配位键 D、氨硼烷固态时为分子晶体11. 和S均属于VIA族元素。下列关于Se及其化合物性质的比较错误的是A、第一电离能: B、原子半径:Se<As C、还原性: D、沸点:12. X、Y、Z、W四种短周期元素在周期表中的位置如图所示,X元素基态原子的最外层电子排布式为。下列说法错误的是
A、工业上可采用电解饱和食盐水的方法制备W的单质 B、Y的最高价氧化物的水化物是强电解质 C、Y、Z与氢三种元素形成化合物的晶体类型一定是分子晶体 D、用FeCl3溶液可鉴别A和B10. 氨硼烷(BH3NH3)分子结构和乙烷相似,是一种固体储氢材料。下列关于氨硼烷的说法错误的是A、N和B元素均位于元素周期表的p区 B、第一电离能:N<B C、分子中N原子与B原子间形成了配位键 D、氨硼烷固态时为分子晶体11. 和S均属于VIA族元素。下列关于Se及其化合物性质的比较错误的是A、第一电离能: B、原子半径:Se<As C、还原性: D、沸点:12. X、Y、Z、W四种短周期元素在周期表中的位置如图所示,X元素基态原子的最外层电子排布式为。下列说法错误的是X
Y
Z
W
A、离子半径: B、还原性: C、酸性: D、氢化物稳定性:13. 短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X基态原子的p轨道处于半充满状态;常温下,Y的氢化物呈液态,Z的单质能溶于W的最高价氧化物对应的水化物的稀溶液,却不溶于其浓溶液。下列说法错误的是A、第一电离能: B、氢化物的热稳定性: C、电负性: D、原子半径:14. 化学与科技、生产生活等各方面息息相关,下列说法错误的是A、Ge的单晶可以作为光电转换材料用于太阳能电池 B、2022冬奥部分场馆建筑应用了新材料碲化镉发电玻璃,其中碲和镉均属于过渡元素 C、牙膏中添加的SrF2、NaF提供的氟离子浓度相等时,它们防治龋齿的作用相当 D、冬天前用石灰浆喷洒树皮可以杀死虫卵15. 短周期主族元素W、X、Y、Z的原子序数依次增加。K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一。0.1mol/L丙溶液的pH<1,上述物质的转化关系如图所示。下列说法正确的是 A、丙不能由无单质参加的化合反应制得 B、K、L、M中键角大小为:K>L>M C、元素的非金属性:Z>Y>X D、W、X、Y、Z可形成四种常见的具有漂白性的单质或化合物,包含了三种漂白原理16. 已知X、Y、Z、W为核电荷数依次增大的前20号主族元素,且位于不同周期,其形成的某种物质的结构如图,该物质的水溶液显酸性。下列说法正确的是
A、丙不能由无单质参加的化合反应制得 B、K、L、M中键角大小为:K>L>M C、元素的非金属性:Z>Y>X D、W、X、Y、Z可形成四种常见的具有漂白性的单质或化合物,包含了三种漂白原理16. 已知X、Y、Z、W为核电荷数依次增大的前20号主族元素,且位于不同周期,其形成的某种物质的结构如图,该物质的水溶液显酸性。下列说法正确的是 A、该化合物的焰色试验呈黄色 B、Z的简单气态氢化物的热稳定性比Y强 C、Z的最高价氧化物对应的水化物为强酸 D、Y与其他三种元素均可形成两种或两种以上的二元化合物17. 一研发团队基于型异质结的、、的超痕量同时检测及其机理如图所示。下列叙述错误的是
A、该化合物的焰色试验呈黄色 B、Z的简单气态氢化物的热稳定性比Y强 C、Z的最高价氧化物对应的水化物为强酸 D、Y与其他三种元素均可形成两种或两种以上的二元化合物17. 一研发团队基于型异质结的、、的超痕量同时检测及其机理如图所示。下列叙述错误的是 A、图中涉及的金属元素位于元素周期表d区 B、图中含金属的纯净物为单质或氧化物 C、上述涉及的四种金属元素均为过渡元素 D、炭粒在制备氧化物的过程中表现氧化性18. 上海科研团队发现M是感知各种代谢活动的关键枢纽。M的结构如图所示。短周期主族元素R、Y、Z、X的原子半径依次减小,R为金属元素,X和R位于同主族,Y与R不同周期。下列叙述正确的是
A、图中涉及的金属元素位于元素周期表d区 B、图中含金属的纯净物为单质或氧化物 C、上述涉及的四种金属元素均为过渡元素 D、炭粒在制备氧化物的过程中表现氧化性18. 上海科研团队发现M是感知各种代谢活动的关键枢纽。M的结构如图所示。短周期主族元素R、Y、Z、X的原子半径依次减小,R为金属元素,X和R位于同主族,Y与R不同周期。下列叙述正确的是 A、简单离子半径: B、能与溶液反应 C、Z和R组成的化合物只含1种化学键 D、工业上电解熔融的制备的单质19. 下列符号表征或说法错误的是( )A、氨的电子式:
A、简单离子半径: B、能与溶液反应 C、Z和R组成的化合物只含1种化学键 D、工业上电解熔融的制备的单质19. 下列符号表征或说法错误的是( )A、氨的电子式: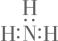 B、Cu位于元素周期表的ds区
C、在水中的电离方程式:
D、的VSEPR模型:
B、Cu位于元素周期表的ds区
C、在水中的电离方程式:
D、的VSEPR模型: 20. 物质M是N−甲基−D−天冬氨酸受体的变构调控因子,其结构式如图所示。其中X、Y、Z、W、R为核电荷数依次增大的短周期主族元素。X的族序数与周期数相等,且与R同主族,Y形成的化合物种类最多。下列说法正确的是
20. 物质M是N−甲基−D−天冬氨酸受体的变构调控因子,其结构式如图所示。其中X、Y、Z、W、R为核电荷数依次增大的短周期主族元素。X的族序数与周期数相等,且与R同主族,Y形成的化合物种类最多。下列说法正确的是 A、原子半径:Y>Z>W>R B、简单氢化物沸点:W>Z>Y C、Z2X4中只含有极性共价键 D、W、R形成的二元化合物均有强氧化性21. 已知某化合物的结构如图所示,其中X、Y、Z和W是原子序数依次增大的短周期元素,Y与W是同一主族元素。下列说法正确的是
A、原子半径:Y>Z>W>R B、简单氢化物沸点:W>Z>Y C、Z2X4中只含有极性共价键 D、W、R形成的二元化合物均有强氧化性21. 已知某化合物的结构如图所示,其中X、Y、Z和W是原子序数依次增大的短周期元素,Y与W是同一主族元素。下列说法正确的是 A、原子半径:r(X)>r(Y)>r(Z)>r(W) B、简单氢化物的沸点:Y>Z C、该化合物中各原子均达到8电子稳定结构 D、氧化物的水化物的酸性:X>W22. 前四周期元素W、X、Y、Z的原子序数依次增大且分属不同周期。X的最高能级的电子数比电子层数多1,Y的最高价含氧酸为具有吸水性的弱酸,Z与W中均存在单电子,且两者单电子数和最外层电子数均相同。下列说法正确的是A、四种元素中电负性最大的为Y B、X元素的第一电离能高于其同周期相邻元素 C、Z元素在同周期中金属性最强 D、W与X两种元素形成的化合物中只含有极性键23. 硒化锌是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为该晶胞沿z轴方向在平面的投影,已知晶胞边长为 , 阿伏加德罗常数的值为 , 下列说法错误的是
A、原子半径:r(X)>r(Y)>r(Z)>r(W) B、简单氢化物的沸点:Y>Z C、该化合物中各原子均达到8电子稳定结构 D、氧化物的水化物的酸性:X>W22. 前四周期元素W、X、Y、Z的原子序数依次增大且分属不同周期。X的最高能级的电子数比电子层数多1,Y的最高价含氧酸为具有吸水性的弱酸,Z与W中均存在单电子,且两者单电子数和最外层电子数均相同。下列说法正确的是A、四种元素中电负性最大的为Y B、X元素的第一电离能高于其同周期相邻元素 C、Z元素在同周期中金属性最强 D、W与X两种元素形成的化合物中只含有极性键23. 硒化锌是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为该晶胞沿z轴方向在平面的投影,已知晶胞边长为 , 阿伏加德罗常数的值为 , 下列说法错误的是 A、位于元素周期表的区 B、基态原子核外有18种不同空间运动状态的电子 C、A点原子的坐标为 , 则B点原子的坐标为 D、该晶体密度为24. X、Y、Z、M为原子序数依次增大的前四周期元素,其有关性质或结构信息如下:
A、位于元素周期表的区 B、基态原子核外有18种不同空间运动状态的电子 C、A点原子的坐标为 , 则B点原子的坐标为 D、该晶体密度为24. X、Y、Z、M为原子序数依次增大的前四周期元素,其有关性质或结构信息如下:元素
X
Y
Z
M
性质或结构信息
原子核外有三个能级,每个能级含有的电子数都相等
原子核外有两个电子层,最外层有3个未成对电子
氢化物为二元弱酸
基态原子核外价电子排布式为
下列说法错误的是
A、X元素与Z元素的原子可构成直线形分子 B、Y元素氢化物的沸点一定比X元素氢化物的沸点高 C、Z元素的二价阴离子是正四面体结构 D、将M的低价硝酸盐溶解在足量稀硝酸中,有气体产生25. 下列我国科研成果所涉及的物质转化中,物质所含元素位于0族的是( )A、由二氧化碳制取汽油: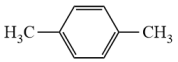 等
B、液氦到超流氦的转变:液氦(-269℃)→超流氦(-271℃)
C、煤炭的清洁化利用:煤炭→
D、利用太阳能合成燃料:
26. 下图为某物质的结构。已知:W、Y、Z属于不同周期、不同主族的短周期元素,W、Y、Z原子最外层电子数之和等于X原子最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述错误的是( )
等
B、液氦到超流氦的转变:液氦(-269℃)→超流氦(-271℃)
C、煤炭的清洁化利用:煤炭→
D、利用太阳能合成燃料:
26. 下图为某物质的结构。已知:W、Y、Z属于不同周期、不同主族的短周期元素,W、Y、Z原子最外层电子数之和等于X原子最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述错误的是( )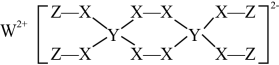 A、Y元素在周期表中的位置为第二周期IVA族 B、W、X对应的简单离子半径:X>W C、该物质具有强氧化性,可以用作漂白剂 D、该物质中,Y、X原子的最外层均满足8电子结构27. 一种新型漂白剂(如图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( )
A、Y元素在周期表中的位置为第二周期IVA族 B、W、X对应的简单离子半径:X>W C、该物质具有强氧化性,可以用作漂白剂 D、该物质中,Y、X原子的最外层均满足8电子结构27. 一种新型漂白剂(如图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( ) A、W单质在空气中点燃发出耀眼的白光 B、W、X对应的简单离子半径W>X C、Y的单质高温下可与水反应放出氢气,体现Y的氧化性 D、该漂白剂的漂白原理与相同28. X、Y、Z、M、W是五种短周期主族元素,其原子半径与原子序数的关系如图甲所示,X、Y、Z、M形成的化合物如图乙所示,Z与W同主族。下列说法错误的是( )
A、W单质在空气中点燃发出耀眼的白光 B、W、X对应的简单离子半径W>X C、Y的单质高温下可与水反应放出氢气,体现Y的氧化性 D、该漂白剂的漂白原理与相同28. X、Y、Z、M、W是五种短周期主族元素,其原子半径与原子序数的关系如图甲所示,X、Y、Z、M形成的化合物如图乙所示,Z与W同主族。下列说法错误的是( )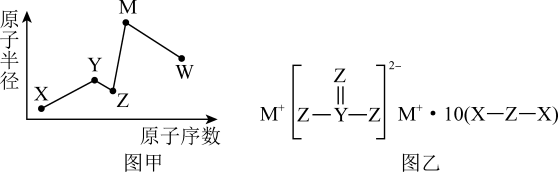 A、简单氢化物的熔沸点:Z>W B、简单离子的半径:W>Z>M C、X2Z2和M2Z2中的化学键类型完全相同 D、最高价氧化物对应水化物的酸性:W>Y29. X、Y、Z为前10号原子序数递增的同周期紧邻元素,基态Z原子的第一电离能的大小在本周期元素中排第二位。下列说法错误的是( )A、电负性:X>Y>Z B、基态原子未成对电子数:X>Y>Z C、原子半径:X>Y>Z D、简单气态氢化物稳定性:Z>Y>X
A、简单氢化物的熔沸点:Z>W B、简单离子的半径:W>Z>M C、X2Z2和M2Z2中的化学键类型完全相同 D、最高价氧化物对应水化物的酸性:W>Y29. X、Y、Z为前10号原子序数递增的同周期紧邻元素,基态Z原子的第一电离能的大小在本周期元素中排第二位。下列说法错误的是( )A、电负性:X>Y>Z B、基态原子未成对电子数:X>Y>Z C、原子半径:X>Y>Z D、简单气态氢化物稳定性:Z>Y>X二、非选择题
-
30. 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。请回答:(1)、和中心原子的杂化方式分别为和。第一电离能介于B、N之间的第二周期元素有种。(2)、卤化物受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为(写化学式)。解释X的熔点比Y高的原因。(3)、一种铜的溴化物立方晶胞如图所示。

该化合物的化学式为 , 在晶体中与Cu距离最近且相等的Cu有个,若该晶体密度为 , 化合物式量为M,则该晶体中Cu原子与Br原子的最小核间距为pm(写出表达式,阿伏加德罗常数为)。
31. 氢能是一种极具发展潜力的清洁能源,下列物质都是具有广阔应用前景的储氢材料。回答下列问题:(1)、氢化钠(NaH)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原产物为。(2)、Ti-Fe合金室温下吸、放氢的速率快,Ti元素在周期表中的位置是。(3)、(氨硼烷)具有很高的储氢容量及相对低的放氢温度(<350℃),是颇具潜力的化学储氢材料之一,它可通过环硼氮烷、与进行合成。①中涉及的元素H、B、N电负性最大的是。
②键角:(填“>”、“<”或“=”),原因是。
(4)、Fe-Mg合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
①距离Mg原子最近的Fe原子个数是。
②若该晶胞的棱长为anm,阿伏加德罗常数的值为 , 则该合金的密度为。
③若该晶体储氢时,分子在晶胞的体心和棱心位置,则含Mg48g的该储氢合金可储存标准状况下的体积约为L。
32. 铜及其化合物在机械制造、国防建设中有着广泛的应用。回答下列问题:(1)、铜元素在元素周期表中的位置是。(2)、Cu2+能与NH3形成具有对称空间结构的[Cu(NH3)4]2+。①[Cu(NH3)4]2+的H—N—H键角(填“>”、“=”或“<”)NH3的H-N-H键角。
②若[Cu(NH3)4]2+中两个NH3分别被Cl-取代,能得到(m)、(n)两种不同结构的Cu(NH3)2Cl2:

[Cu(NH3)4]2+的空间构型是;在水中的溶解度:(m)(n)(填“>”、“=”或“<”)。
③NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,理由是。
(3)、一种钇钡铜氧晶体属四方晶系,品胞参数如图所示,晶胞棱长夹角均为90°。晶体中Y元素的化合价为+3价,Cu元素以+2和+3两种价态存在。基态Cu3+的价层电子的轨道表示式为;设NA为阿伏加德罗常数的值,钇钡铜氧的摩尔质量为Mg·mol-1 , 则该晶体的密度为g·cm-3(列出计算式);晶体中Cu3+与Cu2+个数比为。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。如原子分数坐标A为(0,0,0),B为( , , ),C为( , , m),则D的原子分数坐标为。 33. 胆矾化学式为CuSO4·5H2O。实验证明CuSO4·5H2O中有4个水分子为配位水分子,其结构示意图如下:回答下列问题:
33. 胆矾化学式为CuSO4·5H2O。实验证明CuSO4·5H2O中有4个水分子为配位水分子,其结构示意图如下:回答下列问题: (1)、基态铜原子的价层电子排布式为 , 位于周期表中第周期族。(2)、胆矾中S原子的杂化方式是 , H、O、S中,第一电离能最大的元素是(填元素符号)(3)、胆矾中存在的化学键有配位键、。(4)、含硫化合物SOCl2的VSEPR模型是 , 试分析该分子中健角∠Cl-S-O大于∠Cl-S-Cl的原因是。(5)、立方铜晶胞中铜原子的配位数为12,则每个晶胞中有个铜原子,铜原子的半径为rcm,则铜晶体的密度为g·cm-3(阿伏加德罗常数值用NA表示)。34. 铝的单质、合金及其化合物在生产、生活中具有广泛的应用。(1)、Al属于周期表中区元素,其基态原子核外具有种空间运动状态不同的电子。(2)、与Al位于同一周期,且第一电离能比Al小的元素有(填元素符号)。(3)、一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键;如果两个成键元素间的电负性差值小于1.7,它们之间通常形成共价键。部分主族元素的电负性如下表所示:
(1)、基态铜原子的价层电子排布式为 , 位于周期表中第周期族。(2)、胆矾中S原子的杂化方式是 , H、O、S中,第一电离能最大的元素是(填元素符号)(3)、胆矾中存在的化学键有配位键、。(4)、含硫化合物SOCl2的VSEPR模型是 , 试分析该分子中健角∠Cl-S-O大于∠Cl-S-Cl的原因是。(5)、立方铜晶胞中铜原子的配位数为12,则每个晶胞中有个铜原子,铜原子的半径为rcm,则铜晶体的密度为g·cm-3(阿伏加德罗常数值用NA表示)。34. 铝的单质、合金及其化合物在生产、生活中具有广泛的应用。(1)、Al属于周期表中区元素,其基态原子核外具有种空间运动状态不同的电子。(2)、与Al位于同一周期,且第一电离能比Al小的元素有(填元素符号)。(3)、一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键;如果两个成键元素间的电负性差值小于1.7,它们之间通常形成共价键。部分主族元素的电负性如下表所示:5B
2.0
6C
2.5
7N
3.0
8O
3.5
9F
4.0
13Al
1.5
14Si
1.8
15P
2.1
16S
2.5
17Cl
3.0
31Ga
1.6
32Ge
1.8
33As
2.0
34Se
2.4
35Br
2.8
下列含铝化合物属于离子化合物的是____(填标号)。
A、 B、 C、 D、AlP(4)、Al的熔点为660℃,Ga的熔点为29.76℃,Al的熔点更高的原因为。(5)、三甲基铝(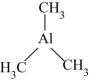 )是一种金属有机化合物,可作烯烃聚合催化剂、引火燃料。
)是一种金属有机化合物,可作烯烃聚合催化剂、引火燃料。①三甲基铝分子中C原子的VSEPR模型为 , Al原子的杂化轨道类型为。
②该物质可与胺类( , R表示烃基)结合,原因是。
(6)、X-射线衍射实验表明,合金Cr-Al晶体(有序)属四方晶系,其晶胞参数如图所示,晶胞棱边夹角均为90°。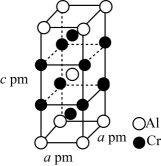
①该合鑫Cr-Al晶体的化学式为。
②用NA表示阿伏加德罗常数的值,则合金Cr-Al晶体的密度为(写出计算式即可,不要求化简)。
35. 五氟化锑主要用作氟化工的催化剂,也用作纺织工业织物阻燃剂,在染料工业中用于制造染料中间体,此外,还用于制备高纯度金属锑、无机离子交换材料和胶体五氧化二锑。以某锑矿(主要成分为Sb2O3 , 含有少量CuO、PbO、As2O3等杂质)为原料制备SbF5的工艺流程如图1:
已知:I.CuS、PbS的Ksp分别为6.3×10-36、9.0×10-29;
II.As2O3微溶于水、Sb2O3难溶于水,它们均为两性氧化物;SbOCl难溶于水。
回答下列问题:
(1)、已知锑与氮元同素主族,原子序数为51,请写出锑在元素周期表中的位置。(2)、“浸出”时少量Sb2O3转化为“滤渣1”。其成分为SbOCl,加入氨水“除氯”,同时将其转化为Sb2O3 , 该反应的离子方程式为 , 不宜用NaOH溶液代替氨水的原因为。(3)、“沉淀”的过程是加入极稀的Na2S溶液,其目的是使Cu2+和Pb2+转化为相应的硫化物而除去,当CuS、PbS共沉时,=。(4)、“除砷”时,H2PO转化为H3PO4 , 该反应中氧化剂与还原剂的物质的量之比为。(5)、“电解”中锑的产率与电压大小关系如图2所示。当电压趣过U0V时,锑的产率降低的原因可能是。 (6)、SbF5与KMnF6反应。首次实现了用化学方法制取F2 , 同时生成KSbF6和MnF3 , 化学反应方程式为。
(6)、SbF5与KMnF6反应。首次实现了用化学方法制取F2 , 同时生成KSbF6和MnF3 , 化学反应方程式为。