高考二轮复习知识点:元素周期表中原子结构与元素性质的递变规律6
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 下列有关物质性质的说法错误的是( )A、热稳定性:HCl>HI B、原子半径:Na>Mg C、酸性:H2SO3>H2SO4 D、结合质子能力:S2﹣>Cl﹣2. 已知W,X,Y,Z为短周期元素,原子序数依次增大.W,Z同主族,X,Y,Z同周期,其中只有X为金属元素.下列说法一定正确的是( )A、原子半径:X>Y>Z>W B、W的含氧酸的酸性比Z的含氧酸的酸性强 C、W的气态氢化物的稳定性小于Y的气态氢化物的稳定性 D、若W与X原子序数差为5,则形成化合物的化学式为X3W23. 短周期主族元素X,Y,Z,W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族.下列说法正确的是( )A、元素X,W的简单阴离子具有相同的电子层结构 B、由Y,Z两种元素组成的化合物是离子化合物 C、W的简单气态氢化物的热稳定性比Y的强 D、原子半径:r(X)<r(Y)<r(Z)<r(W)4. a、b、c、d为短周期元素,a的原子中只有1个电子,b2﹣和c+的电子层结构相同,d与b同族.下列叙述错误的是( )A、a与其他三种元素形成的二元化合物中其化合价均为+1 B、b与其他三种元素均可形成至少两种二元化合物 C、c的原子半径是这些元素中最大的 D、d与a形成的化合物的溶液呈弱酸性5. 短周期主族元素X,Y,Z,W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X,Y的核电荷数之比为3:4,W﹣的最外层为8电子结构,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,下列说法正确的是( )A、X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应 B、原子半径大小:X<Y,Z>W C、化合物Z2Y和ZWY3都只存在离子键 D、Y,W的某些单质或两元素之间形成的某些化合物可作水的消毒剂6. 一种锂离子电池的电解液添加剂,其结构如图所示,其中W、X、Y、Z是最外层电子数依次增大的同周期非金属元素。下列说法错误的是( )
 A、XY2是非电解质 B、WZ3中W没有达到8电子结构 C、最高价氧化物对应水化物第一步电离的常数:X>W D、最简单氢化物的稳定性:Y<X7. X、Y、Z、W为原子序数依次增大的短周期主族元素,Z的原子序数等于X与Y的原子序数之和,W的最外层电子数为K层的一半,X与Y可形成原子个数比为3 : 1的10电子分子。下列说法正确的是( )A、简单离子半径Z<Y<W B、Y和Z的简单气态氢化物的稳定性Z<Y C、W与Z形成的化合物中阴阳离子个数比均为1:2 D、由X、Y、Z三种元素所组成化合物的水溶液均显酸性8. 化合物M的结构如图所示。X、Y、Z、W为原子序数递增的短周期主族元素,Y在自然界中以化合态的形式存在,Z的最外层电子数是其电子层数的3倍。下列说法错误的是( )
A、XY2是非电解质 B、WZ3中W没有达到8电子结构 C、最高价氧化物对应水化物第一步电离的常数:X>W D、最简单氢化物的稳定性:Y<X7. X、Y、Z、W为原子序数依次增大的短周期主族元素,Z的原子序数等于X与Y的原子序数之和,W的最外层电子数为K层的一半,X与Y可形成原子个数比为3 : 1的10电子分子。下列说法正确的是( )A、简单离子半径Z<Y<W B、Y和Z的简单气态氢化物的稳定性Z<Y C、W与Z形成的化合物中阴阳离子个数比均为1:2 D、由X、Y、Z三种元素所组成化合物的水溶液均显酸性8. 化合物M的结构如图所示。X、Y、Z、W为原子序数递增的短周期主族元素,Y在自然界中以化合态的形式存在,Z的最外层电子数是其电子层数的3倍。下列说法错误的是( ) A、元素X、元素Z、元素W的单质熔点依次升高 B、X与W所形成的化合物中含有离子键 C、化合物M中各原子或离子均达到2或8电子稳定结构 D、当被强碱灼伤时,可用Y的最高价氧化物对应水化物稀溶液处理9. 一种由原子序数依次增大的短周期主族元素W、X、Y、Z组成的化合物在化学和医药工业中常用作还原剂(如图所示,其中一表示化学键,可能为单键或双键),X最外层电子数为电子层数的3倍。下列叙述正确的是( )
A、元素X、元素Z、元素W的单质熔点依次升高 B、X与W所形成的化合物中含有离子键 C、化合物M中各原子或离子均达到2或8电子稳定结构 D、当被强碱灼伤时,可用Y的最高价氧化物对应水化物稀溶液处理9. 一种由原子序数依次增大的短周期主族元素W、X、Y、Z组成的化合物在化学和医药工业中常用作还原剂(如图所示,其中一表示化学键,可能为单键或双键),X最外层电子数为电子层数的3倍。下列叙述正确的是( ) A、简单离子半径:Z>Y>X>W B、Y与X、Y与W形成的化合物化学键类型一定相同 C、X与Z形成的化合物中各原子均满足8电子稳定结构 D、Z的最高价氧化物对应的水化物酸性强于碳酸10. 下列关于第ⅣA族元素及相关物质的性质比较中,错误的是( )A、热稳定性:CH4>SiH4>GeH4 B、酸性:CH3COOH>H2CO3>H2SiO3 C、熔点:金刚石>晶体硅>晶体锗 D、第一电离能:C<Si<Ge11. 短周期主族非金属元素X、Y、Z、M的原子序数依次增大,其中Y与Z同族,Z原子最外层电子数等于X原子的核外电子总数,X与M、Y与Z的核电荷数之和均为22。下列说法正确的是( )A、将少量Na2CO3固体加入到X的最高价含氧酸的水溶液中,有气泡产生 B、X、Z分别与M形成的二元化合物中,各原子均满足8e-稳定结构 C、常温下,单质M能够从Y的简单氢化物中置换出单质Y D、X与Y形成的二元化合物为分子晶体,熔沸点低12. 短周期主族元素W、X、Y、Z的原子序数依次增大,它们形成的一种化合物的结构如图所示。已知W和X的原子序数之和与Y的最外层电子数相等。下列说法错误的是( )
A、简单离子半径:Z>Y>X>W B、Y与X、Y与W形成的化合物化学键类型一定相同 C、X与Z形成的化合物中各原子均满足8电子稳定结构 D、Z的最高价氧化物对应的水化物酸性强于碳酸10. 下列关于第ⅣA族元素及相关物质的性质比较中,错误的是( )A、热稳定性:CH4>SiH4>GeH4 B、酸性:CH3COOH>H2CO3>H2SiO3 C、熔点:金刚石>晶体硅>晶体锗 D、第一电离能:C<Si<Ge11. 短周期主族非金属元素X、Y、Z、M的原子序数依次增大,其中Y与Z同族,Z原子最外层电子数等于X原子的核外电子总数,X与M、Y与Z的核电荷数之和均为22。下列说法正确的是( )A、将少量Na2CO3固体加入到X的最高价含氧酸的水溶液中,有气泡产生 B、X、Z分别与M形成的二元化合物中,各原子均满足8e-稳定结构 C、常温下,单质M能够从Y的简单氢化物中置换出单质Y D、X与Y形成的二元化合物为分子晶体,熔沸点低12. 短周期主族元素W、X、Y、Z的原子序数依次增大,它们形成的一种化合物的结构如图所示。已知W和X的原子序数之和与Y的最外层电子数相等。下列说法错误的是( ) A、简单离子半径:Y>Z B、该化合物中X的杂化方式相同 C、第一电离能:Y>X D、化合物ZYW中既含离子键,又含极性共价键13. a、b、c、d、e为原子序数依次增大的短周期主族元素。X、Y、Z、W为这些元素形成的常见化合物,X为二元化合物,常温下0.1mol/L X溶液的pH=1。物质之间的转化关系如图所示。
A、简单离子半径:Y>Z B、该化合物中X的杂化方式相同 C、第一电离能:Y>X D、化合物ZYW中既含离子键,又含极性共价键13. a、b、c、d、e为原子序数依次增大的短周期主族元素。X、Y、Z、W为这些元素形成的常见化合物,X为二元化合物,常温下0.1mol/L X溶液的pH=1。物质之间的转化关系如图所示。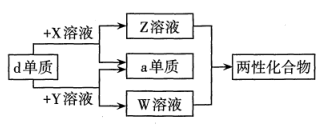
下列说法正确的是( )
A、简单离子半径:e>d> b B、b、c形成的化合物中都不含共价键 C、Z、W都能破坏水的电离平衡 D、b的氢化物稳定性一定强于e的氢化物14. 3体积浓硝酸和1体积浓盐酸组成的混合液叫做反王水,腐蚀能力强于王水,含有一种氧化性很强的离子(如图所示),其中不含氢元素。下列叙述错误的是( )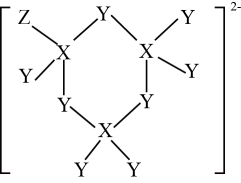 A、原子半径:r(Z)>r(X)>r( Y) B、X、Z均能与Y形成多种化合物 C、该离子中各元素原子均满足8电子稳定结构 D、X、Y、Z的气态氢化物中,沸点最高的是X的气态氢化物15. 一种由短周期主族元素组成的新型电池离子导体的结构如图所示,X、Y、Z原子序数依次增大,三者的核外电子数之和等于35,Y与Z位于同一周期。下列说法正确的是( )
A、原子半径:r(Z)>r(X)>r( Y) B、X、Z均能与Y形成多种化合物 C、该离子中各元素原子均满足8电子稳定结构 D、X、Y、Z的气态氢化物中,沸点最高的是X的气态氢化物15. 一种由短周期主族元素组成的新型电池离子导体的结构如图所示,X、Y、Z原子序数依次增大,三者的核外电子数之和等于35,Y与Z位于同一周期。下列说法正确的是( ) A、简单离子的半径:Y>X B、工业上常采用电解Y的氧化物冶炼单质Y C、同主族元素形成的简单氢化物中X的稳定性最强 D、同周期主族元素中第一电离能大于Z的元素有2种16. 现有处于不同主族的短周期元素A、B、C、D、E,其中B原子最外层电子数是电子层数的2倍,C是金属元素,0.1 mol·L-1的D的最高价氧化物的水化物溶液pH<1,五种元素的原子半径与原子序数的关系如图所示。下列推断错误的是( )
A、简单离子的半径:Y>X B、工业上常采用电解Y的氧化物冶炼单质Y C、同主族元素形成的简单氢化物中X的稳定性最强 D、同周期主族元素中第一电离能大于Z的元素有2种16. 现有处于不同主族的短周期元素A、B、C、D、E,其中B原子最外层电子数是电子层数的2倍,C是金属元素,0.1 mol·L-1的D的最高价氧化物的水化物溶液pH<1,五种元素的原子半径与原子序数的关系如图所示。下列推断错误的是( ) A、原子半径和离子半径均满足:E<C B、由C,E两种元素组成的化合物的水溶液能促进水的电离 C、最高价氧化物对应的水化物的酸性:B<D<E D、B与D形成的化合物BD2中原子的最外层都满足8电子稳定结构17. 一种高效电解质的结构如图所示,W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,X与Q同族,Y和Z的原子序数之和与Q相等。下列说法正确的是( )
A、原子半径和离子半径均满足:E<C B、由C,E两种元素组成的化合物的水溶液能促进水的电离 C、最高价氧化物对应的水化物的酸性:B<D<E D、B与D形成的化合物BD2中原子的最外层都满足8电子稳定结构17. 一种高效电解质的结构如图所示,W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,X与Q同族,Y和Z的原子序数之和与Q相等。下列说法正确的是( ) A、X与Q的最高化合价均为+6 B、化合物QX2、YX2均能与NaOH溶液反应 C、简单氢化物的沸点:Q>Z>X D、W单质在空气中燃烧的产物是W2O218. 2022年3月23日下午,在“四季如春”的中国空间站里,王亚平用过饱和X3Y2Z2M(结构为
A、X与Q的最高化合价均为+6 B、化合物QX2、YX2均能与NaOH溶液反应 C、简单氢化物的沸点:Q>Z>X D、W单质在空气中燃烧的产物是W2O218. 2022年3月23日下午,在“四季如春”的中国空间站里,王亚平用过饱和X3Y2Z2M(结构为 )溶液制作了一颗晶莹剔透的“冰球”,其中X、Y、Z、M是原子序数依次增大的短周期主族元素,M的原子半径是短周期主族元素中最大的。下列说法正确的是( ) A、简单离子半径:M>Z>X B、最简单氢化物的沸点:Z> Y C、X3Y2Z2M中,各原子均满足8e-稳定结构 D、X、Y形成的化合物一定不能使酸性KMnO4溶液褪色19. 物质M可用作调味剂、乳化剂、抗氧化增效剂、吸湿剂、调节剂、增香剂、缓冲剂,其结构式如图所示。M的组成元素X、Y、Z、Q为原子序数依次增大的短周期主族元素,且Y的一种核素常用于检测文物的年代。下列说法错误的是( )
)溶液制作了一颗晶莹剔透的“冰球”,其中X、Y、Z、M是原子序数依次增大的短周期主族元素,M的原子半径是短周期主族元素中最大的。下列说法正确的是( ) A、简单离子半径:M>Z>X B、最简单氢化物的沸点:Z> Y C、X3Y2Z2M中,各原子均满足8e-稳定结构 D、X、Y形成的化合物一定不能使酸性KMnO4溶液褪色19. 物质M可用作调味剂、乳化剂、抗氧化增效剂、吸湿剂、调节剂、增香剂、缓冲剂,其结构式如图所示。M的组成元素X、Y、Z、Q为原子序数依次增大的短周期主族元素,且Y的一种核素常用于检测文物的年代。下列说法错误的是( ) A、由Z和Q形成的化合物中可以存在共价键 B、Y与Z分别形成的最简单氢化物的沸点: C、X、Y、Z、Q四种元素原子半径的大小顺序为 D、该化合物中每个原子最外层电子都达到稳定结构20. 短周期主族元素W、X、Y、Z的原子序数依次增大,且原子序数之和为32,四种元素组成的一种物质的结构式如图所示,该物质是一种常见的化工原料,可用于合成除草剂、防火剂、甜味剂、防腐剂、金属清洗剂等。下列说法错误的是( )
A、由Z和Q形成的化合物中可以存在共价键 B、Y与Z分别形成的最简单氢化物的沸点: C、X、Y、Z、Q四种元素原子半径的大小顺序为 D、该化合物中每个原子最外层电子都达到稳定结构20. 短周期主族元素W、X、Y、Z的原子序数依次增大,且原子序数之和为32,四种元素组成的一种物质的结构式如图所示,该物质是一种常见的化工原料,可用于合成除草剂、防火剂、甜味剂、防腐剂、金属清洗剂等。下列说法错误的是( ) A、原子半径:Z>Y>X>W B、X、Z的最高价氧化物的水化物均为强酸 C、简单氢化物的沸点:Y>X>Z D、四种元素能形成即含离子键又含共价键的化合物21. W、X、Z、Y为原子序数依次增大的短周期主族元素,Z与X最外层电子数之和是Y的最外层电子数的两倍,W与X可形成原子个数比为3:1的18e-分子。下列说法正确的是( )A、简单离子半径:Z>Y>W B、氢化物沸点:Z>X C、X与Z形成的化合物均可以用排空气法收集 D、Y的某种氧化物的水化物可形成二元酸22. 某化合物结构如图所示,其中X。Y、W、Z是原子序数依次增大的短周期元素,且四种元素分布在三个周期,W的最外层电子数是Y的最外层电子数的2倍,Z和X同主族。下列说法正确的是( )
A、原子半径:Z>Y>X>W B、X、Z的最高价氧化物的水化物均为强酸 C、简单氢化物的沸点:Y>X>Z D、四种元素能形成即含离子键又含共价键的化合物21. W、X、Z、Y为原子序数依次增大的短周期主族元素,Z与X最外层电子数之和是Y的最外层电子数的两倍,W与X可形成原子个数比为3:1的18e-分子。下列说法正确的是( )A、简单离子半径:Z>Y>W B、氢化物沸点:Z>X C、X与Z形成的化合物均可以用排空气法收集 D、Y的某种氧化物的水化物可形成二元酸22. 某化合物结构如图所示,其中X。Y、W、Z是原子序数依次增大的短周期元素,且四种元素分布在三个周期,W的最外层电子数是Y的最外层电子数的2倍,Z和X同主族。下列说法正确的是( ) A、W与Z形成的化合物中只含离子键 B、该化合物中Y都满足8电子稳定结构 C、X3YW3是弱酸 D、离子半径:Z>W>Y23. 解痉药物奥昔布宁的结构简式如图所示。下列关于奥昔布宁的说法正确的是( )
A、W与Z形成的化合物中只含离子键 B、该化合物中Y都满足8电子稳定结构 C、X3YW3是弱酸 D、离子半径:Z>W>Y23. 解痉药物奥昔布宁的结构简式如图所示。下列关于奥昔布宁的说法正确的是( ) A、组成元素均位于元素周期表的p区 B、基态原子第一电离能:N>O>H>C C、分子中碳原子杂化轨道类型有2种 D、分子中两个六元环的成环原子均各自共面24. 前4周期主族元素X、Y、Z、W的原子序数依次增大,X的族序数是周期数的2倍,Y是短周期中金属性最强的元素,基态时Z原子价电子排布为 , W与Y处于同一主族。下列说法正确的是( )A、原子半径: B、X的氢化物的沸点一定比Z的低 C、Z的第一电离能比它左右相邻元素的都高 D、Y的最高价氧化物对应水化物的碱性比W的强25. 下列有关Na、Mg、Al的叙述正确的是( )A、元素均位于周期表s区 B、均可用电解法冶炼制得单质 C、原子均有一个未成对电子 D、还原性由弱到强:
A、组成元素均位于元素周期表的p区 B、基态原子第一电离能:N>O>H>C C、分子中碳原子杂化轨道类型有2种 D、分子中两个六元环的成环原子均各自共面24. 前4周期主族元素X、Y、Z、W的原子序数依次增大,X的族序数是周期数的2倍,Y是短周期中金属性最强的元素,基态时Z原子价电子排布为 , W与Y处于同一主族。下列说法正确的是( )A、原子半径: B、X的氢化物的沸点一定比Z的低 C、Z的第一电离能比它左右相邻元素的都高 D、Y的最高价氧化物对应水化物的碱性比W的强25. 下列有关Na、Mg、Al的叙述正确的是( )A、元素均位于周期表s区 B、均可用电解法冶炼制得单质 C、原子均有一个未成对电子 D、还原性由弱到强:二、多选题
-
26. 元素X,Y,Z原子序数之和为36,X,Y在同一周期,X+与Z2﹣具有相同的核外电子层结构.下列推测正确的是( )A、同周期元素中X的金属性最强 B、原子半径X>Y,离子半径X+>Z2﹣ C、同族元素中Z的氢化物沸点最低 D、同周期元素中Y的最高价含氧酸的酸性最强27. X,Y,Z,W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
 A、Y,Z,W处于同一周期 B、Y,W的最简单氢化物的水溶液能相互反应 C、非金属性:Y<Z D、X,Z,W形成的化合物为均强酸
A、Y,Z,W处于同一周期 B、Y,W的最简单氢化物的水溶液能相互反应 C、非金属性:Y<Z D、X,Z,W形成的化合物为均强酸三、非选择题
-
28. 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题:
 (1)、元素x在周期表中的位置是第周期,第族,其单质可采用电解熔融的方法制备.(2)、m、n、y三种元素最高价氧化物的水化物中,酸性最强的是 , 碱性最强的是 . (填化学式)(3)、气体分子(mn)2的电子式为 . (mn)2成为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为 .29. M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:(1)、R基态原子的电子排布式是 , X和Y中电负性较大的是(填元素符号).(2)、X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 .(3)、X与M形成的XM3分子的空间构型是 .(4)、M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是(填离子符号).
(1)、元素x在周期表中的位置是第周期,第族,其单质可采用电解熔融的方法制备.(2)、m、n、y三种元素最高价氧化物的水化物中,酸性最强的是 , 碱性最强的是 . (填化学式)(3)、气体分子(mn)2的电子式为 . (mn)2成为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为 .29. M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:(1)、R基态原子的电子排布式是 , X和Y中电负性较大的是(填元素符号).(2)、X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 .(3)、X与M形成的XM3分子的空间构型是 .(4)、M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是(填离子符号). (5)、在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是 .30. 哈佛大学A.Y.Liu教授首次合成类金刚石相氮化碳(β﹣﹣C3N4).福州大学王新晨教授在此基础上以单氰胺(CH2N2)为原料制得光催化剂类石墨相氮化碳(g﹣C3N4),其单层结构如图a,
(5)、在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是 .30. 哈佛大学A.Y.Liu教授首次合成类金刚石相氮化碳(β﹣﹣C3N4).福州大学王新晨教授在此基础上以单氰胺(CH2N2)为原料制得光催化剂类石墨相氮化碳(g﹣C3N4),其单层结构如图a, (1)、C,H,N元素电负性从大到小的顺序为(填元素符号).(2)、β﹣﹣C3N4熔点、硬度均高于金刚石,其原因为 .(3)、β﹣﹣C3N4和g﹣﹣C3N4中碳原子的杂化轨道类型分别为 .(4)、单氰胺的结构式为 .(5)、g﹣﹣C3N4中存在的作用力为(填序号).
(1)、C,H,N元素电负性从大到小的顺序为(填元素符号).(2)、β﹣﹣C3N4熔点、硬度均高于金刚石,其原因为 .(3)、β﹣﹣C3N4和g﹣﹣C3N4中碳原子的杂化轨道类型分别为 .(4)、单氰胺的结构式为 .(5)、g﹣﹣C3N4中存在的作用力为(填序号).a.离子键 b.σ键 c.π键 d.氢键 e.范德华力
(6)、g﹣﹣C3N4中掺杂少量铁元素能提高光催化效果.图b为g﹣﹣C3N4的另一种单层结构;图c为Fe3+掺杂前后N﹣1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图c中横坐标为g﹣﹣C3N4中N﹣1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移.①Fe3+的价电子轨道表示式为 .
②发生位移的谱线对应的N原子为(填图b中的序号).
③谱线右移的原因为
31. 元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4;M原子最外层电子数与次外层电子数之比为3:4;N﹣、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体.据此回答:(1)、M、N的最高价氧化物的水化物中酸性较强的是(写出化学式) .(2)、Z与M可形成常见固体化合物C,用电子式表示C的形成过程 .(3)、已知通常状况下1 g X2在Y2中完全燃烧放出a kJ的热量,请写出表示X2燃烧热的热化学方程式 .(4)、X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式 .(5)、化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1:1:1,A溶液中水的电离程度比在纯水中小.则化合物A中的化学键类型为;若B为常见家用消毒剂的主要成分,则B的化学式是 .(6)、均由X、Y、Z、M四种元素组成的两种盐发生反应的离子方程式是;其中一种是强酸所成的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 .32. 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.(1)、下列叙述正确的是 . (填字母)A、CH2O与水分子间能形成氢键 B、CH2O和CO2分子中的中心原子均采用sp2杂化 C、C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子 D、CO2晶体的熔点、沸点都比二氧化硅晶体的低(2)、Mn和Fe的部分电离能数据如表:元素
Mn
Fe
电离能
/kJ•mol﹣1
I1
717
759
I2
1509
1561
I3
3248
2957
Mn元素价电子排布式为 , 气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 .
(3)、Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为 . (4)、电镀厂排放的废水中常含有剧毒的CN﹣离子,可在X的催化下,先用NaClO将CN﹣氧化成CNO﹣ , 再在酸性条件下CNO﹣继续被NaClO氧化成N2和CO2 .
(4)、电镀厂排放的废水中常含有剧毒的CN﹣离子,可在X的催化下,先用NaClO将CN﹣氧化成CNO﹣ , 再在酸性条件下CNO﹣继续被NaClO氧化成N2和CO2 .①与CNO﹣互为等电子体微粒的化学式为(写出一种即可).
②氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 .
33. 锶(Sr)与镁是同主族元素.锶的单质及其化合物用途广泛,例如金属锶用于制造合金、光电管、照明灯,Sr(OH)2用于磨拉石的提纯,Sr(NO3)2用于烟火装置,SrCl2用于修补牙齿等.(1)、锶(Sr)位于周期表的第周期,第族,过氧化锶(SrO2)中锶元素的化合价为 .(2)、金属锶在常温下和水反应,有气体生成,写出该反应的化学方程式(3)、金属锶很活泼,在空气中易被氧化,可保存在中(填序号)①水②酒精③煤油
(4)、锶的性质与钙类似.已知:CaCl2易溶于水,CaF2难溶于水.请写出硝酸锶和氟化钠反应的离子方程式 .(5)、隔绝空气高温焙烧SrSO4和C粉的混合物,若2molSrSO4完全反应,只有S被还原并转移16mol电子,同时只生成一种可燃性气体.该反应的化学方程式: .(6)、在t℃时,某Sr(OH)2的稀溶液中c(H+)=10﹣amol•L﹣1 c(OH﹣)=10﹣bmol•L﹣1 , 已知a+b=12.向该溶液中逐滴加入pH=X的盐酸,测得混合溶液的部分pH如表所示.序号
Sr(OH)2溶液的体积/mL
盐酸的体积/mL
溶液的pH
①
②
22.00
18.00
7
③
22.00
22.00
6
若忽略溶液混合前后的体积变化,则X为(用数字填空).
34. X、Y、Z、T、W五种元素的性质或原子结构如下表:元素
元素性质或原子结构
X
原子的最外层电子数是次外层电子数的2倍
Y
常温下单质为双原子分子,其氢化物水溶液呈碱性
Z
基态原子最外层电子排布式为(n+1)sn(n+1)pn+2
T
与Z同周期,元素最高价是+7价
W
原子序数为Y、T元素之和,不锈钢中含有该元素
(1)、元素X的一种同位素可测定文物年代,这种同位素的符号是;W元素基态原子电子排布式为 .(2)、元素Z与元素T相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是 .A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
(3)、常见溶剂XZ2的分子中,含有的σ键与π键个数比为 , 它所形成的晶体类型为; Y的常见氢化物易液化的主要原因是(4)、①自然界常见的X元素含氧酸的钙盐和适量T的氢化物溶液反应时,每产生4.4g 气体(不考虑气体溶解)放热a kJ,则该反应的热化学方程式为 .②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示

请用离子方程式表示BC段、CD段发生的反应:
BC段:;
CD段: .
35. 决定物质性质的重要因素是物质结构。请回答下列问题。(1)、已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:电离能/kJ·mol-1
I1
I2
I3
I4
A
578
1817
2745
11578
B
738
1451
7733
10540
A通常显价,B元素的核外电子排布式为。
(2)、波长为300nm紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因是。组成蛋白质的最简单的氨基酸中的碳原子杂化类型是。共价键
C-C
C-N
C-S
键能/ kJ·mol-1
347
305
259
(3)、实验证明:KCl、MgO、CaO、TiN这4种晶体的结构
与NaCl晶体结构相似(如下图所示),已知3种离子晶体的晶格能数据如下表:

离子晶体
NaCl
KCl
CaO
晶格能/kJ·mol-1
786
715
3401
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有个。
(4)、金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是。(5)、某配合物的分子结构如下图所示,其分子内不含有 (填序号)。
 A、离子键 B、极性键 C、金属键 D、配位键 E、氢键 F、非极性键36. 金属锂及其化合物在国民经济建设中用途广泛,占有重要地位.
A、离子键 B、极性键 C、金属键 D、配位键 E、氢键 F、非极性键36. 金属锂及其化合物在国民经济建设中用途广泛,占有重要地位.
(1)、锂在元素周期表中的位置是(2)、可以证明锂的金属性弱于钠的实验事实是(3)、下图是以某富铿卤水(主要含Na+、K+、Li+、Mg2+、Cl一等)进行的沉锂工艺路线图.

①“二次除镁”所得的沉淀中主要有碱式碳酸镁和
②“沉锂”和“二次除镁”时所用纯碱的浓度差异的原因是
(4)、将上述制备的碳酸锂加硫酸制得硫酸锂溶液,再用如右图所示装置制备氢氧化锉.①碳酸锂与硫酸反应的离子方程式是
②结合电极反应式简述制得LiOH的原理:
③该法中可循环利用的物质是 .