高考二轮复习知识点:元素周期表中原子结构与元素性质的递变规律5
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 下列有关物质性质的比较,结论正确的是( )A、溶解度:Na2CO3<NaHCO3 B、热稳定性:HCl<PH3 C、沸点:C2H5SH<C2H5OH D、碱性:LiOH<Be(OH)22. a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族,下列叙述正确的是( )A、原子半径:d>c>b>a B、4种元素中b的金属性最强 C、c的氧化物的水化物是强碱 D、d单质的氧化性比a单质的氧化性强3. 短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素.下列说法正确的是( )A、原子半径 r(X)<r(Y)<r(Z)<r(W) B、W的最高价氧化物的水化物是一种弱碱 C、Y的单质的氧化性比Z的强 D、X、Y、Z 三种元素可以组成共价化合物和离子化合物4. X、Y、Z、W、R是原子序数依次增大的短周期主族元素,其最外层电子数之和为9。部分元素形成的一种常用还原剂结构如图所示。下列说法正确的是( )
 A、原子的半径:X>Y B、W最高价氧化物对应的水化物一定能与R单质反应 C、Z与氮原子可形成共价晶体 D、Z的氟化物ZF3中,原子均为8电子稳定结构5. 短周期主族元素X、Y、Z、W的原子序数依次增大,其最外层电子数之和为18。X、Y与Z、W位于不同周期,X、Z处于对角线位置且其单质都能与强酸、强碱溶液反应。下列说法错误的是A、Z的最高价氧化物为两性氧化物 B、单质的熔点: C、Z与W形成的化合物是共价化合物 D、简单氢化物的稳定性:6. X、Y、Z为短周期元素且原子序数依次增大,其中Y、Z为同一周期元素,X为周期表中电负性最强的元素,三者可以形成Y3ZX6配合物。下列说法正确的是A、原子半径: B、Y和Z最高价氧化物对应的水化物可以相互反应 C、X的氢化物为强酸,可与反应 D、该配合物在水中的电离方程式为7. 以下事实可以判断元素的非金属性氧强于氮的是A、相对原子质量:O>N B、空气中含量:N2>O2 C、沸点:H2O>NH3 D、NH3在O2中燃烧生成N28. 关于前四周期主族元素6C、12Mg、17Cl、32Ge的判断正确的是( )A、原子半径:r(Ge)>r(Cl)>r(Mg)>r(C) B、热稳定性:CH4>GeH4 C、酸性:H2GeO3>HClO4 D、Ge位于第四周期VIA族9. 如图是元素周期表的一部分。X、Y、Z、W均为短周期元素,若Z原子序数是Y的两倍,则下列说法错误的是
A、原子的半径:X>Y B、W最高价氧化物对应的水化物一定能与R单质反应 C、Z与氮原子可形成共价晶体 D、Z的氟化物ZF3中,原子均为8电子稳定结构5. 短周期主族元素X、Y、Z、W的原子序数依次增大,其最外层电子数之和为18。X、Y与Z、W位于不同周期,X、Z处于对角线位置且其单质都能与强酸、强碱溶液反应。下列说法错误的是A、Z的最高价氧化物为两性氧化物 B、单质的熔点: C、Z与W形成的化合物是共价化合物 D、简单氢化物的稳定性:6. X、Y、Z为短周期元素且原子序数依次增大,其中Y、Z为同一周期元素,X为周期表中电负性最强的元素,三者可以形成Y3ZX6配合物。下列说法正确的是A、原子半径: B、Y和Z最高价氧化物对应的水化物可以相互反应 C、X的氢化物为强酸,可与反应 D、该配合物在水中的电离方程式为7. 以下事实可以判断元素的非金属性氧强于氮的是A、相对原子质量:O>N B、空气中含量:N2>O2 C、沸点:H2O>NH3 D、NH3在O2中燃烧生成N28. 关于前四周期主族元素6C、12Mg、17Cl、32Ge的判断正确的是( )A、原子半径:r(Ge)>r(Cl)>r(Mg)>r(C) B、热稳定性:CH4>GeH4 C、酸性:H2GeO3>HClO4 D、Ge位于第四周期VIA族9. 如图是元素周期表的一部分。X、Y、Z、W均为短周期元素,若Z原子序数是Y的两倍,则下列说法错误的是X
Y
Z
W
A、X元素的简单氢化物分子间可以形成氢键 B、Y元素与X、Z、W元素均可形成两种以上的化合物 C、最高价氧化物对应水化物的酸性:W>Z D、阴离子半径由大到小的顺序为:X>Y>Z>W10. 原子序数依次增大的三种短周期元素X、Y和Z,X的氢化物极易溶于Y的氢化物中,常温下,Z的单质可溶于X的最高价氧化物的水化物的稀溶液中,但不能溶于其浓溶液。下列说法正确的是A、X和Y可形成多种化合物,且这些化合物均具有氧化性 B、三种元素的最高正化合价均与其原子的最外层电子数相等 C、三种元素的简单离子的半径大小顺序,与原子半径的大小顺序相同 D、X和Y的氢化物的稳定性:X<Y11. 2022年7月25日,由河南科学家研发的阿兹夫定片获批上市,这是我国首款抗新冠口服药物,其有效成分的结构简式如图所示:
下列说法错误的是( )
A、-NH2的电子式为 B、非金属性:F>O>N>H
C、该有机物能发生氧化反应
D、1 mol该物质最多与1 mol Na反应
12. 短周期主族元素X、Y、Z、W原子序数依次增大,其中X、W同主族,元素X的原子最外层电子数是其内层电子数的3倍,Y是短周期中金属性最强的元素,Z是地壳中含量最多的金属元素。下列说法正确的是( )A、原子半径:W>Z>Y>X B、简单气态氢化物的稳定性:W>X C、元素Z、W的最高价氧化物对应的水化物能发生反应 D、X分别与Y、Z、W都能形成多种化合物13. 化合物R(结构式如图所示)具有强大的氧化能力,可有效改善水质。已知X、Y、Z、W是原子序数依次增大的前20号主族元素,X与W、Y与Z分别同主族,Z、W对应的简单离子核外电子排布相同。下列说法正确的是( )
B、非金属性:F>O>N>H
C、该有机物能发生氧化反应
D、1 mol该物质最多与1 mol Na反应
12. 短周期主族元素X、Y、Z、W原子序数依次增大,其中X、W同主族,元素X的原子最外层电子数是其内层电子数的3倍,Y是短周期中金属性最强的元素,Z是地壳中含量最多的金属元素。下列说法正确的是( )A、原子半径:W>Z>Y>X B、简单气态氢化物的稳定性:W>X C、元素Z、W的最高价氧化物对应的水化物能发生反应 D、X分别与Y、Z、W都能形成多种化合物13. 化合物R(结构式如图所示)具有强大的氧化能力,可有效改善水质。已知X、Y、Z、W是原子序数依次增大的前20号主族元素,X与W、Y与Z分别同主族,Z、W对应的简单离子核外电子排布相同。下列说法正确的是( ) A、X与Y只能形成一种化合物 B、化合物R中Y的化合价有2种 C、W可与反应生成Y的单质 D、Y和Z形成的化合物的水溶液呈碱性14. 已知X、Y、Z、W、M为原子序数依次递增的短周期元素,其中X、Y、Z元素同周期, Y与W元素同主族,它们可以形成一种重要化合物甲。其结构如图所示。下列说法正确的是( )
A、X与Y只能形成一种化合物 B、化合物R中Y的化合价有2种 C、W可与反应生成Y的单质 D、Y和Z形成的化合物的水溶液呈碱性14. 已知X、Y、Z、W、M为原子序数依次递增的短周期元素,其中X、Y、Z元素同周期, Y与W元素同主族,它们可以形成一种重要化合物甲。其结构如图所示。下列说法正确的是( ) A、原子半径:M>W>Z B、第一电离能:Y>Z>X C、氢化物的沸点:Z>Y>X D、甲中W的杂化方式为sp215. 有一种净水剂,结构如图所示,短周期元素X、Y、Z、W原子序数依次增大,X、Y、Z分布在不同周期,X、Y原子的最外层电子数之和等于W原子的最外层电子数,W与Z的原子序数相差4,下列叙述正确的是( )
A、原子半径:M>W>Z B、第一电离能:Y>Z>X C、氢化物的沸点:Z>Y>X D、甲中W的杂化方式为sp215. 有一种净水剂,结构如图所示,短周期元素X、Y、Z、W原子序数依次增大,X、Y、Z分布在不同周期,X、Y原子的最外层电子数之和等于W原子的最外层电子数,W与Z的原子序数相差4,下列叙述正确的是( ) A、Y、Z的简单离子的半径Z>Y B、的水溶液中可能存在 C、X与Z不可形成离子晶体 D、Z、W的最高价氧化物对应的水化物之间不能发生反应16. 化合物是一种重要的储氢材料,电子式如图所示,X、Y、Z是原子序数依次增大的短周期元素,其中只有一种为非金属元素,Y、Z在同一个周期,X是周期表中原子半径最小的元素。下列叙述错误的是( )
A、Y、Z的简单离子的半径Z>Y B、的水溶液中可能存在 C、X与Z不可形成离子晶体 D、Z、W的最高价氧化物对应的水化物之间不能发生反应16. 化合物是一种重要的储氢材料,电子式如图所示,X、Y、Z是原子序数依次增大的短周期元素,其中只有一种为非金属元素,Y、Z在同一个周期,X是周期表中原子半径最小的元素。下列叙述错误的是( ) A、Y是短周期中元素最高价氧化物对应的水化物碱性最强的 B、Z氢氧化物能和强酸反应但不和强碱反应 C、X的单质是理想的燃料 D、化合物有强还原性17. 一种矿石[Y3Z2X5(XW)4]的组成元素W、X、Y、Z为原子序数依次增大的短周期元素,其中W、X、Z分别位于不同周期,Z核外最外层电子数是X核外电子数的一半,1个W2X分子含有10个电子。下列说法正确的是( )A、原子半径:Y>Z>X>W B、Y与X形成的化合物可与NaOH溶液反应 C、简单氢化物的沸点:Z>X D、Z的最高价氧化物不能与酸、碱反应18. W、X、Y、Z为原子序数依次增大的短周期主族元素,Y的原子序数等于W与X的原子序数之和,Z是地壳中含量最丰富的金属元素,W与X可形成原子个数比2∶1的分子,下列说法正确的是( )A、X与Z能形成耐高温的无机材料 B、简单离子半径Z>X>Y C、由W、X、Y三种元素所组成的化合物的水溶液均显酸性 D、非金属性:X>Y>W19. X、Y、Z、W、M均为短周期主族元素,X、Y同周期,Z、W、M也处于同一周期,Y是形成化合物种类最多的元素,M为短周期中除稀有气体元素外原子半径最大的元素,X、Y原子最外层电子数之和等于Z、W原子最外层电子数之和,X、W的简单离子X2-、W3+具有相同的电子层结构。下列说法正确的是( )A、Y最高价氧化物对应的水化物为强酸 B、原子半径大小顺序为:M>W>X>Y>Z C、水溶液中Z的单核离子能促进水的电离 D、简单氢化物的沸点:X>Y20. W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的核外电子数等于W与Y的核外电子数之和,W的最外层电子数为偶数。四种元素中只有Y为金属元素。下列说法正确的是( )A、原子半径: Y>Z>X> W B、X与Y形成的化合物只含离子键 C、常温常压下,X的简单氢化物为气态 D、最高价氧化物的水化物酸性: Z> W21. 随着原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小,最高正价或最低负价的变化如图所示,下列说法错误的是( )
A、Y是短周期中元素最高价氧化物对应的水化物碱性最强的 B、Z氢氧化物能和强酸反应但不和强碱反应 C、X的单质是理想的燃料 D、化合物有强还原性17. 一种矿石[Y3Z2X5(XW)4]的组成元素W、X、Y、Z为原子序数依次增大的短周期元素,其中W、X、Z分别位于不同周期,Z核外最外层电子数是X核外电子数的一半,1个W2X分子含有10个电子。下列说法正确的是( )A、原子半径:Y>Z>X>W B、Y与X形成的化合物可与NaOH溶液反应 C、简单氢化物的沸点:Z>X D、Z的最高价氧化物不能与酸、碱反应18. W、X、Y、Z为原子序数依次增大的短周期主族元素,Y的原子序数等于W与X的原子序数之和,Z是地壳中含量最丰富的金属元素,W与X可形成原子个数比2∶1的分子,下列说法正确的是( )A、X与Z能形成耐高温的无机材料 B、简单离子半径Z>X>Y C、由W、X、Y三种元素所组成的化合物的水溶液均显酸性 D、非金属性:X>Y>W19. X、Y、Z、W、M均为短周期主族元素,X、Y同周期,Z、W、M也处于同一周期,Y是形成化合物种类最多的元素,M为短周期中除稀有气体元素外原子半径最大的元素,X、Y原子最外层电子数之和等于Z、W原子最外层电子数之和,X、W的简单离子X2-、W3+具有相同的电子层结构。下列说法正确的是( )A、Y最高价氧化物对应的水化物为强酸 B、原子半径大小顺序为:M>W>X>Y>Z C、水溶液中Z的单核离子能促进水的电离 D、简单氢化物的沸点:X>Y20. W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的核外电子数等于W与Y的核外电子数之和,W的最外层电子数为偶数。四种元素中只有Y为金属元素。下列说法正确的是( )A、原子半径: Y>Z>X> W B、X与Y形成的化合物只含离子键 C、常温常压下,X的简单氢化物为气态 D、最高价氧化物的水化物酸性: Z> W21. 随着原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小,最高正价或最低负价的变化如图所示,下列说法错误的是( ) A、常见离子半径:g>h>d>e B、上述元素组成的ZX4f(gd4)2溶液中,离子浓度:c(f3+)>c(zx4+) C、由d、e、g三种元素组成的盐溶液和稀硫酸反应可能生成沉淀 D、f的最高价氧化物的水化物可以分别与e和h的最高价氧化物的水化物发生反应22. 短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、W处于同一主族Y、Z的原子最外层电子数之和等于8,X的简单氢化物与W的简单氢化物反应有大量白烟生成。下列说法正确的是( )A、简单离子半径:Y<Z<W B、Z与W形成化合物的水溶液呈碱性 C、W的某种氧化物可用于杀菌消毒 D、Y分别与X、Z形成的化合物,所含化学键的类型相同23. X、Y、 Z、W是原子序数依次增大的短周期主族元素,乙是元素Z的单质,甲、丙、丁、戊、己是由其中两种元素组成的化合物,已知气体甲的水溶液呈碱性,丁为淡黄色固体,己为红棕色气体,上述物质的转化关系如图所示。下列说法错误的是( )
A、常见离子半径:g>h>d>e B、上述元素组成的ZX4f(gd4)2溶液中,离子浓度:c(f3+)>c(zx4+) C、由d、e、g三种元素组成的盐溶液和稀硫酸反应可能生成沉淀 D、f的最高价氧化物的水化物可以分别与e和h的最高价氧化物的水化物发生反应22. 短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、W处于同一主族Y、Z的原子最外层电子数之和等于8,X的简单氢化物与W的简单氢化物反应有大量白烟生成。下列说法正确的是( )A、简单离子半径:Y<Z<W B、Z与W形成化合物的水溶液呈碱性 C、W的某种氧化物可用于杀菌消毒 D、Y分别与X、Z形成的化合物,所含化学键的类型相同23. X、Y、 Z、W是原子序数依次增大的短周期主族元素,乙是元素Z的单质,甲、丙、丁、戊、己是由其中两种元素组成的化合物,已知气体甲的水溶液呈碱性,丁为淡黄色固体,己为红棕色气体,上述物质的转化关系如图所示。下列说法错误的是( ) A、原子半径大小:W>Y>Z>X B、丁中阴阳离子个数比为1:1 C、W的单质能与戊反应 D、X与W形成的化合物为离子化合物
A、原子半径大小:W>Y>Z>X B、丁中阴阳离子个数比为1:1 C、W的单质能与戊反应 D、X与W形成的化合物为离子化合物二、多选题
-
24. W、X、Y、Z是原子序数依次增大的短周期主族元素.W的气态氢化物的水溶液显碱性,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍.下列说法错误的是( )A、阴离子的还原性:Y>X B、Y和Z的简单阴离子都会破坏水的电离平衡 C、最高价氧化物的水化物的酸性:Z>Y D、氢化物的热稳定性:W>X25. 短周期主族元素X,Y,Z,W原子序数依次增大,X与Z原子序数相差8,Y元素的焰色为黄色,Z元素的最高价为+6.下列叙述正确的是 ( )A、半径:r(X2﹣)>r(Y+) B、沸点:H2Z>H2X C、稳定性:H2Z>HW D、熔点:Y2X>Y2Z
三、非选择题
-
26. 磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)、上述流程中能加快反应速率的措施有。(2)、磷精矿粉酸浸时发生反应:①该反应体现出酸性关系: H3PO4 H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,。
(3)、酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:。(4)、H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。800C后脱除率变化的原因:。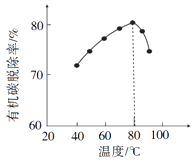 (5)、脱硫时,CaCO3稍过量,充分反应后仍有SO24-残留,原因是:;加入BaCO3可进一步提高硫的脱除率,其离子方程式是。(6)、取ag所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用bmol·L-1NaOH溶液滴定至终点时生成Na2HPO4 , 消耗NaOH溶液cmL,精制磷酸中H3PO4的质量分数是。(已知:H3PO4摩尔质量为98g·mol-1)27. X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:(1)、X与L组成的最简单化合物的电子式为。(2)、X与M组成的物质为(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为。(3)、Y在周期表中的位置是 , 其含氧酸的化学式为。(4)、L与M形成的化合物中L的化合价是。28. A,B,C,D,E是五种短周期的主族元素,它们的原子序数依次增大,A,D都能与C按原子个数比为1:1或2:1形成化合物,A,B组成的气态化合物可以与B的最高价氧化物的水化物反应生成一种盐M,E与C的最外层电子数相同.(1)、已知:E(s)+O2(g)═EO2(g)△H1 , E(g)+O2(g)═EO2(g)△H2 , 则△H1(填“>”“<”或“=”)△H2 .(2)、M中含有的化学键有 , E元素在周期表中的位置是 .(3)、向100mL 0.1mol•L﹣1 D的氢氧化物溶液中通入224mL A2E(标准状况下)气体,所得溶液呈碱性,原因是 , 溶液中离子浓度由大到小的顺序为 .(4)、B、C所形成氢化物的稳定性由强到弱的顺序是(填具体的化学式).(5)、有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl﹣NH4Cl溶液为电解质溶液制造新型燃料电池,写出该电池的正极电极反应式: , 放电时溶液中的H+移向(填“正”或“负”)29. 有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3:1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大.(1)、B与D形成的非极性分子中中心原子的孤对电子数是 , 中心原子的杂化轨道类型为 .(2)、A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是(写分子式),它们的稳定性由弱到强的顺序是(写分子式).(3)、分子ABC、BA2D的空间构型分别是、 .(4)、B、C、D三种元素的电负性由大到小的顺序是(用元素符号表示),第一电离能由大到小的顺序是(用元素符号表示).(5)、C的单质分子中存在个π键、个σ键.30. 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:
(5)、脱硫时,CaCO3稍过量,充分反应后仍有SO24-残留,原因是:;加入BaCO3可进一步提高硫的脱除率,其离子方程式是。(6)、取ag所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用bmol·L-1NaOH溶液滴定至终点时生成Na2HPO4 , 消耗NaOH溶液cmL,精制磷酸中H3PO4的质量分数是。(已知:H3PO4摩尔质量为98g·mol-1)27. X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:(1)、X与L组成的最简单化合物的电子式为。(2)、X与M组成的物质为(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为。(3)、Y在周期表中的位置是 , 其含氧酸的化学式为。(4)、L与M形成的化合物中L的化合价是。28. A,B,C,D,E是五种短周期的主族元素,它们的原子序数依次增大,A,D都能与C按原子个数比为1:1或2:1形成化合物,A,B组成的气态化合物可以与B的最高价氧化物的水化物反应生成一种盐M,E与C的最外层电子数相同.(1)、已知:E(s)+O2(g)═EO2(g)△H1 , E(g)+O2(g)═EO2(g)△H2 , 则△H1(填“>”“<”或“=”)△H2 .(2)、M中含有的化学键有 , E元素在周期表中的位置是 .(3)、向100mL 0.1mol•L﹣1 D的氢氧化物溶液中通入224mL A2E(标准状况下)气体,所得溶液呈碱性,原因是 , 溶液中离子浓度由大到小的顺序为 .(4)、B、C所形成氢化物的稳定性由强到弱的顺序是(填具体的化学式).(5)、有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl﹣NH4Cl溶液为电解质溶液制造新型燃料电池,写出该电池的正极电极反应式: , 放电时溶液中的H+移向(填“正”或“负”)29. 有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3:1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大.(1)、B与D形成的非极性分子中中心原子的孤对电子数是 , 中心原子的杂化轨道类型为 .(2)、A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是(写分子式),它们的稳定性由弱到强的顺序是(写分子式).(3)、分子ABC、BA2D的空间构型分别是、 .(4)、B、C、D三种元素的电负性由大到小的顺序是(用元素符号表示),第一电离能由大到小的顺序是(用元素符号表示).(5)、C的单质分子中存在个π键、个σ键.30. 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:A的单质是密度最小的物质;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子;C的原子最外层电子数是其内层电子数的三倍;D与B同周期,该周期中D的简单离子半径最小;B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分;F元素最高正价与最低负价的代数和为4.
(1)、写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式 .(2)、D、E、F的简单离子半径由大到小的顺序是(直接用化学式表示) .(3)、向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等.则原混合物中D单质的质量分数为 .(4)、一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.t2时反应的化学方程式为 . (5)、A、B形成的化合物BA在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物.写出它与乙醇反应的化学方程式 .31. A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
(5)、A、B形成的化合物BA在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物.写出它与乙醇反应的化学方程式 .31. A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题: (1)、A、B、C的第一电离能由小到大的顺序是(用对应的元素符号表示);基态D原子的电子排布式为 .(2)、A的最高价氧化物对应的水化物分子中,其中心原子采取杂化;BC 的空间构型为(用文字描述).(3)、1molAB﹣中含有的π键数目为 .(4)、如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是 .(5)、镧镍合金与上述合金都具有相同类型的晶胞结构XYn , 它们有很强的储氢能力.已知镧镍合金LaNin晶胞体积为9.0×10﹣23 cm3 , 储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=(填数值);氢在合金中的密度为32. 现有A、B、C、D、E、F六种原子序数依次增大的短周期主族元素.已知A与D同主族且能形成离子化合物DA,B元素氢化物的水溶液呈碱性,C与E同主族且EC2是一种具有刺激性气味的气体.用化学用语回答下列问题:(1)、元素F在周期表中的位置 .(2)、C、D、E三种元素原子半径由大到小的顺序为 . A、C、D三种元素组成的化合物和单质F反应的离子方程式为 .(3)、B与F形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为 .(4)、已知0.50mol EC2被C2氧化成气态EC3 , 放出49.15kJ热量,其热化学方程式为 .(5)、A、B、C以原子个数比4:2:3所形成的化合物,所含的化学键类型为;0.1mol•L﹣1的该化合物水溶液中的离子浓度由大到小的顺序为: .33. R、T、V、X、Y分别代表原子序数依次增大的短周期主族元素,在已发现的元素里R的原子半径最小;T、V同主族,T与Y可组成共价化合物TY3;X的晶体熔点高、硬度大、有脆性,在常温下化学性质不活泼.Z元素基态原子核外M能层上p轨道与d轨道的电子总数相等.
(1)、A、B、C的第一电离能由小到大的顺序是(用对应的元素符号表示);基态D原子的电子排布式为 .(2)、A的最高价氧化物对应的水化物分子中,其中心原子采取杂化;BC 的空间构型为(用文字描述).(3)、1molAB﹣中含有的π键数目为 .(4)、如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是 .(5)、镧镍合金与上述合金都具有相同类型的晶胞结构XYn , 它们有很强的储氢能力.已知镧镍合金LaNin晶胞体积为9.0×10﹣23 cm3 , 储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=(填数值);氢在合金中的密度为32. 现有A、B、C、D、E、F六种原子序数依次增大的短周期主族元素.已知A与D同主族且能形成离子化合物DA,B元素氢化物的水溶液呈碱性,C与E同主族且EC2是一种具有刺激性气味的气体.用化学用语回答下列问题:(1)、元素F在周期表中的位置 .(2)、C、D、E三种元素原子半径由大到小的顺序为 . A、C、D三种元素组成的化合物和单质F反应的离子方程式为 .(3)、B与F形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为 .(4)、已知0.50mol EC2被C2氧化成气态EC3 , 放出49.15kJ热量,其热化学方程式为 .(5)、A、B、C以原子个数比4:2:3所形成的化合物,所含的化学键类型为;0.1mol•L﹣1的该化合物水溶液中的离子浓度由大到小的顺序为: .33. R、T、V、X、Y分别代表原子序数依次增大的短周期主族元素,在已发现的元素里R的原子半径最小;T、V同主族,T与Y可组成共价化合物TY3;X的晶体熔点高、硬度大、有脆性,在常温下化学性质不活泼.Z元素基态原子核外M能层上p轨道与d轨道的电子总数相等.请回答下列问题:
(1)、Z元素基态原子的电子排布式是 .
(2)、利用价层电子对互斥理论判断TY3的空间构型是 .
(3)、V、X、Y的单质形成的晶体,熔点由高到低的排列顺序是(填化学式);LiTR4为近年来储氢材料领域的研究热点,其中TR4﹣的电子式为;V的氢氧化物作弱酸时有类似TR4﹣的离子产生,其电离方程式为 .(4)、Y的二氧化物为一种气体,它是新一代饮用水的消毒剂、可用NaYO3与浓盐酸反应制取,在该反应中氧化剂与还原剂的物质的量之比为1:1,其化学方程式为 .34. 从含氮化合物资料中查得:HNO2是一种不稳定的弱酸,Ki=4.6×10﹣4;NaNO2是一种白色易溶于水的固体,俗称工业盐.(1)、N原子最外层电子的轨道排布式为;下列选项可作为比较氮和氧非金属性强弱的判断依据的是 .a.氢化物稳定性:H2O>NH3 b.沸点:H2O>NH3
c.NO中N为+2价,O为﹣2价 d.碱性:NH3>H2O.
(2)、误食NaNO2会导致血红蛋白中的二价铁转化为三价铁而引起中毒,该过程中NaNO2发生反应(填“氧化”或“还原”,下同);服用维生素C可解毒,说明维生素C具有性.(3)、把NaNO2加入新制的氯水中,氯水褪色,产物之一是NaNO3 , 写出该反应的化学方程式:;若生成0.1mol NaNO3 , 转移电子数为 .(4)、将同为0.1mol/L的HNO2溶液与Na2CO3溶液等体积混合,充分反应后,溶液中阴离子浓度由大到小的顺序为:(用离子符号表示)已知:H2CO3=4.3×10﹣7 =5.6×10﹣11 .
35. 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.(1)、Ⅰ.将钠、钾、镁、铝各1mol分别投入到足量的0.1mol•L﹣1的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应最慢.(2)、将NaOH溶液与NH4Cl溶液混合生成NH3•H2O,从而验证NaOH的碱性大于NH3•H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由: , .(3)、Ⅱ.利用如图装置可以验证非金属性的变化规律.
仪器A的名称为 , 干燥管D的作用是 .
(4)、实验室中现有药吕Na2S、KMnO4、浓盐酸、MnO2 , 请选择合适药品设计实验验证氯的非金属性大于硫;装置A、B、C中所装药品分别为、、 . 装置C中实验现象为有淡黄色沉淀生成,离子方程式为 .(5)、若要证明非金属性:C>Si,则A中 , B中加Na2CO3、C中加 , 观察到C中溶液的现象为 .