高考二轮复习知识点:元素周期表中原子结构与元素性质的递变规律4
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
 A、原子半径:W<X B、常温常压下,Y单质为固态 C、气态氢化物热稳定性:Z<W D、X的最高价氧化物的水化物是强碱2. 2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟( )等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷( )同周期。下列说法不正确的是( )
A、原子半径:W<X B、常温常压下,Y单质为固态 C、气态氢化物热稳定性:Z<W D、X的最高价氧化物的水化物是强碱2. 2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟( )等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷( )同周期。下列说法不正确的是( )
A、 是第五周期第 族元素 B、 的中子数与电子数的差值为17 C、原子半径: D、碱性:3. 科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是( )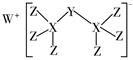 A、WZ的水溶液呈碱性 B、元素非金属性的顺序为X>Y>Z C、Y的最高价氧化物的水化物是中强酸 D、该新化合物中Y不满足8电子稳定结构4. 短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是( )A、原子半径:r(W) > r(Z) > r(Y) B、由X、Y 组成的化合物中均不含共价键 C、Y 的最高价氧化物的水化物的碱性比Z的弱 D、X 的简单气态氢化物的热稳定性比W的强5. 2022年9月9日,中国科学家首次在月球上发现的新矿物被命名为“嫦娥石”。该矿物除了含钙、铁(26Fe)、钇(39Y)三种长周期元素外,还含有X、R、Z、W四种原子序数依次增大的短周期主族元素。X、R、Z、W质子数之和为46,X、 R、Z最外层电子数分别为x、y、z,x+y+z=9, x=2(y+z)。下列叙述正确的是A、铁(26Fe)位于第四周期VIIIB族 B、简单离子半径: X>R>Z C、W的简单氢化物热稳定性比X的简单氢化物强 D、X与R形成的化合物为离子化合物且只含有离子键6. 北宋名画《千里江山图》历经千年色彩依然,其青色来自青金石,它含有H、O、Si元素,以及X、Y、Z、M、Q等前20号元素,X、Y、Z、M同周期,Z的原子序数小于M,Z最高价氧化物对应水化物0.005mol·L-1的pH=2。X、Y、Z、M原子的最外层电子数之和为17,Q与青金石中其他7种元素均不同周期也不同族。下列说法错误的是A、X、Y的单质都能形成氧化物保护膜 B、金属活动性强弱:X<Q C、ZM2分子中各原子均满足8电子稳定结构 D、氢化物稳定性:Si<Z<M7. W、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19。W、X、Y所在的族均不相邻,族序数按Y、W、X、Z的顺序依次增大。下列说法错误的是A、简单离子半径X>Y>Z B、W的简单氢化物的沸点小于X的简单氢化物的沸点 C、W、X、Z可形成共价化合物 D、一定条件下,Y的单质能将W从WX2置换出来8. 短周期主族元素X、Y、Z、R、W的原子序数依次增大,X、Y、Z位于同一周期,Y和R位于同一主族,这五种元素构成的一种分子的结构如图所示。下列说法正确的是
A、WZ的水溶液呈碱性 B、元素非金属性的顺序为X>Y>Z C、Y的最高价氧化物的水化物是中强酸 D、该新化合物中Y不满足8电子稳定结构4. 短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是( )A、原子半径:r(W) > r(Z) > r(Y) B、由X、Y 组成的化合物中均不含共价键 C、Y 的最高价氧化物的水化物的碱性比Z的弱 D、X 的简单气态氢化物的热稳定性比W的强5. 2022年9月9日,中国科学家首次在月球上发现的新矿物被命名为“嫦娥石”。该矿物除了含钙、铁(26Fe)、钇(39Y)三种长周期元素外,还含有X、R、Z、W四种原子序数依次增大的短周期主族元素。X、R、Z、W质子数之和为46,X、 R、Z最外层电子数分别为x、y、z,x+y+z=9, x=2(y+z)。下列叙述正确的是A、铁(26Fe)位于第四周期VIIIB族 B、简单离子半径: X>R>Z C、W的简单氢化物热稳定性比X的简单氢化物强 D、X与R形成的化合物为离子化合物且只含有离子键6. 北宋名画《千里江山图》历经千年色彩依然,其青色来自青金石,它含有H、O、Si元素,以及X、Y、Z、M、Q等前20号元素,X、Y、Z、M同周期,Z的原子序数小于M,Z最高价氧化物对应水化物0.005mol·L-1的pH=2。X、Y、Z、M原子的最外层电子数之和为17,Q与青金石中其他7种元素均不同周期也不同族。下列说法错误的是A、X、Y的单质都能形成氧化物保护膜 B、金属活动性强弱:X<Q C、ZM2分子中各原子均满足8电子稳定结构 D、氢化物稳定性:Si<Z<M7. W、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19。W、X、Y所在的族均不相邻,族序数按Y、W、X、Z的顺序依次增大。下列说法错误的是A、简单离子半径X>Y>Z B、W的简单氢化物的沸点小于X的简单氢化物的沸点 C、W、X、Z可形成共价化合物 D、一定条件下,Y的单质能将W从WX2置换出来8. 短周期主族元素X、Y、Z、R、W的原子序数依次增大,X、Y、Z位于同一周期,Y和R位于同一主族,这五种元素构成的一种分子的结构如图所示。下列说法正确的是 A、离子半径: B、X的氢化物常温下一定为气体 C、氧化物对应水化物的酸性: D、分子中每个原子都符合8电子稳定结构9. 短周期主族元素X、Y、Z、W、 R的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物对应的水化物的稀溶液中,却不溶于其浓溶液。下列说法正确的是A、简单离子半径:R>W>X> Y> Z B、Y与W具有相同的最高化合价 C、Z、W的简单离子都能促进水的电离 D、往元素X的最简单氢化物的稀溶液中滴加酚酞,无明显变化10. 某碳-碳成键反应的催化剂由R3+和结构如图所示的阴离子组成,X、Y、Z、Q为原子序数依次增大的短周期主族元素,R3+与Ar具有相同的核外电子排布。下列说法正确的是
A、离子半径: B、X的氢化物常温下一定为气体 C、氧化物对应水化物的酸性: D、分子中每个原子都符合8电子稳定结构9. 短周期主族元素X、Y、Z、W、 R的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物对应的水化物的稀溶液中,却不溶于其浓溶液。下列说法正确的是A、简单离子半径:R>W>X> Y> Z B、Y与W具有相同的最高化合价 C、Z、W的简单离子都能促进水的电离 D、往元素X的最简单氢化物的稀溶液中滴加酚酞,无明显变化10. 某碳-碳成键反应的催化剂由R3+和结构如图所示的阴离子组成,X、Y、Z、Q为原子序数依次增大的短周期主族元素,R3+与Ar具有相同的核外电子排布。下列说法正确的是 A、R位于第四周期ⅢA族 B、X、Y、Z的简单氢化物的沸点依次升高 C、XQ2和QY2的空间结构相同 D、基团-XZ3与碘原子形成的化合物可水解为XZ3H和HIO11. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是电子层数的3倍,元素Y、Z、W互不相邻但位于同周期,且Y、Z的最外层电子数之和等于W的最外层电子数,W在同周期中原子半径最小。下列叙述错误的是A、原子半径的大小顺序: B、元素X的简单气态氢化物的热稳定性比Z的强 C、元素W的最高价氧化物对应水化物的酸性比Z的弱 D、Z、W形成的化合物中各原子最外层电子均满足8电子稳定结构12. 元素周期表可以有多种表示方法,如图1为八角形元素周期表,八角形的每个顶角对应一种元素,下列说法错误的是
A、R位于第四周期ⅢA族 B、X、Y、Z的简单氢化物的沸点依次升高 C、XQ2和QY2的空间结构相同 D、基团-XZ3与碘原子形成的化合物可水解为XZ3H和HIO11. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是电子层数的3倍,元素Y、Z、W互不相邻但位于同周期,且Y、Z的最外层电子数之和等于W的最外层电子数,W在同周期中原子半径最小。下列叙述错误的是A、原子半径的大小顺序: B、元素X的简单气态氢化物的热稳定性比Z的强 C、元素W的最高价氧化物对应水化物的酸性比Z的弱 D、Z、W形成的化合物中各原子最外层电子均满足8电子稳定结构12. 元素周期表可以有多种表示方法,如图1为八角形元素周期表,八角形的每个顶角对应一种元素,下列说法错误的是 A、图1中沿虚线箭头方向,元素单质的还原性逐渐增强 B、元素第一电离能大小关系:②>①>④ C、最简单气态氢化物的稳定性:⑤>⑥ D、与③、④可形成冰晶石(已知(熔融) , 形成的晶胞如图2所示,其中黑球代表 , 该晶体密度为13. 一种用作锂离子电池电解液的锂盐结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,W原子的最外层电子数等于其总电子数的。下列说法错误的是
A、图1中沿虚线箭头方向,元素单质的还原性逐渐增强 B、元素第一电离能大小关系:②>①>④ C、最简单气态氢化物的稳定性:⑤>⑥ D、与③、④可形成冰晶石(已知(熔融) , 形成的晶胞如图2所示,其中黑球代表 , 该晶体密度为13. 一种用作锂离子电池电解液的锂盐结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,W原子的最外层电子数等于其总电子数的。下列说法错误的是 A、简单离子半径:W>Y>Z B、X元素的各种含氧酸盐水溶液均显碱性 C、与W同周期的元素中,第一电离能小于W的有5种 D、该锂盐中所有非金属元素均属于元素周期表p区元素14. X、Y、Z、W是原子序数依次增大的短周期元素,X、Y可以构成[YX4]+ , W的价电子排布式为(n+1)sn(n+1)p(n+2) , Z、W同主族且能构成如图所示的阴离子(Rm-)。以下说法正确的是
A、简单离子半径:W>Y>Z B、X元素的各种含氧酸盐水溶液均显碱性 C、与W同周期的元素中,第一电离能小于W的有5种 D、该锂盐中所有非金属元素均属于元素周期表p区元素14. X、Y、Z、W是原子序数依次增大的短周期元素,X、Y可以构成[YX4]+ , W的价电子排布式为(n+1)sn(n+1)p(n+2) , Z、W同主族且能构成如图所示的阴离子(Rm-)。以下说法正确的是 A、[YX4]+中不存在配位键 B、Rm-有很好的热稳定性 C、电负性Y>Z>W>X D、m=215. W、X、Y、Z是原子序数依次增大的短周期主族元素,焰色试验中X呈黄色,Y是地壳中含量最多的金属元素,W、Z原子最外层电子数相同,Z的核电荷数是W的2倍。下列叙述正确的是A、简单离子半径大小:X>Y>Z>W B、化合物中阴阳离子的个数比为 C、X、Y、Z最高价氧化物的水化物两两间能发生反应 D、简单氢化物的沸点:Z>W16. 短周期主族元素Q、X、Y、Z质子数之和为37,Q与X、Y、Z位于不同周期,Q与Z位于同一主族。X、Y、Z最外层电子数分别为x、y、z,且依次增大,x、y、z之和为15,。下列说法正确的是A、Q是原子半径最小的元素 B、最高正价含氧酸的酸性: C、分子中各原子最外层达到8电子结构 D、Z的氢化物不可能含有非极性共价键17. 一种工业洗涤剂中间体的结构式如图所示。其中短周期元素X、Y、Z、Q、W原子的半径依次增大,X和W同主族但不相邻,Y和Q最外层电子数之和是Z原子L层电子数的两倍,下列说法错误的是
A、[YX4]+中不存在配位键 B、Rm-有很好的热稳定性 C、电负性Y>Z>W>X D、m=215. W、X、Y、Z是原子序数依次增大的短周期主族元素,焰色试验中X呈黄色,Y是地壳中含量最多的金属元素,W、Z原子最外层电子数相同,Z的核电荷数是W的2倍。下列叙述正确的是A、简单离子半径大小:X>Y>Z>W B、化合物中阴阳离子的个数比为 C、X、Y、Z最高价氧化物的水化物两两间能发生反应 D、简单氢化物的沸点:Z>W16. 短周期主族元素Q、X、Y、Z质子数之和为37,Q与X、Y、Z位于不同周期,Q与Z位于同一主族。X、Y、Z最外层电子数分别为x、y、z,且依次增大,x、y、z之和为15,。下列说法正确的是A、Q是原子半径最小的元素 B、最高正价含氧酸的酸性: C、分子中各原子最外层达到8电子结构 D、Z的氢化物不可能含有非极性共价键17. 一种工业洗涤剂中间体的结构式如图所示。其中短周期元素X、Y、Z、Q、W原子的半径依次增大,X和W同主族但不相邻,Y和Q最外层电子数之和是Z原子L层电子数的两倍,下列说法错误的是 A、X、Y形成的化合物中只含极性共价键 B、简单离子半径:Z>Y>W C、第一电离能:Z>Y D、Q的氢化物沸点不一定比Z的氢化物低18. 一种新型电池的电解质的结构如图所示(箭头指向表示共用电子对由W提供):W、X、Y、Z是同周期四种主族元素,Y的最外层电子数是X次外层电子数的3倍,下列说法错误的是
A、X、Y形成的化合物中只含极性共价键 B、简单离子半径:Z>Y>W C、第一电离能:Z>Y D、Q的氢化物沸点不一定比Z的氢化物低18. 一种新型电池的电解质的结构如图所示(箭头指向表示共用电子对由W提供):W、X、Y、Z是同周期四种主族元素,Y的最外层电子数是X次外层电子数的3倍,下列说法错误的是 A、该物质中含离子键、极性键和非极性键 B、第一电离能: C、W的电负性比Y大 D、W、X、Y、Z四种元素中,X的原子半径最大19. X、Y、Z、W、Q是原子序数依次增大且不超过20的主族元素。X是地壳中含量最多的元素,Y基态原子核外s能级和p能级电子数相等,Z与X同主族,Q的焰色试验呈紫色。列说法正确的是A、简单离子半径; B、X的第一电离能比同周期的相邻元素的大 C、Z的简单气态氢化物的热稳定性比W的强 D、Q最高价氧化物对应水化物的碱性比Y的弱20. W、X、Y、Z四种元素组成的化合物是新能源汽车电池的正极材料,W、X、Y、Z的原子序数依次增大,W和Z是两种金属元素,Z单质是用途最广泛的金属,X、Y形成的有50个电子。下列说法正确的是A、W的简单离子半径大于的半径 B、在同周期元素的氢化物中,X的氢化物沸点最高 C、Y的最高价氧化物对应的水化物的酸性强于碳酸 D、Z元素在化合物中只有+2、+3价21. M、W、X、Y、Z是原子序数依次增大的同周期主族元素,基态X原子2p能级上有2个未成对电子,Y元素原子的价电子数是W的两倍,由五种元素组成某电极材料的结构如图所示。下列说法错误的是
A、该物质中含离子键、极性键和非极性键 B、第一电离能: C、W的电负性比Y大 D、W、X、Y、Z四种元素中,X的原子半径最大19. X、Y、Z、W、Q是原子序数依次增大且不超过20的主族元素。X是地壳中含量最多的元素,Y基态原子核外s能级和p能级电子数相等,Z与X同主族,Q的焰色试验呈紫色。列说法正确的是A、简单离子半径; B、X的第一电离能比同周期的相邻元素的大 C、Z的简单气态氢化物的热稳定性比W的强 D、Q最高价氧化物对应水化物的碱性比Y的弱20. W、X、Y、Z四种元素组成的化合物是新能源汽车电池的正极材料,W、X、Y、Z的原子序数依次增大,W和Z是两种金属元素,Z单质是用途最广泛的金属,X、Y形成的有50个电子。下列说法正确的是A、W的简单离子半径大于的半径 B、在同周期元素的氢化物中,X的氢化物沸点最高 C、Y的最高价氧化物对应的水化物的酸性强于碳酸 D、Z元素在化合物中只有+2、+3价21. M、W、X、Y、Z是原子序数依次增大的同周期主族元素,基态X原子2p能级上有2个未成对电子,Y元素原子的价电子数是W的两倍,由五种元素组成某电极材料的结构如图所示。下列说法错误的是 A、电极材料的结构中存在配位键 B、简单氢化物沸点:X<Y C、第一电离能:W<X<Y D、单质的氧化性:Z<Y22. 为ⅠA族元素,可用于癌症治疗。有关说法错误的是A、质量数为137 B、核外电子数为54 C、原子半径: D、碱性:
A、电极材料的结构中存在配位键 B、简单氢化物沸点:X<Y C、第一电离能:W<X<Y D、单质的氧化性:Z<Y22. 为ⅠA族元素,可用于癌症治疗。有关说法错误的是A、质量数为137 B、核外电子数为54 C、原子半径: D、碱性:二、多选题
-
23. 短周期主族元素X、Y、Z、M的原子序数依次递增,Z、M的单质均能与水发生剧烈的化学反应,Z的最外层电子数是X、Y的最外层电子数之和,且X、Y相邻。下列有关说法正确的是( )A、离子半径:M>Z B、Z、M可以形成离子化合物 C、X、Y最高价含氧酸的酸性:X<Y D、X、Y分别与Z形成的二元化合物中,各原子最外层均满足8e-结构24. X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是( )A、X、Y、Z、W四种元素都位于元素周期表的p区 B、Z元素的离子半径大于W元素的离子半径 C、Z元素的单质在一定条件下能与X元素的单质反应 D、Y元素最高价氧化物的晶体具有很高的熔点和沸点
三、非选择题
-
25.(1)、下列元素或化合物的性质变化顺序正确的是( )A、第一电离能:Cl>S>P>Si B、共价键的极性:HF>HCl>HBr>HI C、晶格能:NaF>NaCl>NaBr>NaI D、热稳定性:MgCO3>CaCO3>SrCO3>BaCO3(2)、黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:①CuFeS2中存在的化学键类型是。下列基态原子或离子的价层电子排布图正确的是(填标号)。

在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
a.x分子的立体构型是 , 中心原子杂化类型为 , 属于(填“非极性”或“极性”)分子。
b.X的沸点比水低的主要原因是。
②CuFeS2与氧气反应生成SO2。SO2中心原子的价层电子对数为 , 共价键的类型有。
③四方晶系CuFeS2的晶胞结构如图所示。

a.Cu+的配位数为 , S2-的配位数为。
b.已知:a=b=0.524 nm,c=1.032nm,Na为阿伏加德罗常数的值,CuFeS2晶体的密度是g·cm-3(列出计算式)。
26. Ⅰ几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期.(请用化学用语答题)元素代号
X
Y
Z
M
R
原子半径/nm
0.186
0.102
0.075
0.074
0.143
主要化合价
+1
+6﹣2
+5﹣3
﹣2
+3
(1)、R的元素符号为; M在元素周期表中的位置为 .(2)、X与Y按原子个数比1:1构成的物质的电子式为;所含化学键类型 .(3)、X+ , Y2‾,M2‾离子半径由大到小的顺序为(用离子符号表示) .(4)、用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的电极反应式 .Ⅱ如图转化关系A B C,若B为白色胶状不溶物,则A与C反应的离子方程式为 .
27. 在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6 , 与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高.(1)、B元素在周期表中的位置;D元素基态原子电子排布式为 .(2)、E的气态氢化物在同族元素中沸点最高的原因是: .(3)、A、C两元素第一电离能> . (填元素符号)(4)、B元素能形成多种配合物.元素之间形成配合物的条件是:一方是能够提供孤对电子的原子,另一方是的原子.(5)、A元素可与氢元素形成离子化合物,电子式为;这种离子化合物可与水反应,化学方程式为28. 原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn , 元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个.根据判断出的元素回答下列问题:
(1)、基态R原子核外电子排布式为 , X、Y、Z三种原子第一电离能由大到小的顺序为(用具体元素符号表示).(2)、1mol配合物[R(XY)6]4﹣中含有σ键的数目为 .(3)、XZW2是一种高毒类物质,结构与甲醛相似,X原子杂化方式为 , 其沸点高于甲醛的主要原因是 .(4)、YW3为黄色、油状、具有刺激性气味的液体,该分子的立体构型为(用文字描述).(5)、某晶体的晶胞结构如图所示,则该化合物的化学式为(R、Z用具体元素符号表示). 29. A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大.元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子.(1)、F+离子的电子排布式是 .(2)、B、C、D元素的第一电离能由大到小的顺序是 .(3)、B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是;B、C的这些氢化物的沸点相差较大的主要原因是 .(4)、A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是;1mol该分子中含有π键的数目是 .(5)、C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 , C原子的配位数是 .
29. A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大.元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子.(1)、F+离子的电子排布式是 .(2)、B、C、D元素的第一电离能由大到小的顺序是 .(3)、B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是;B、C的这些氢化物的沸点相差较大的主要原因是 .(4)、A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是;1mol该分子中含有π键的数目是 .(5)、C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 , C原子的配位数是 .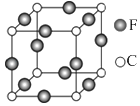 30. 元素X位于第四周期,其基态原子有4个未成对电子.Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子.(1)、Y与Z可形成多种化合物.
30. 元素X位于第四周期,其基态原子有4个未成对电子.Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子.(1)、Y与Z可形成多种化合物.①元素Y与Z中电负性较大的是(用元素符号描述).
②离子ZY32﹣的空间构型为(用文字描述).
③写出一种与ZY2互为等电子体的氧化物分子的化学式 .
(2)、Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是 .(3)、含X2+的溶液与KCN、氨水反应可得到化合物K3[X(CN)5(NH3)].①基态X2+的电子排布式是 .
②1mol配合物K3[X(CN)5(NH3)]中含σ键的数目为 .
(4)、下图为X与Z所形成的一种化合物的基本结构单元,推测该化合物的化学式: . 31. 水是生命之源,也是化学反应中的主角.请回答下列问题:(1)、水是一种电解质,发生电离会产生电子总数相同的两种微粒,其电离方程式为 .(2)、在许多反应中H2O扮演不同的“角色”.请结合所学知识,写出有关反应的化学方程
31. 水是生命之源,也是化学反应中的主角.请回答下列问题:(1)、水是一种电解质,发生电离会产生电子总数相同的两种微粒,其电离方程式为 .(2)、在许多反应中H2O扮演不同的“角色”.请结合所学知识,写出有关反应的化学方程式或离子方程式.
(I)H2O参与置换反应,符合X+W→Y+V.已知X和Y均是短周期主族元素形成的单
质,W、V是化合物.
①若W是水,且做还原剂,该反应的化学方程式为 .
②若V是水,且为还原产物,该反应在常温下进行.发生反应的化学方程式为
(II)A、B是两种由短周期元素组成的有色气体(且MA>MB),它们均能与水发生氧化还原
反应,但水既不是氧化剂也不是还原剂.
①A与H2O反应的化学方程式为 ,
②气体B通常不是纯净物的主要原因为(用化学方程式表示).
32. A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大.A与D同主族,可形成DA型离子化合物,B与C同周期且相邻,C与E同主族,E2﹣与Ar原子具有相同的电子层结构,W的合金用量最大、用途最广.请回答下列问题:(1)、D在元素周期表中的位置 .(2)、A分别与C、E形成最简单化合物中沸点较高的是(填化学式),原因是 .(3)、A、C、D三种元素形成的物质中含有的化学键类型 , 灼热的碳能与B的最高价氧化物对应水化物的浓溶液反应,化学反应方程式为 .(4)、向盛有A2C2溶液的试管中加入几滴酸化的WEC4溶液,溶液变成棕黄色,发生反应的离子方程式为;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是;生成沉淀的原因是(用平衡移动原理解释).33. A、B、C、D、E五种元素的元素序数依次增大.A的原子序数等于周期数;B的最外层电子数是次外层电子数的2倍,D的L层有两对成对电子;E+的核外有三个电子层,且都处于全满状态.试回答下列问题:(1)、基态E原子核外电子的排布式为(2)、A、C、D三种元素形成的常见离子化合物中阳离子的空间构型为 , 阴离子的中心原子轨道采用杂化.(3)、B、C、D三种元素的第一电离能有大到小的顺序是(填元素符号)(4)、E(CA3)42+离子的颜色是;含有化学键类型是;该配离子中心离子的配位数为(5)、D、E能形成两种晶体,其晶胞分别如甲、乙两图.在一定条件下,甲和C2A4反应生成乙,同时生成在常温下分别为气体和液体的另外两种常见无污染物质.该化学反应方程式为 . 34. Q、R、X、Y、Z是短周期元素,原子序数依次增大.Q的基态原子最外层s轨道和p轨道电子数相等;R的一种氢化物是常见的碱性气体;X在同周期元素中,其氧化物的水化物是最强的碱;Y的一种氧化物能使品红溶液褪色;Z的最高价氧化物的水化物是最强的酸.
34. Q、R、X、Y、Z是短周期元素,原子序数依次增大.Q的基态原子最外层s轨道和p轨道电子数相等;R的一种氢化物是常见的碱性气体;X在同周期元素中,其氧化物的水化物是最强的碱;Y的一种氧化物能使品红溶液褪色;Z的最高价氧化物的水化物是最强的酸.请回答下列问题:
(1)、R位于元素周期表中第周期,第族.(2)、Q形成的最高价氧化物分子是(填“极性”或“非极性”)分子,中心原子的杂化轨道类型是 .(3)、Y、Z的氢化物中,稳定性较强的是(填氢化物的化学式).(4)、X单质的晶体的晶胞示意图是(填字母编号). (5)、Y的最高价含氧酸根Y2O82﹣中,Y和Y之间有一过氧键,该酸根具有极强的氧化性,在Ag+的催化下,能将酸性介质中的Mn2+氧化成MnO4﹣ , 而Y的价态不变,该反应的离子方程式是 .35. A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:(1)、A,B,C三种元素的第一电离能由小到大的顺序是(用元素符号表示).(2)、B与C能形成四原子阴离子,其中B的杂化方式为;B的三氯化物分子的立体构型为 .(3)、任写一种与AB﹣离子互为等电子体的离子(写化学式).(4)、F原子的外围电子排布式为 , F晶体的堆积方式为(填序号:①简单立方堆积,②体心立方堆积,③六方最密堆积,④面心立方密集堆积).(5)、E的离子可以形成多种配合物,将ECl3溶液蒸发浓缩,析出深绿色晶体.该晶体中E3+、Cl﹣、H2O的物质的量之比为1:3:6,且E的配位数为6,向1.0mol该晶体的溶液中加入足量AgNO3溶液产生143.5g沉淀,则配合物的化学式为 .(6)、硼与D可形成一种耐磨材料,其结构与金刚石相似,如图为其晶体结构单元,它可由硼的三溴化物和D的三溴化物于高温下在氢气的氛围中合成
(5)、Y的最高价含氧酸根Y2O82﹣中,Y和Y之间有一过氧键,该酸根具有极强的氧化性,在Ag+的催化下,能将酸性介质中的Mn2+氧化成MnO4﹣ , 而Y的价态不变,该反应的离子方程式是 .35. A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:(1)、A,B,C三种元素的第一电离能由小到大的顺序是(用元素符号表示).(2)、B与C能形成四原子阴离子,其中B的杂化方式为;B的三氯化物分子的立体构型为 .(3)、任写一种与AB﹣离子互为等电子体的离子(写化学式).(4)、F原子的外围电子排布式为 , F晶体的堆积方式为(填序号:①简单立方堆积,②体心立方堆积,③六方最密堆积,④面心立方密集堆积).(5)、E的离子可以形成多种配合物,将ECl3溶液蒸发浓缩,析出深绿色晶体.该晶体中E3+、Cl﹣、H2O的物质的量之比为1:3:6,且E的配位数为6,向1.0mol该晶体的溶液中加入足量AgNO3溶液产生143.5g沉淀,则配合物的化学式为 .(6)、硼与D可形成一种耐磨材料,其结构与金刚石相似,如图为其晶体结构单元,它可由硼的三溴化物和D的三溴化物于高温下在氢气的氛围中合成①写出合成该晶体的化学方程式: .
②已知晶体中硼与D原子的最近距离为a pm,则该晶体密度的表达式为 g•cm﹣3 .
(不需化简,阿伏加德罗常数为NA)
