高考二轮复习知识点:元素周期表中原子结构与元素性质的递变规律3
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是( )A、NaOH的碱性比Mg(OH)2的强 B、Cl2得到电子的能力比Br2的弱 C、原子半径r: D、原子的最外层电子数n:2. 短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是( )A、原子半径:r(W)> r(Z)> r(Y)> r(X) B、由X、Y组成的化合物是离子化合物 C、Z的最高价氧化物对应水化物的酸性比W的强 D、W的简单气态氢化物的热稳定性比X的强3. X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10,X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是( )
A、熔点:X的氧化物比Y的氧化物高 B、热稳定性:X的氢化物大于Z的氢化物 C、X与Z可形成离子化合物ZX D、Y的单质与Z的单质均能溶于浓硫酸4. 一种由前四周期主族元素组成的化合物(如图所示)是一种用于合成药物的重要试剂。已知X、Y、Z、M、N的原子序数依次增大,Z、M位于同一主族,X、Y、N的最外层电子数之和等于Z的最外层电子数。下列有关叙述错误的是 A、简单离子半径:M>N>Z B、最简单氢化物的沸点:Z>M C、化合物YM2与YZM均为共价化合物 D、化合物中所有原子均满足8电子稳定结构5. 从原子结构角度判断,下列说法错误的是A、稳定性:NH3>PH3>AsH3 B、HNO3可以与KH2PO4反应生成H3PO4 C、元素的非金属性:N>P>S D、氟元素不显正化合价6. 配合物XY(ZW)5的结构如图所示,Y位于第四周期且基态原子中含5个单电子,Z与W位于第二周期的p区,ZW结构与N2相似,Z的电负性小于W。下列说法错误的是
A、简单离子半径:M>N>Z B、最简单氢化物的沸点:Z>M C、化合物YM2与YZM均为共价化合物 D、化合物中所有原子均满足8电子稳定结构5. 从原子结构角度判断,下列说法错误的是A、稳定性:NH3>PH3>AsH3 B、HNO3可以与KH2PO4反应生成H3PO4 C、元素的非金属性:N>P>S D、氟元素不显正化合价6. 配合物XY(ZW)5的结构如图所示,Y位于第四周期且基态原子中含5个单电子,Z与W位于第二周期的p区,ZW结构与N2相似,Z的电负性小于W。下列说法错误的是 A、第一电离能: W>Z B、XY(ZW)5中Y的配位数是5 C、W3的熔点低于YW2 D、Z的某种同素异形体具有良好导电性,其中Z原子的杂化方式均为sp27. 短周期主族元素Y、Z、R、X的原子半径依次减小,四种元素的原子序数均不超过10,我国科学家利用M制备的有机一金属框架(MO)可以高效快速分离CO2和N2 , M的结构式如图所示。下列说法正确的是
A、第一电离能: W>Z B、XY(ZW)5中Y的配位数是5 C、W3的熔点低于YW2 D、Z的某种同素异形体具有良好导电性,其中Z原子的杂化方式均为sp27. 短周期主族元素Y、Z、R、X的原子半径依次减小,四种元素的原子序数均不超过10,我国科学家利用M制备的有机一金属框架(MO)可以高效快速分离CO2和N2 , M的结构式如图所示。下列说法正确的是 A、最简单氢化物的沸点:R > Z> Y B、R的单质与X2Z不发生反应 C、简单离子半径:Z > R D、YX3YX2ZX不溶于水8. 如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,若Z原子序数是Y的两倍,则下列说法正确的是
A、最简单氢化物的沸点:R > Z> Y B、R的单质与X2Z不发生反应 C、简单离子半径:Z > R D、YX3YX2ZX不溶于水8. 如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,若Z原子序数是Y的两倍,则下列说法正确的是 A、X元素的简单氢化物分子内可以形成氢键 B、Y元素与X、Z、W元素均可形成两种以上的化合物,且都能溶于水 C、最高价氧化物对应水化物的酸性:Z>W D、阴离子半径由大到小的顺序为:Z>W>X>Y9. W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍,Y是地壳中含量最多的金属元素。W和X的单质常温下均为气体。下列叙述正确的是A、原子半径: B、电负性: C、W、X形成的化合物只含有极性共价键 D、Y的氧化物属于碱性氧化物10. X、Y、Z、W为原子序数依次增大的前四周期元素,X与Y、Z均能形成多种常见二元化合物,Y、Z形成的某化合物是参与光合作用的主要气体,基态原子中X、Y、Z的价电子数之和等于W的价电子数,下列说法正确的是A、W属于d区元素 B、原子半径: C、氢化物沸点: D、X与W的最外层电子数相等11. 我国科学家在嫦娥五号月壤样品中发现一种新矿物,命名为“嫦娥石”,其中含有原子序数依次增大的短周期主族元素W、X、Y、Z,W在地壳中含量最多,X的原子半径在同周期主族元素中最大,基态Y原子无未成对电子,Z第一电离能大于同周期相邻元素。下列叙述正确的是A、W的简单氢化物的稳定性弱于Z B、X的原子半径小于Y(最高价氧化为对应水化物的碱性X小于Y) C、Z的简单氢化物的空间结构为三角锥形 D、W分别与X、Y、Z形成晶体,其类型相同12. 我国科学家使用某种电解液提高了水系锌锰电池的性能。该电解液阴离子结构如图所示,其中W、X、Y、Z为原子半径依次增大的短周期元素,且最外层电子数之和为23。下列说法错误的是( )
A、X元素的简单氢化物分子内可以形成氢键 B、Y元素与X、Z、W元素均可形成两种以上的化合物,且都能溶于水 C、最高价氧化物对应水化物的酸性:Z>W D、阴离子半径由大到小的顺序为:Z>W>X>Y9. W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍,Y是地壳中含量最多的金属元素。W和X的单质常温下均为气体。下列叙述正确的是A、原子半径: B、电负性: C、W、X形成的化合物只含有极性共价键 D、Y的氧化物属于碱性氧化物10. X、Y、Z、W为原子序数依次增大的前四周期元素,X与Y、Z均能形成多种常见二元化合物,Y、Z形成的某化合物是参与光合作用的主要气体,基态原子中X、Y、Z的价电子数之和等于W的价电子数,下列说法正确的是A、W属于d区元素 B、原子半径: C、氢化物沸点: D、X与W的最外层电子数相等11. 我国科学家在嫦娥五号月壤样品中发现一种新矿物,命名为“嫦娥石”,其中含有原子序数依次增大的短周期主族元素W、X、Y、Z,W在地壳中含量最多,X的原子半径在同周期主族元素中最大,基态Y原子无未成对电子,Z第一电离能大于同周期相邻元素。下列叙述正确的是A、W的简单氢化物的稳定性弱于Z B、X的原子半径小于Y(最高价氧化为对应水化物的碱性X小于Y) C、Z的简单氢化物的空间结构为三角锥形 D、W分别与X、Y、Z形成晶体,其类型相同12. 我国科学家使用某种电解液提高了水系锌锰电池的性能。该电解液阴离子结构如图所示,其中W、X、Y、Z为原子半径依次增大的短周期元素,且最外层电子数之和为23。下列说法错误的是( )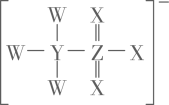 A、简单氢化物沸点: B、该离子中Z为杂化 C、四种元素中电负性最强的为Z D、第一电离能:13. X、Y、Z、W是同周期主族元素,四种元素均是短周期元素,W元素形成的某种单质具有强氧化性,可用于杀菌消毒。四种元素与锂组成的盐是一种新型锂离子电池的电解质,结构如图所示,下列说法正确的是
A、简单氢化物沸点: B、该离子中Z为杂化 C、四种元素中电负性最强的为Z D、第一电离能:13. X、Y、Z、W是同周期主族元素,四种元素均是短周期元素,W元素形成的某种单质具有强氧化性,可用于杀菌消毒。四种元素与锂组成的盐是一种新型锂离子电池的电解质,结构如图所示,下列说法正确的是 A、组成这种新型电解质的所有元素均处于元素周期表p区 B、Z元素的含氧酸不可能使酸性高锰酸钾溶液褪色 C、最简单氢化物的沸点: X>W D、同周期中第一电离能比W元素小的有4种元素14. 一种重要的无机化学品广泛应用于工业和科技领域,其结构如图所示,W、X、Y、Z为原子序数依次增大的短周期主族元素。下列说法错误的是
A、组成这种新型电解质的所有元素均处于元素周期表p区 B、Z元素的含氧酸不可能使酸性高锰酸钾溶液褪色 C、最简单氢化物的沸点: X>W D、同周期中第一电离能比W元素小的有4种元素14. 一种重要的无机化学品广泛应用于工业和科技领域,其结构如图所示,W、X、Y、Z为原子序数依次增大的短周期主族元素。下列说法错误的是 A、简单离子半径:X>Y>Z B、简单氢化物的稳定性:Y>X C、W、X、Y三种元素组成的化合物均抑制水的电离 D、X和Z形成的二元化合物水解时,生成的两种产物均可与强酸反应15. 下表是元素周期表的一部分,W、X、Y、Z、Q为短周期主族元素,W与X的最高化合价之和为8。下列说法正确的是
A、简单离子半径:X>Y>Z B、简单氢化物的稳定性:Y>X C、W、X、Y三种元素组成的化合物均抑制水的电离 D、X和Z形成的二元化合物水解时,生成的两种产物均可与强酸反应15. 下表是元素周期表的一部分,W、X、Y、Z、Q为短周期主族元素,W与X的最高化合价之和为8。下列说法正确的是W
Q
X
Y
Z
A、简单离子半径:Q<W<X B、最简单氢化物的沸点:Q>Z C、X、Y分别与Q可形成离子化合物 D、Y、Z、W的氧化物均为酸性氧化物16. 某多孔储氢材料结构如图,M、W、X、Y、Z五种短周期元素原子序数依次增大,电负性Z大于Y,下列说法错误的是 A、基态原子的第一电离能Y>Z B、该物质中有离子键、极性共价键,还存在配位键 C、M、Y、Z形成的化合物只能抑制水的电离 D、最高价含氧酸的酸性:Y>X>W17. 某多孔储氢材料结构如图,M、W、X、Y、Z五种短周期元素原子序数依次增大,电负性Z大于Y,下列说法错误的是
A、基态原子的第一电离能Y>Z B、该物质中有离子键、极性共价键,还存在配位键 C、M、Y、Z形成的化合物只能抑制水的电离 D、最高价含氧酸的酸性:Y>X>W17. 某多孔储氢材料结构如图,M、W、X、Y、Z五种短周期元素原子序数依次增大,电负性Z大于Y,下列说法错误的是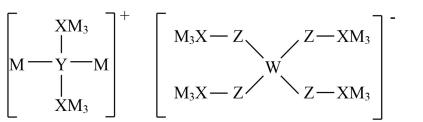 A、最高价含氧酸的酸性:Y>X>W B、M、Y、Z形成的化合物只能抑制水的电离 C、该物质中有离子键、极性共价键,还存在配位键 D、基态原子的第一电离能Y>Z18. 短周期主族元素R、X、Y、M原子序数依次增大,Y为地壳中含量最高的元素,M与Y元素不同周期且M原子的核外未成对电子数为1,由R、X、Y、M组成的物质结构式如图所示,下列说法错误的是
A、最高价含氧酸的酸性:Y>X>W B、M、Y、Z形成的化合物只能抑制水的电离 C、该物质中有离子键、极性共价键,还存在配位键 D、基态原子的第一电离能Y>Z18. 短周期主族元素R、X、Y、M原子序数依次增大,Y为地壳中含量最高的元素,M与Y元素不同周期且M原子的核外未成对电子数为1,由R、X、Y、M组成的物质结构式如图所示,下列说法错误的是 A、的空间结构为平面三角形 B、M的最高价氧化物对应的水化物为强酸 C、该化合物中X原子最外层均满足结构 D、Y元素所在周期中,第一电离能大于Y的元素有2种19. 矿物药M具有补血功效,结构如图所示,X、Y、Z和W为原子序数依次增大的元素,原子序数之和为51,Y和Z同主族,四种元素中只有W为金属,的价层电子为半充满结构。下列说法错误的是
A、的空间结构为平面三角形 B、M的最高价氧化物对应的水化物为强酸 C、该化合物中X原子最外层均满足结构 D、Y元素所在周期中,第一电离能大于Y的元素有2种19. 矿物药M具有补血功效,结构如图所示,X、Y、Z和W为原子序数依次增大的元素,原子序数之和为51,Y和Z同主族,四种元素中只有W为金属,的价层电子为半充满结构。下列说法错误的是 A、简单氢化物的稳定性:Y>Z B、该物质易被氧化,需密封保存 C、W与Y之间可以形成多种化合物 D、的键角大于的键角20. 下列有关物质性质的比较,结论正确的是A、溶解度:Na2CO3<NaHCO3 B、热稳定性:HCl<PH3 C、沸点:C2H6<C4H10 D、碱性:LiOH<Be(OH)221. 甲~丁均为短周期主族元素,在元素周期表中的相对位置如图所示。丁的最高价氧化物对应的水化物在同周期中酸性最强,下列说法正确的是
A、简单氢化物的稳定性:Y>Z B、该物质易被氧化,需密封保存 C、W与Y之间可以形成多种化合物 D、的键角大于的键角20. 下列有关物质性质的比较,结论正确的是A、溶解度:Na2CO3<NaHCO3 B、热稳定性:HCl<PH3 C、沸点:C2H6<C4H10 D、碱性:LiOH<Be(OH)221. 甲~丁均为短周期主族元素,在元素周期表中的相对位置如图所示。丁的最高价氧化物对应的水化物在同周期中酸性最强,下列说法正确的是甲
乙
丙
丁
A、非金属性:丁>丙>甲 B、原子半径:甲>乙>丙 C、最简单氢化物的沸点:乙>甲 D、丙与乙形成的二元化合物易溶于水和强碱溶液二、多选题
-
22. 碱土金属碳酸盐热分解反应的相关数据如图表,其分解温度(一定压强下热分解反应达平衡时的温度)与压强有关。已知 和 随温度T的变化可以忽略不计,当且仅当 为 且分解反应达平衡时恰有 。下列说法正确的是( )
总压 ,
117
175
x
268
167
161
167
167
时的分解温度/K
701
1087
1413
1605
A、表中 B、4种碳酸盐热分解的 相近,其主要原因是4种晶体的晶体类型相似 C、从 到 ,阳离子半径依次增大, 与 的作用力逐渐减弱,生成 越来越难,导致其分解温度越来越高 D、露天条件下(总压p为 ),石灰石受热分解生成生石灰的起始温度高于23. M、X、Y、Z、W均为短周期元素,且原子序数依次减小,并能形成如图所示化合物,下列说法正确的是( ) A、简单离子半径: B、简单氢化物的稳定性: C、X与W形成的某种化合物可使酸性高锰酸钾溶液褪色 D、由M、X、Z、W四种元素组成的化合物的水溶液可能显碱性
A、简单离子半径: B、简单氢化物的稳定性: C、X与W形成的某种化合物可使酸性高锰酸钾溶液褪色 D、由M、X、Z、W四种元素组成的化合物的水溶液可能显碱性三、非选择题
-
24. CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:(1)、Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为 , 其固体的晶体类型为。(2)、NH3、PH3、AsH3的沸点由高到低的顺序为(填化学式,下同),还原性由强到弱的顺序为 , 键角由大到小的顺序为。(3)、含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有mol,该螯合物中N的杂化方式有种。
 (4)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
(4)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。坐标
原子
x
y
z
Cd
0
0
0
Sn
0
0
0.5
As
0.25
0.25
0.125

一个晶胞中有个Sn,找出距离Cd(0,0,0)最近的Sn(用分数坐标表示)。CdSnAs2
晶体中与单个Sn键合的As有个。
25. 氮、磷、砷 、锑 、铋 、镆 为元素周期表中原子序数依次增大的同族元素。回答下列问题:(1)、砷在元素周期表中的位置。 的中子数为。已知: ( ,白磷)= ( ,黑磷) ;
( ,白磷)= ( ,红磷) ;
由此推知,其中最稳定的磷单质是。
(2)、氮和磷氢化物性质的比较:热稳定性: (填“>”“<”)。
沸点: (填“>”“<”),判断依据是。
(3)、 和 与卤化氢的反应相似,产物的结构和性质也相似。下列对 与 反应产物的推断正确的是(填序号)。a.不能与 反应 b.含离子键、共价键 c.能与水反应
(4)、 能发生较强烈的水解,生成难溶的 ,写出该反应的化学方程式 , 因此,配制 溶液应注意。
(5)、在1L真空密闭容器中加入a mol PH4I固体,时发生如下反应:
①②
③
达平衡时,体系中 , , ,则 ℃时反应①的平衡常数 值为(用字母表示)。26. W、X、Y、Z四种元素均为短周期元素,原子序数依次增大,其它相关信息见下表。
根据上述信息,回答下列问题:
(1)、元素Y在元素周期表中的位置是;Y和Z的简单离子半径比较,较大的是(用离子符号表示)。(2)、XY2由固态变为气态所需克服的微粒间作用力是;由元素W和Y组成的一种绿色氧化剂的电子式为。(3)、由W、X、Y、Z四种元素组成的一种无机盐,水溶液呈碱性的原因是 (用离子方程式表示)。27. 铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。(1)、按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于区。(2)、Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+ , 请从离子的价电子式角度解释Mn2+与Fe2+还原能力的差别:。Mn2+的半径 Fe3+的半径(填“>”、“<”或“=”)。(3)、金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为(用含π的式子表示)。(4)、向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。N、H、O三种元素的电负性由大到小的顺序为;[Fe(SCN)(H2O)5]2+中Fe3+的配位数为 , H2O中氧原子的杂化方式为。(5)、二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2 , 可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H )配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π
)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π  表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π  ),则C5H
),则C5H  的大π键表示为。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是(填标号)。
的大π键表示为。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是(填标号)。 A 离子键 B 配位键 C σ 键 D 范德华力
 (6)、一种含有Fe、Cu、S三种元素的矿物的晶胞(如上图b所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为。若晶胞的底面边长为A pm,高为C pm,阿伏加德罗常数为NA , 则该晶体的密度为 g/cm3(写出表达式)。28. 已知①~⑩号元素在周期表中的位置如图。试回答下列问题:
(6)、一种含有Fe、Cu、S三种元素的矿物的晶胞(如上图b所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为。若晶胞的底面边长为A pm,高为C pm,阿伏加德罗常数为NA , 则该晶体的密度为 g/cm3(写出表达式)。28. 已知①~⑩号元素在周期表中的位置如图。试回答下列问题: (1)、上述元素中属于d区的有:(填编号)。(2)、②、③、④三种元素的第一电离能由大到小的顺序为(用元素符号表示)。(3)、请根据等电子体原理,写出由②、③两种元素组成的带有一个单位负电荷离子的电子式:。(4)、⑧号元素在元素周期表中的位置是 , ⑩号原子处于基态时核外电子排布式为 , 已知元素⑩和⑦的电负性分别为1.9和2.5,则⑩与⑦形成的化合物属于(填“离子”或“共价”)化合物。(5)、③号元素原子与①号元素原子形成的原子个数比为1∶3的分子X的空间构型为 , X在①与④形成的化合物Y中的溶解度很大,其主要原因是 , X分子中中心原子为杂化,X分子与⑩号元素对应的二价阳离子形成的配离子的化学式为。(6)、⑤号元素原子与Tl元素形成的晶体的晶胞如图所示,该物质的化学式为 , 若忽略Tl原子,则此晶体中⑤的空间结构跟哪种常见物质的晶体结构一样?。已知该晶体的密度为ρ g·cm-3 , 阿伏加德罗常数为NA , 则该晶体中晶胞边长为 pm(只写计算式)。
(1)、上述元素中属于d区的有:(填编号)。(2)、②、③、④三种元素的第一电离能由大到小的顺序为(用元素符号表示)。(3)、请根据等电子体原理,写出由②、③两种元素组成的带有一个单位负电荷离子的电子式:。(4)、⑧号元素在元素周期表中的位置是 , ⑩号原子处于基态时核外电子排布式为 , 已知元素⑩和⑦的电负性分别为1.9和2.5,则⑩与⑦形成的化合物属于(填“离子”或“共价”)化合物。(5)、③号元素原子与①号元素原子形成的原子个数比为1∶3的分子X的空间构型为 , X在①与④形成的化合物Y中的溶解度很大,其主要原因是 , X分子中中心原子为杂化,X分子与⑩号元素对应的二价阳离子形成的配离子的化学式为。(6)、⑤号元素原子与Tl元素形成的晶体的晶胞如图所示,该物质的化学式为 , 若忽略Tl原子,则此晶体中⑤的空间结构跟哪种常见物质的晶体结构一样?。已知该晶体的密度为ρ g·cm-3 , 阿伏加德罗常数为NA , 则该晶体中晶胞边长为 pm(只写计算式)。 29. A,B,C,D,E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。(1)、E元素形成的氧化物对应的水化物的化学式为。(2)、元素C、D、E形成的简单离子半径大小关系是(用离子符号表示)。(3)、用电子式表示化合物D2C的形成过程:。C、D还可形成化合物D2C2 , D2C2中含有的化学键类型是。(4)、由A、B、C三种元素形成的离子化合物的化学式为 , 它与强碱溶液共热,发生反应的离子方程式是。(5)、某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为(化学式用具体的元素符号表示)。30. 钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:(1)、钴元素在周期表中的位置是 , 其外围电子排布式为。(2)、已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是。(3)、配位化学创始人维尔纳发现,取1mol配合物CoCl3·6NH3(黄色)溶于水,加人足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
29. A,B,C,D,E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。(1)、E元素形成的氧化物对应的水化物的化学式为。(2)、元素C、D、E形成的简单离子半径大小关系是(用离子符号表示)。(3)、用电子式表示化合物D2C的形成过程:。C、D还可形成化合物D2C2 , D2C2中含有的化学键类型是。(4)、由A、B、C三种元素形成的离子化合物的化学式为 , 它与强碱溶液共热,发生反应的离子方程式是。(5)、某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为(化学式用具体的元素符号表示)。30. 钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:(1)、钴元素在周期表中的位置是 , 其外围电子排布式为。(2)、已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是。(3)、配位化学创始人维尔纳发现,取1mol配合物CoCl3·6NH3(黄色)溶于水,加人足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。①根据上述事实推测原配合物中络离子化学式为。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式;生成气体分子的中心原子杂化方式为。
(4)、经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于 , 若该堆积方式下的晶胞参数为acm,则钴原子的半径为pm。 31. 下表列出了①~⑨九种元素在周期表中的位置。
31. 下表列出了①~⑨九种元素在周期表中的位置。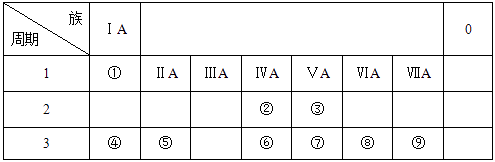
请按要求回答下列问题:
(1)、⑧的原子结构示意图是;(2)、③、⑤、⑦三种元素的原子半径由大到小的顺序是 (填元素符号);(3)、元素②的气态氢化物比元素⑥的气态氢化物的稳定性较 (填 “强”或“弱”);(4)、④和⑨两种元素组成的化合物与AgNO3溶液反应的离子方程式是。32. 砷化镓(GaAs)是优良的半导体材料或用于制作微型激光器或太阳能电池的材料等。部分元素在周期表中位置如下:Al
Si
P
Ga
Ge
As
回答下列问题:
(1)、六种元素中,非金属性最强的元素是:.写出As原子的最外层的电子排布式 , As原子核外有个未成对电子。(2)、根据元素周期律,可判断原子半径GaAs。(选填“>”、 “<”或“=”)。写出铝的最高价氧化物对应水化物的电离方程式:(3)、NH3 的分子构型是。GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,可能的原因是.写出C2H2的电子式为:(4)、比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4
GeBr4
GeI4
熔点/℃
-49.5
26
146
沸点/℃
83.1
186
约400
33. K、Fe、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:(1)、K元素处于元素周期表的 区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级有个。(2)、KCl 和NaCl 均为重要的化学试剂,KCl 的熔点低于NaCl的原因为。(3)、从原子结构角度分析,Fe3+比Fe2+更稳定的原因是。(4)、NiSO4 溶于氨水形成[Ni (NH3)6]SO4。①写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式。
②1mol[Ni(NH3)6]SO4中含有σ键的数目为。
③NH3 的VSEPR模型为 ;中心原子的杂化形式为 , 其杂化轨道的作用为。
(5)、K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=g/cm3(用代数式表示)。 34. 磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。(1)、基态铜原子的电子排布式为;价电子中成对电子数有个。(2)、磷化铜与水作用产生有毒的磷化氢(PH3)。
34. 磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。(1)、基态铜原子的电子排布式为;价电子中成对电子数有个。(2)、磷化铜与水作用产生有毒的磷化氢(PH3)。①PH3分子中的中心原子的杂化方式是。
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3H3PO4(填“>”或“<”),从结构的角度说明理由:。
(3)、磷青铜中的锡、磷两元素电负性的大小为SnP(填“>”“<”或“=”)。(4)、某磷青铜晶胞结构如图所示。
①则其化学式为。
②该晶体中距离Cu原子最近的Sn原子有个,这些Sn原子所呈现的构型为。
③若晶体密度为8.82g·cm-3 , 最近的Cu原子核间距为pm(用含NA的代数式表示)。
35. X、Y、Z、W是原子序数依次增大的短周期主族元素.通常状况下,X与W元素均能形成﹣1价的气态氢化物,Y为同周期主族元素中原子半径最大的元素.X、Z和W的原子最外层电子教之和为20.回答下列问题:(1)、X在兀素周期表中的位置是 .(2)、X和Y元素简单离子的半径较大的是(填离子符号);Z和W元素气态氢化物的稳定性较强的是(填化学式).(3)、Y的氧化物中既含离子键又含共价键的是(用电子式表示).(4)、Z的最高价氧化物对应水化物的浓溶液(过量)和氧化亚铜共热,反应的化学方程式为 .