高考二轮复习知识点:元素周期表中原子结构与元素性质的递变规律2
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. W、X、Y、Z为原子序数依次增大的短周期主族元素。W和Y同族,Y的原子序数是W的2倍,X是地壳中含量最多的金属元素。下列说法正确的是( )A、非金属性:Y>W B、XZ3是离子化合物 C、Y、Z的氧化物对应的水化物均为强酸 D、X与Y可形成化合物X2Y32. 一种麻醉剂的分子结构式如图所示。其中, 的原子核只有1个质子;元素 、 、 原子序数依次增大,且均位于 的下一周期;元素 的原子比 原子多8个电子。下列说法不正确的是( )
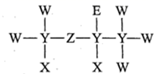 A、 是一种强酸 B、非金属性: C、原子半径: D、 中, 的化合价为+2价3. 我国嫦娥五号探测器带回1.731 kg的月球土壤,经分析发现其构成与地球土壤类似,土壤中含有的短周期元素W、X、Y、Z,原子序数依次増大,最外层电子数之和为 15。X、Y、Z为同周期相邻元素,且均不与W同族,下列结论正确的是( )A、原子半径大小顺序为W>X>Y>Z B、化合物XW中的化学健为离子键 C、Y单质的导电性能弱于Z单质的 D、Z的氧化物的水化物的酸性强于碳酸4. 现有4种短周期主族元素X、Y、Z和Q,原子序数依次增大,其中Z、Q在同一周期。相关信息如下表:
A、 是一种强酸 B、非金属性: C、原子半径: D、 中, 的化合价为+2价3. 我国嫦娥五号探测器带回1.731 kg的月球土壤,经分析发现其构成与地球土壤类似,土壤中含有的短周期元素W、X、Y、Z,原子序数依次増大,最外层电子数之和为 15。X、Y、Z为同周期相邻元素,且均不与W同族,下列结论正确的是( )A、原子半径大小顺序为W>X>Y>Z B、化合物XW中的化学健为离子键 C、Y单质的导电性能弱于Z单质的 D、Z的氧化物的水化物的酸性强于碳酸4. 现有4种短周期主族元素X、Y、Z和Q,原子序数依次增大,其中Z、Q在同一周期。相关信息如下表:元素
相关信息
X
最外层电子数是核外电子总数的一半
Y
最高化合价和最低化合价之和为零
Z
单质为淡黃色固体,常存在于火山喷口附近
Q
同周期元素中原子半径最小
下列说法正确的是( )
A、常温时,X单质能与水发生剧烈反应 B、Y与Q元素组成的YQ4分子,空间构型为正四面体 C、Y、Z、Q最高价氧化物对应水化物的酸性依次减弱 D、第五周期且与Q同主族元素的单质在常温常压下呈液态5. 短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是( )元素
X
Y
Z
W
最高价氧化物的水化物
H3ZO4
溶液对应的pH(25℃)
1.00
13.00
1.57
0.70
A、元素电负性:Z<W B、简单离子半径:W<Y C、元素第一电离能:Z<W D、简单氢化物的沸点:X<Z6. R、G、Y、X为原子序数依次增大的四种短周期元素,Y与G同周期,X与Y同主族。甲、乙、丙、丁、戊为这四种元素构成的化合物,其转化关系如图。下列说法中正确的是 A、Y的氢化物沸点高于G的氢化物沸点 B、基态X原子核外电子有9种空间运动状态 C、丁的稀溶液在反应③中做催化剂 D、G的最高价氧化物的水化物的酸性比X的强7. 下列判断正确的是A、稳定性:H2S>H2O B、熔点:Na>Mg C、碱性:NaOH>Mg(OH)2 D、酸性:HF>HCl8. X、Y、Z、W是原子序数依次增大的四种短周期元素。X和Y的基态原子s能级电子总数均等于其p能级电子总数,Z的原子最外层电子数是Y原子最外层电子数的2倍,W和X位于同一主族。下列说法错误的是A、Z单质可用于制作半导体材料 B、元素Z、W的最高价氧化物对应水化物都是强酸 C、元素X的简单气态氢化物的热稳定性比W的强 D、简单离子半径:9. 常用作沉淀滴定分析试剂。X是原子半径最小的元素,Y的基态原子中单电子与成对电子个数比为3∶4,Z元素的电负性仅次于氟元素,W原子电子总数与Z原子的最外层电子数相同。下列说法正确的是A、简单氢化物的稳定性: B、电负性: C、第一电离能: D、Y原子核外电子有7种空间运动状态10. 下列关于Na和K的比较中正确的是A、原子半径:Na>K B、金属性:Na>K C、第一电离能:Na>K D、还原性:Na>K11. W、X、Y、Z为原子序数依次增大的短周期元素。W原子的核外电子只有一种运动状态;X与Z同主族,X元素基态原子最高能级的不同轨道都有电子,并且自旋方向相同;Y元素原子中只有两种形状的电子云,最外层没有成对电子。下列说法正确的是A、非金属性:W>X B、最简单氢化物的键角:X<Z C、简单离子半径:Y>X D、四种元素的氧化物都至少有两种12. X、Y、Z、R、W是原子序数依次递增的五种短周期主族元素,它们所在周期数之和为11,其中Y元素最高与最低化合价的代数和为2,Y和Z的单质生成的化合物是一种传递神经信息的“信使分子”,R的原子半径是五种元素中最大的,Y和W是同族元素。下列说法正确的是A、简单离子的半径:W>Y>Z B、简单氢化物的稳定性:Y<W C、若R为非金属,R的最高价氧化物是酸性氧化物,不能与任何酸反应 D、标准状况下,1molYZ与0.5molZ2混合后所得气体的体积为22.4L13. 由SiCl4制备高纯SiH4的反应为SiCl4+LiAlH4SiH4↑+LiCl+AlCl3。下列说法正确的是A、热稳定性:HCl>SiH4 B、离子半径:r(Li+)>r(H-) C、第一电离能:I1(Al)>I1(Cl) D、共价键的极性:Si-Cl>Al-Cl14. R、X、Y、Z为原子序数依次增大的前20号元素。R和Y位于同主族,R原子最外层电子数与X的原子序数之和等于Z的原子序数。向这四种元素组成的一种化合物Q的溶液中滴加Ba(OH)2溶液,产生沉淀的物质的量与加入Ba(OH)2的物质的量的关系如图所示。下列说法错误的是
A、Y的氢化物沸点高于G的氢化物沸点 B、基态X原子核外电子有9种空间运动状态 C、丁的稀溶液在反应③中做催化剂 D、G的最高价氧化物的水化物的酸性比X的强7. 下列判断正确的是A、稳定性:H2S>H2O B、熔点:Na>Mg C、碱性:NaOH>Mg(OH)2 D、酸性:HF>HCl8. X、Y、Z、W是原子序数依次增大的四种短周期元素。X和Y的基态原子s能级电子总数均等于其p能级电子总数,Z的原子最外层电子数是Y原子最外层电子数的2倍,W和X位于同一主族。下列说法错误的是A、Z单质可用于制作半导体材料 B、元素Z、W的最高价氧化物对应水化物都是强酸 C、元素X的简单气态氢化物的热稳定性比W的强 D、简单离子半径:9. 常用作沉淀滴定分析试剂。X是原子半径最小的元素,Y的基态原子中单电子与成对电子个数比为3∶4,Z元素的电负性仅次于氟元素,W原子电子总数与Z原子的最外层电子数相同。下列说法正确的是A、简单氢化物的稳定性: B、电负性: C、第一电离能: D、Y原子核外电子有7种空间运动状态10. 下列关于Na和K的比较中正确的是A、原子半径:Na>K B、金属性:Na>K C、第一电离能:Na>K D、还原性:Na>K11. W、X、Y、Z为原子序数依次增大的短周期元素。W原子的核外电子只有一种运动状态;X与Z同主族,X元素基态原子最高能级的不同轨道都有电子,并且自旋方向相同;Y元素原子中只有两种形状的电子云,最外层没有成对电子。下列说法正确的是A、非金属性:W>X B、最简单氢化物的键角:X<Z C、简单离子半径:Y>X D、四种元素的氧化物都至少有两种12. X、Y、Z、R、W是原子序数依次递增的五种短周期主族元素,它们所在周期数之和为11,其中Y元素最高与最低化合价的代数和为2,Y和Z的单质生成的化合物是一种传递神经信息的“信使分子”,R的原子半径是五种元素中最大的,Y和W是同族元素。下列说法正确的是A、简单离子的半径:W>Y>Z B、简单氢化物的稳定性:Y<W C、若R为非金属,R的最高价氧化物是酸性氧化物,不能与任何酸反应 D、标准状况下,1molYZ与0.5molZ2混合后所得气体的体积为22.4L13. 由SiCl4制备高纯SiH4的反应为SiCl4+LiAlH4SiH4↑+LiCl+AlCl3。下列说法正确的是A、热稳定性:HCl>SiH4 B、离子半径:r(Li+)>r(H-) C、第一电离能:I1(Al)>I1(Cl) D、共价键的极性:Si-Cl>Al-Cl14. R、X、Y、Z为原子序数依次增大的前20号元素。R和Y位于同主族,R原子最外层电子数与X的原子序数之和等于Z的原子序数。向这四种元素组成的一种化合物Q的溶液中滴加Ba(OH)2溶液,产生沉淀的物质的量与加入Ba(OH)2的物质的量的关系如图所示。下列说法错误的是 A、简单离子半径:Y> Z> R> X B、Q溶液中两种阳离子浓度相等 C、Z2R2中含有离子键和非极性共价键 D、最简单气态氢化物的热稳定性:R>Y15. 某化合物(结构如图所示)是一种家用杀虫剂。X、Y、Z、W、R为原子序数逐渐增大的短周期元素,Z与R不在同一周期。下列叙述正确的是
A、简单离子半径:Y> Z> R> X B、Q溶液中两种阳离子浓度相等 C、Z2R2中含有离子键和非极性共价键 D、最简单气态氢化物的热稳定性:R>Y15. 某化合物(结构如图所示)是一种家用杀虫剂。X、Y、Z、W、R为原子序数逐渐增大的短周期元素,Z与R不在同一周期。下列叙述正确的是 A、Z、W的氢化物均很稳定 B、阴离子的还原性:R>X C、W、R两种元素均可形成能使品红溶液褪色的化合物,且褪色原理相同 D、元素Y与元素R均能形成三种以上的含氧酸盐16. 短周期主族元素X、Y、Z、W的原子序数依次增大,其中X的一种核素常用于测定文物年代,基态Y原子s能级电子总数与p能级电子总数相等,X原子与Y原子的价层电子数之和与Z原子的价层电子数相等。下列说法正确的是A、X、W形成的化合物易溶于水 B、最高价氧化物对应水化物的酸性:X> Z C、Y元素的第一电离能比同周期相邻元素大 D、原子半径:X> Y> Z> W17. 2022年诺贝尔化学奖授予了对点击化学和生物正交化学做出贡献的三位科学家。我国科学家在寻找新的点击反应砌块的过程中,意外发现一种安全、高效的合成化合物,其结构简式如图所示,其中X、Y、Z和W是原子序数依次增大的短周期元素,W的原子序数是Y的二倍。下列说法错误的是
A、Z、W的氢化物均很稳定 B、阴离子的还原性:R>X C、W、R两种元素均可形成能使品红溶液褪色的化合物,且褪色原理相同 D、元素Y与元素R均能形成三种以上的含氧酸盐16. 短周期主族元素X、Y、Z、W的原子序数依次增大,其中X的一种核素常用于测定文物年代,基态Y原子s能级电子总数与p能级电子总数相等,X原子与Y原子的价层电子数之和与Z原子的价层电子数相等。下列说法正确的是A、X、W形成的化合物易溶于水 B、最高价氧化物对应水化物的酸性:X> Z C、Y元素的第一电离能比同周期相邻元素大 D、原子半径:X> Y> Z> W17. 2022年诺贝尔化学奖授予了对点击化学和生物正交化学做出贡献的三位科学家。我国科学家在寻找新的点击反应砌块的过程中,意外发现一种安全、高效的合成化合物,其结构简式如图所示,其中X、Y、Z和W是原子序数依次增大的短周期元素,W的原子序数是Y的二倍。下列说法错误的是 A、简单氢化物的稳定性:Z>Y B、含氧酸的酸性:W>X C、X与Y能形成多种二元化合物 D、分子结构中除W外,其他元素均满足8电子结构18. 短周期主族元素X、Y、Z能组成化合物X+[Y-Z-Y]- , 其中X和Y同主族,且三种元素原子序数总和为19。下列说法错误的是A、原子半径:X>Y>Z B、化合物XY具有很强的还原性 C、X的最高价氧化物的水化物是强碱 D、Y与Z至少可以形成两种化合物19. W、X、Y、Z为原子序数依次增大,且为不同主族的短周期元素,四种元素的最外层电子数满足W+X=Y+Z,WZ4是一种常见的有机溶剂。下列叙述正确的是A、原子半径:Z>Y>X>W B、W与X形成的共价化合物中,W和X均满足8电子稳定结构 C、Y的氧化物一定为碱性氧化物 D、用惰性电极电解熔融的Y与Z形成的化合物一定能得到对应的单质20. X、Y、Z、W均属于短周期元素,其中X、Y位于同一主族,Y、Z、W处于同一周期。X原子的最外层电子数是其电子层数的3倍,基态Z原子的电子总数是其最高能级电子数的5倍,同周期中W电负性最大。下列说法正确的是A、简单离子半径由小到大的顺序:X<Z<Y<W B、Y元素最高价氧化物对应水化物的化学式可表示为 C、上述元素形成的简单氢化物中X的氢化物沸点最高、最稳定 D、第一电离能:Z<Y<W<X21. 甲~戊均为短周期主族元素,在元素周期表中的相对位置如下图所示,戊的最高价氧化物对应的水化物为强酸,下列说法可能错误的是
A、简单氢化物的稳定性:Z>Y B、含氧酸的酸性:W>X C、X与Y能形成多种二元化合物 D、分子结构中除W外,其他元素均满足8电子结构18. 短周期主族元素X、Y、Z能组成化合物X+[Y-Z-Y]- , 其中X和Y同主族,且三种元素原子序数总和为19。下列说法错误的是A、原子半径:X>Y>Z B、化合物XY具有很强的还原性 C、X的最高价氧化物的水化物是强碱 D、Y与Z至少可以形成两种化合物19. W、X、Y、Z为原子序数依次增大,且为不同主族的短周期元素,四种元素的最外层电子数满足W+X=Y+Z,WZ4是一种常见的有机溶剂。下列叙述正确的是A、原子半径:Z>Y>X>W B、W与X形成的共价化合物中,W和X均满足8电子稳定结构 C、Y的氧化物一定为碱性氧化物 D、用惰性电极电解熔融的Y与Z形成的化合物一定能得到对应的单质20. X、Y、Z、W均属于短周期元素,其中X、Y位于同一主族,Y、Z、W处于同一周期。X原子的最外层电子数是其电子层数的3倍,基态Z原子的电子总数是其最高能级电子数的5倍,同周期中W电负性最大。下列说法正确的是A、简单离子半径由小到大的顺序:X<Z<Y<W B、Y元素最高价氧化物对应水化物的化学式可表示为 C、上述元素形成的简单氢化物中X的氢化物沸点最高、最稳定 D、第一电离能:Z<Y<W<X21. 甲~戊均为短周期主族元素,在元素周期表中的相对位置如下图所示,戊的最高价氧化物对应的水化物为强酸,下列说法可能错误的是甲
丁
乙
丙
戊
A、非金属性:丙<戊 B、单质的熔点:甲>乙 C、简单氢化物的稳定性:丁>戊 D、最外层电子数:乙<丙22. 短周期主族元素W、X、Y、Z的原子序数依次增大。W与X不在同周期, X原子的最外层电子数与核外电子总数之比为3:4,Y、Z相邻,Y的单质在空气中燃烧,产物有两种离子化合物和一种单质。下列说法错误的是A、简单离子的半径:X> Y>Z B、工业上常用电解熔融YX制备Y单质 C、Z2(SO4)3溶液是泡沫灭火器原料之一,原理利用了Z离子的水解 D、X的某氢化物可作为杀菌消毒剂23. 2022年我国科学家首次在月球上发现一种硅酸盐矿物,该物质含有X、Y、Z、W、E五种主族元素,原子序数依次增大且均不大于20,X、W为非金属元素,Y、Z、E为金属元素,Y的最高正化合价为 , Z和E同族。下列说法错误的是A、原子半径: B、X和Y可形成含有非极性键的离子化合物 C、Y、Z、E的最高价氧化物对应的水化物均为强碱 D、简单气态氢化物稳定性:24. 化合物M[化学式为RQ4Y(ZX4)2·12Q2X]曾是一种食品添加剂,现已被禁用。Q、R、X、Y、Z 元素分别处于三个短周期,原子序数依次增加,且和为45。在元素周期表中X与R 、Z相邻。下列叙述正确的是 A、简单离子半径:R>X>Y>Z B、Q与X的二元简单化合物比Q与R的二元简单化合物沸点高、热稳定性强 C、X与R或Z组成的二元化合物均为酸性氧化物 D、向一定体积的M溶液中滴加等浓度的Ba(OH)2溶液,生成沉淀质量的曲线如图所示25. 大多数离子液体含有体积很大的阴、阳离子,某离子液体结构如图所示,其中X、Y、Z为原子序数依次增大的短周期非金属元素,X、Z同主族。该物质可通过以物质M(
A、简单离子半径:R>X>Y>Z B、Q与X的二元简单化合物比Q与R的二元简单化合物沸点高、热稳定性强 C、X与R或Z组成的二元化合物均为酸性氧化物 D、向一定体积的M溶液中滴加等浓度的Ba(OH)2溶液,生成沉淀质量的曲线如图所示25. 大多数离子液体含有体积很大的阴、阳离子,某离子液体结构如图所示,其中X、Y、Z为原子序数依次增大的短周期非金属元素,X、Z同主族。该物质可通过以物质M( , 含有大π键,表示为Π , n为参与形成大π键的原子个数,m为参与形成大π键的电子个数)为原料合成得到。下列说法正确的是
, 含有大π键,表示为Π , n为参与形成大π键的原子个数,m为参与形成大π键的电子个数)为原料合成得到。下列说法正确的是 A、第一电离能:Y>X>Z B、X2Y2分子为直线形分子 C、M分子中存在的大π键为Π D、电负性:X>Y>Z
A、第一电离能:Y>X>Z B、X2Y2分子为直线形分子 C、M分子中存在的大π键为Π D、电负性:X>Y>Z二、非选择题
-
26. 物质A由原子序数依次增大的短周期元素X、Y、Z组成,其中Z为地壳含量最高的金属元素,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如下图所示:
回答下列问题:
 (1)、Y、Z元素的名称为徐寿确定并使用至今,Y在周期表中的位置是 , 写出YX的电子式。(2)、比较X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示)。(3)、在YZO2与YX的混合液中,通入足量CO2是工业制取A的一种方法,写出该反应的化学方程式。27.(1)、Ⅰ.天然气开采过程会产生大量含硫废水(硫元素的主要存在形式为),可采用氧化法对其进行处理。
(1)、Y、Z元素的名称为徐寿确定并使用至今,Y在周期表中的位置是 , 写出YX的电子式。(2)、比较X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示)。(3)、在YZO2与YX的混合液中,通入足量CO2是工业制取A的一种方法,写出该反应的化学方程式。27.(1)、Ⅰ.天然气开采过程会产生大量含硫废水(硫元素的主要存在形式为),可采用氧化法对其进行处理。下列事实中,能够比较氢硫酸与亚硫酸的酸性强弱的是____(填标号)。
A、氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 B、氢硫酸的导电能力低于亚硫酸 C、常温下,的氢硫酸和亚硫酸的分别为4.5和2.1 D、氢硫酸的还原性强于亚硫酸(2)、Ⅱ.已知:氧化还原反应可拆分为氧化、还原两个半反应,电极电势分别表示为和 , 电势差。如的。两组电对的电势差越大,反应的自发程度越大。各电对的电极电势与产物浓度的关系如图1所示,将体系中自发程度最大的反应记为ⅰ,反应ⅰ的离子方程式为。各微粒的相对能量如下表:
相对能量
a
b
0
c
d
e
已知反应ⅰ为放热反应,当有发生反应ⅰ时,释放的能量为。(用含字母的代数式表示)
 (3)、时,向浓度为的溶液中加入一定量固体,在不同下的去除率随时间变化如图所示。
(3)、时,向浓度为的溶液中加入一定量固体,在不同下的去除率随时间变化如图所示。
①实际生产中采取的去除条件,而不选择更低的原因为。
②时,前的去除速率;实际生产中反应时间选择而不是更长,其原因为。
(4)、已知反应过程中还会发生如下两个反应(均未配平):ⅱ.
ⅲ
实验测得,在、时,的投加量对平衡体系中部分微粒浓度的影响如图所示。

①时,反应ⅲ的平衡常数。
②结合反应ⅰ、ⅱ、ⅲ分析,当投加量高于时,单位体积内S的质量减小的原因为。
28. 回答下列问题:(1)、常温常压下苯酚为无色晶体,而苯酚在水中以液态形式存在,原因是。(2)、和比较,热稳定性较好的是 , 理由是。29. 氧化锌在液晶显示器、薄膜晶体管、发光二极管等产品中均有应用,常用下列三种锌盐为原料经高温分解制备。
回答下列问题:
(1)、Zn为30号元素,它在元素周期表中的位置是。(2)、原料Ⅰ中阴离子空间结构为 , 其等电子体为(写出1种即可)。(3)、原料Ⅱ、Ⅲ阴离子对应的酸沸点较高的是(写结构简式),原因是。(4)、关于以上几种锌盐说法正确的是____。A、化合物Ⅱ中电负性最大的元素是O B、化合物Ⅱ中所有C原子的杂化形式均为sp3 C、化合物Ⅲ中只存在离子键和极性共价键 D、化合物Ⅰ阴离子中σ键和π键数目比为2:1(5)、ZnO存在多种晶体结构,其中纤锌矿型和闪锌矿型是最常见的晶体结构,下图为这两种晶体的局部结构。
①图a不是纤锌矿型ZnO的晶胞单元,原因是。
②图b闪锌矿型属于立方晶胞,原子1的坐标为 , 则原子2的坐标为。
③图的闪锌矿型ZnO晶体中离O距离最近的Zn原子数为 , 其晶胞参数为a nm,阿伏加德罗常数的值为NA , 则晶体密度为g/cm3(列出计算式)。
30. 氧、硫、硒、碲等氧族元素在化合物中常表现出多种氧化态,含氧族元素的化合物在研究和生产中有许多重要用途。请回答以下问题:(1)、氧、硫、硒三元素的第一电离能由大到小的顺序为(用元素符号回答)。(2)、基态Se原子的价层电子排布式为 , 其原子核外有种运动状态不同的电子。(3)、气态SO3为单分子状态,其中S原子的杂化轨道类型为。若SO3的三聚体(SO3)3的环状结构如图所示,则该结构中S原子的杂化轨道类型为。 (4)、氧族元素的气态氢化物中,H2S的稳定性强于H2Se,原因是。(5)、氧、硫分别与钙形成两种化合物的晶格能大小为 CaO CaS (填“>”,“<”或“=”)。 (6)硫化锌在光导材料、涂料等行业中应用广泛,其晶体结构如图,则该晶体属于晶体,化学式为 , 若晶体的密度为ρg·cm-3 , 则晶胞边长为cm (阿伏加德罗常数的值用NA表示)。
(4)、氧族元素的气态氢化物中,H2S的稳定性强于H2Se,原因是。(5)、氧、硫分别与钙形成两种化合物的晶格能大小为 CaO CaS (填“>”,“<”或“=”)。 (6)硫化锌在光导材料、涂料等行业中应用广泛,其晶体结构如图,则该晶体属于晶体,化学式为 , 若晶体的密度为ρg·cm-3 , 则晶胞边长为cm (阿伏加德罗常数的值用NA表示)。 31. X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素。X和R属同族元素;Z和U位于第VIIA族;X和Z可形成化合物XZ4;Q基态原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃。
31. X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素。X和R属同族元素;Z和U位于第VIIA族;X和Z可形成化合物XZ4;Q基态原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃。请回答下列问题:
(1)、R基态原子的电子排布式是。(2)、利用价层电子对互斥理论判断TU3的立体构型是。(3)、X所在周期元素最高价氧化物对应的水化物中,酸性最强的是(填化学式);Z和U的氢化物中沸点较高的是(填化学式);Q、R、U的单质形成的晶体,熔点由高到低的排列顺序是(填化学式)。(4)、CuSO4溶液能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是。32. 过碳酸钠(2Na2CO3·3H2O2)晶体性质具有Na2CO3和H2O2 的双重性,被广泛用于氧气发生、漂白杀菌、污水处理、金属表面处理以及高分子聚合控制等。(1)、Na 原子的核外电子排布式为 , O 原子核外 L 层上有种能量不同的电子,H2O2 的电子式是(2)、设计一个简单实验,比较O 元素与其同主族短周期元素的非金属性强弱(简要写出实验方法、实验现象和结论);并用原子结构知识对作出的结论进行解释。(3)、用一个离子方程式表示过碳酸钠溶液显碱性的原因。(4)、高锰酸根离子( )水对人体危害极大,可用过碳酸钠改性赤泥进行处理,反应如下: +CO +H2O2→MnCO3¯+ +OH-+H2O补全并配平上述化学反应过程式;反应中,过碳酸钠起沉淀剂和剂作用;若将 1L 含Mn 2000mg·L-1 的含高锰酸根离子的废水处理至含Mn 1.2mg·L-1 , 则转移电子数为mol(保留 2 位小数)
33. 磷是人体所必需的重要矿物质元素,磷的化合物在生产和生活中应用广泛。反应:P4+ NaOH+H2O→ NaH2PO2 +PH3(未配平)制得的次磷酸钠(NaH2PO2)可作食品防腐剂,也可用于化学镀镍。
请回答下列问题:
(1)、磷原子的核外电子排布式:;磷原子核外有种能量不同的电子。(2)、上述反应的反应物和生成物中含有非极性键的分子是。(写出物质的化学式)(3)、将Na、O、P三种原子的原子半径大小按由大到小的顺序排列。(4)、NH3的稳定性比PH3的(填“强”或“弱”) , 判断理由是。(5)、A、配平上述反应,并标出电子转移方向与数目P4+ NaOH+H2O→ NaH2PO2 + PH3
B、上述反应中每生成1 mol 氧化产物,转移电子的数目为。
34. 周期表前四周期的元素 、 、 、 ,原子序数依次增大,X原子基态时 层中 轨道电子数与s轨道电子数相同; 原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料; 位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题:(1)、X位于周期表的第周期,第族。(2)、元素的第一电离能:XY(填“>”或“<”,下同);原子半径:XY。(3)、 的最高价氧化物对应水化物中酸根离子的空间构型是(用文字描述)。(4)、 基态核外电子排布式为 , 用铁氰化钾溶液检验 的离子方程式为。(5)、元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 , 它可与浓盐酸发生非氧化还原反应,生成配合物 ,反应的化学方程式:。 35. 钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:(1)、钒在元素周期表中的位置为 , 其价层电子排布图为。(2)、钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为、。(3)、V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是对,分子的立体构型为;SO3气态为单分子,该分子中S原子的杂化轨道类型为;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为(填图2中字母),该分子中含有个σ键。
35. 钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:(1)、钒在元素周期表中的位置为 , 其价层电子排布图为。(2)、钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为、。(3)、V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是对,分子的立体构型为;SO3气态为单分子,该分子中S原子的杂化轨道类型为;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为(填图2中字母),该分子中含有个σ键。 (4)、V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为。
(4)、V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为。