高考二轮复习知识点:元素周期表中原子结构与元素性质的递变规律1
试卷更新日期:2023-07-30 类型:二轮复习
一、选择题
-
1. 和的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是( )A、与都能在水中与氨形成配合物 B、和的熔点都比的低 C、和均可表现出弱酸性 D、和的氢化物都不能在酸中稳定存在2. 钠和钾是两种常见金属,下列说法正确的是( )A、钠元素的第一电离能大于钾 B、基态钾原子价层电子轨道表示式为
 C、钾能置换出NaCl溶液中的钠
D、钠元素与钾元素的原子序数相差18
3. 短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y同周期并相邻,Y是组成水的元素之一,Z在同周期主族元素中金属性最强,W原子在同周期主族元素中原子半径最小,下列判断正确的是( )A、是非极性分子 B、简单氢化物沸点: C、Y与Z形成的化合物是离子化合物 D、X、Y、Z三种元素组成的化合物水溶液呈酸性4. 科学家合成了一种新的共价化合物(结构如图所示),X、Y、Z、W为原子序数依次增大的短周期元素,W的原子序数等于X与Y的原子序数之和。下列说法错误的是( )A、原子半径: B、非金属性: C、Z的单质具有较强的还原性 D、原子序数为82的元素与W位于同一主族5. 下列推测不合理的是( )A、相同条件下,Br2与PBr3反应比Cl2与PCl3反应难 B、OPBrCl2与足量H2O作用生成2种酸 C、相同条件下,与水反应由快到慢的顺序:OPBr3、OPCl3、OPF3 D、PBr3与足量C2H5OH作用可得到P(OC2H5)36. R、X、Y、Z、M五种短周期主族元素,原子序数依次增大。基态R原子每个能级上电子数相等,基态X原子的价层电子排布为 , Y与M同主族,Z是同周期元素中原子半径最大的元素,Z核电荷数等于X、M原子的最外层电子数之和。下列说法不正确的是A、电负性:Y>X>R B、原子半径:Z>M>Y C、氢化物的沸点:R<Y D、Z与Y可形成两种常见的离子化合物,且晶体中的阴阳离子个数比均为1∶27. X、Y、Z、Q、T五种元素,原子序数依次增大。X原子轨道上有1个空轨道,Y原子的轨道只有一对成对电子,Z原子M层上有两个未成对电子,Q最高价氧化物对应水化物是常见的三元酸,微粒的价电子构型是。下列说法不正确的是A、第一电离能: B、X和Q各有一种单质的结构单元是正四面体 C、Y和Z形成的化合物为分子晶体 D、T与Y可形成阴离子8. 氧元素的非金属性比氯元素的非金属性强,下列说法中,能支持该结论的是( )A、相同条件下,氯气与铁反应生成氯化铁,氧气与铁反应生成四氧化三铁 B、氧元素与氯元素形成的化合物中,氧元素显负化合价,氯元素显正化合价 C、氧原子最外层电子数比氯原子最外层电子数少 D、氧原子的半径比氯原子的半径小9. 由主族元素X、Y、Z、W组成的化合物ZX4W(YX4)3具有良好的储氢性能,其中,X、Y、Z是短周期元素, 与均为10电子数微粒,四种元素的原子序数之和为33。下列有关说法错误的是A、X与Y、Z均可形成多种化合物 B、非金属性:Z> Y> >X C、X、W元素可形成离子化合物 D、原子半径:W> Y> Z> >X10. 短周期主族元素X、Y、Z、W原子序数依次增大,其中X、Y、Z可形成的化合物是一种具有发展前景的“绿色”化工产品( 如图所示),W是短周期中金属性最强的元素,下列说法正确的是
C、钾能置换出NaCl溶液中的钠
D、钠元素与钾元素的原子序数相差18
3. 短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y同周期并相邻,Y是组成水的元素之一,Z在同周期主族元素中金属性最强,W原子在同周期主族元素中原子半径最小,下列判断正确的是( )A、是非极性分子 B、简单氢化物沸点: C、Y与Z形成的化合物是离子化合物 D、X、Y、Z三种元素组成的化合物水溶液呈酸性4. 科学家合成了一种新的共价化合物(结构如图所示),X、Y、Z、W为原子序数依次增大的短周期元素,W的原子序数等于X与Y的原子序数之和。下列说法错误的是( )A、原子半径: B、非金属性: C、Z的单质具有较强的还原性 D、原子序数为82的元素与W位于同一主族5. 下列推测不合理的是( )A、相同条件下,Br2与PBr3反应比Cl2与PCl3反应难 B、OPBrCl2与足量H2O作用生成2种酸 C、相同条件下,与水反应由快到慢的顺序:OPBr3、OPCl3、OPF3 D、PBr3与足量C2H5OH作用可得到P(OC2H5)36. R、X、Y、Z、M五种短周期主族元素,原子序数依次增大。基态R原子每个能级上电子数相等,基态X原子的价层电子排布为 , Y与M同主族,Z是同周期元素中原子半径最大的元素,Z核电荷数等于X、M原子的最外层电子数之和。下列说法不正确的是A、电负性:Y>X>R B、原子半径:Z>M>Y C、氢化物的沸点:R<Y D、Z与Y可形成两种常见的离子化合物,且晶体中的阴阳离子个数比均为1∶27. X、Y、Z、Q、T五种元素,原子序数依次增大。X原子轨道上有1个空轨道,Y原子的轨道只有一对成对电子,Z原子M层上有两个未成对电子,Q最高价氧化物对应水化物是常见的三元酸,微粒的价电子构型是。下列说法不正确的是A、第一电离能: B、X和Q各有一种单质的结构单元是正四面体 C、Y和Z形成的化合物为分子晶体 D、T与Y可形成阴离子8. 氧元素的非金属性比氯元素的非金属性强,下列说法中,能支持该结论的是( )A、相同条件下,氯气与铁反应生成氯化铁,氧气与铁反应生成四氧化三铁 B、氧元素与氯元素形成的化合物中,氧元素显负化合价,氯元素显正化合价 C、氧原子最外层电子数比氯原子最外层电子数少 D、氧原子的半径比氯原子的半径小9. 由主族元素X、Y、Z、W组成的化合物ZX4W(YX4)3具有良好的储氢性能,其中,X、Y、Z是短周期元素, 与均为10电子数微粒,四种元素的原子序数之和为33。下列有关说法错误的是A、X与Y、Z均可形成多种化合物 B、非金属性:Z> Y> >X C、X、W元素可形成离子化合物 D、原子半径:W> Y> Z> >X10. 短周期主族元素X、Y、Z、W原子序数依次增大,其中X、Y、Z可形成的化合物是一种具有发展前景的“绿色”化工产品( 如图所示),W是短周期中金属性最强的元素,下列说法正确的是 A、简单氢化物的稳定性: Y<Z B、原子半径: X<Y<Z<W C、X2Z2、W2Z2中所含化学键类型完全相同 D、W的最高价氧化物的水化物是一种弱碱11. X、Y、Z、W为原子序数依次增大的前四周期元素,X与Y能形成多种常见二元化合物,Y与Z形成的某化合物是参与光合作用的主要气体,基态原子中X,Y、Z的价电子数之和等于W的价电子数。下列说法正确的是A、W属于d区元素 B、原子半径:X<Y<Z C、氢化物沸点:Y<Z D、基态原子的最外层电子数:X=W12. 短周期元素X、Y、Z在周期表中的位置如图所示,下列说法中错误的是
A、简单氢化物的稳定性: Y<Z B、原子半径: X<Y<Z<W C、X2Z2、W2Z2中所含化学键类型完全相同 D、W的最高价氧化物的水化物是一种弱碱11. X、Y、Z、W为原子序数依次增大的前四周期元素,X与Y能形成多种常见二元化合物,Y与Z形成的某化合物是参与光合作用的主要气体,基态原子中X,Y、Z的价电子数之和等于W的价电子数。下列说法正确的是A、W属于d区元素 B、原子半径:X<Y<Z C、氢化物沸点:Y<Z D、基态原子的最外层电子数:X=W12. 短周期元素X、Y、Z在周期表中的位置如图所示,下列说法中错误的是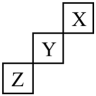 A、X元素的最外层电子数为2 B、X、Y、Z的单质中X最稳定 C、气态氢化物的稳定性:Y<Z D、Z的最高价氧化物的化学式为ZO313. R、X、Y、Z均为短周期元素,R与X同族,X的原子半径在这四种元素中是最小的,和均达到了8电子稳定结构,R的原子序数大于Z,Y原子的最外层电子数为Z原子与X原子的最外层电子数之差。下列叙述正确的是A、R的氯化物水溶液呈酸性 B、X的单质还原性比R的单质强 C、Y位于第三周期第VIA族 D、Z的原子半径比Y小14. 用α粒子()分别轰击和 , 发生核反应:和 , 其中基态原子的能级数与未成对电子数相等。下列说法正确的是A、与X同周期的元素中,第一电离能比X小的元素有两种 B、X和Z在其最高价氧化物的水化物中均采用杂化 C、的键角大于的键角 D、X、Y、Z的单质均为分子晶体15. X、Y、Z、M是电负性逐渐减小的短周期非金属元素。X、Z、M位于三个不同周期,Y与Z的价电子数之和为M价电子数的两倍;化合物的电子总数为18个。下列说法错误的是A、Y的含氧酸为弱酸 B、Z与M形成的化合物具有较强的还原性 C、简单氢化物的稳定性:X>Y>M D、原子半径:Z<X<Y<M16. X、Y、Z、Q、W是原子序数依次增大的前四周期元素,X、Z的基态原子2p能级上各有两个未成对电子,Y与Q同主族,W原子N能层只有一个电子,其余能层全充满。下列说法错误的是
A、X元素的最外层电子数为2 B、X、Y、Z的单质中X最稳定 C、气态氢化物的稳定性:Y<Z D、Z的最高价氧化物的化学式为ZO313. R、X、Y、Z均为短周期元素,R与X同族,X的原子半径在这四种元素中是最小的,和均达到了8电子稳定结构,R的原子序数大于Z,Y原子的最外层电子数为Z原子与X原子的最外层电子数之差。下列叙述正确的是A、R的氯化物水溶液呈酸性 B、X的单质还原性比R的单质强 C、Y位于第三周期第VIA族 D、Z的原子半径比Y小14. 用α粒子()分别轰击和 , 发生核反应:和 , 其中基态原子的能级数与未成对电子数相等。下列说法正确的是A、与X同周期的元素中,第一电离能比X小的元素有两种 B、X和Z在其最高价氧化物的水化物中均采用杂化 C、的键角大于的键角 D、X、Y、Z的单质均为分子晶体15. X、Y、Z、M是电负性逐渐减小的短周期非金属元素。X、Z、M位于三个不同周期,Y与Z的价电子数之和为M价电子数的两倍;化合物的电子总数为18个。下列说法错误的是A、Y的含氧酸为弱酸 B、Z与M形成的化合物具有较强的还原性 C、简单氢化物的稳定性:X>Y>M D、原子半径:Z<X<Y<M16. X、Y、Z、Q、W是原子序数依次增大的前四周期元素,X、Z的基态原子2p能级上各有两个未成对电子,Y与Q同主族,W原子N能层只有一个电子,其余能层全充满。下列说法错误的是 A、电负性为Z>Y>X B、原子半径为r(Q)>r(Y)>r(Z) C、X与Z可以形成含极性键的非极性分子 D、W与Z形成的化合物晶胞如图,其化学式为WZ17. W、X、Y、Z为原子序数依次增大的短周期元素,原子序数之和为32;M是由这四种元素组成的化合物,其化学式为YZX2W2(其中每种元素只有一种化合价);将8.0gM投入水中有刺激性气味的气体放出,该气体能使湿润的红色石蕊试纸变蓝,向所得溶液中通入足量的CO2 , 经过滤等一系列操作后得到7.8g的白色固体。下列叙述错误的是A、四种元素中有两种金属元素 B、原子半径:Y>Z>X C、M与盐酸反应能生成三种离子化合物 D、Y元素最高价氧化物的水化物能溶解Z元素最高价氧化物18. 某种天然硅酸盐矿石主要成分的化学式为R[Z2W3Y10]•3X2Y,其中X、Y、Z、W、R是主族元素,原子序数依次增大,且处于四个不同周期。Y元素是地壳中含量最高的元素,化合物RY在实验室中常用作干燥剂。下列说法正确的是A、原子半径:W>Z>Y B、工业制备Z单质采用热还原法 C、X和R形成的化合物,X显负价 D、W的最高价氧化物可溶于稀硝酸19. 有a、b、c、d四种短周期主族元素,它们在周期表中的位置如图所示,已知四种元素中只有b为金属元素,则下列有关说法中正确的是( )
A、电负性为Z>Y>X B、原子半径为r(Q)>r(Y)>r(Z) C、X与Z可以形成含极性键的非极性分子 D、W与Z形成的化合物晶胞如图,其化学式为WZ17. W、X、Y、Z为原子序数依次增大的短周期元素,原子序数之和为32;M是由这四种元素组成的化合物,其化学式为YZX2W2(其中每种元素只有一种化合价);将8.0gM投入水中有刺激性气味的气体放出,该气体能使湿润的红色石蕊试纸变蓝,向所得溶液中通入足量的CO2 , 经过滤等一系列操作后得到7.8g的白色固体。下列叙述错误的是A、四种元素中有两种金属元素 B、原子半径:Y>Z>X C、M与盐酸反应能生成三种离子化合物 D、Y元素最高价氧化物的水化物能溶解Z元素最高价氧化物18. 某种天然硅酸盐矿石主要成分的化学式为R[Z2W3Y10]•3X2Y,其中X、Y、Z、W、R是主族元素,原子序数依次增大,且处于四个不同周期。Y元素是地壳中含量最高的元素,化合物RY在实验室中常用作干燥剂。下列说法正确的是A、原子半径:W>Z>Y B、工业制备Z单质采用热还原法 C、X和R形成的化合物,X显负价 D、W的最高价氧化物可溶于稀硝酸19. 有a、b、c、d四种短周期主族元素,它们在周期表中的位置如图所示,已知四种元素中只有b为金属元素,则下列有关说法中正确的是( )a
b
c
d
A、第一电离能:d>c>b B、离子半径:c>d>a C、简单气态氢化物的稳定性:a<c<d D、c的最高价氧化物的水化物为强酸20. 短周期主族元素X、Y、Z、W原子序数依次增大,Y比X原子的核外电子数多1个,X与Z原子最外层电子数之比为。下列说法错误的是( )A、X、Y一定位于同一周期,Y、Z可能不位于同一周期 B、X气态氢化物分子的空间构型一定是正四面体 C、Y最高价氧化物对应的水化物可能是强电解质 D、若Y、Z、W位于同一周期,则电负性:21. 有机金属氯化物由原子序数依次增大的短周期主族元素X、Y、Z、M、N组成,部分结构如图所示,基态原子M核外电子所占据原子轨道全充满,N元素的价层电子排布式为nsn-1np2n-1。下列说法错误的是( )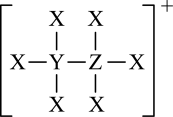 A、YN4为正四面体结构 B、氢化物的沸点Z>Y C、Z元素的第一电离能比同周期相邻元素的大 D、与M同族元素的基态原子最高能级的电子云轮廓图呈球形22. X、Y、Z、W是前4周期原子序数依次增大的主族元素,X在周期表中非金属性最强,Y的周期序数与族序数相等,Z原子次外层电子数是核外电子总数的一半,基态W原子核外16个轨道上填有电子。下列说法正确的是( )A、原子半径:r(X) <r(Y) <r(Z) <r(W) B、Z的简单气态氢化物沸点比X的高 C、第一电离能:I1(W) <I1(Y) <I1(Z) D、W最高价氧化物对应的水化物为可溶性强碱23. X、Y、Z和W为原子序数依次增大的短周期主族元素, X、Z同主族且能形成离子化合物,YW同主族且原子序数之和为24。四种元素组成的一种化合物 M具有下列性质: 白色沉淀M 溶液褪色并产生气泡。下列说法正确的是( )A、原子半径: W>Z>Y>X . B、简单氢化物的稳定性: W>Y C、Y与X、Z、W均能形成具有漂白性的物质 D、X、Z形成的离子化合物中阴阳离子核外电子排布相同
A、YN4为正四面体结构 B、氢化物的沸点Z>Y C、Z元素的第一电离能比同周期相邻元素的大 D、与M同族元素的基态原子最高能级的电子云轮廓图呈球形22. X、Y、Z、W是前4周期原子序数依次增大的主族元素,X在周期表中非金属性最强,Y的周期序数与族序数相等,Z原子次外层电子数是核外电子总数的一半,基态W原子核外16个轨道上填有电子。下列说法正确的是( )A、原子半径:r(X) <r(Y) <r(Z) <r(W) B、Z的简单气态氢化物沸点比X的高 C、第一电离能:I1(W) <I1(Y) <I1(Z) D、W最高价氧化物对应的水化物为可溶性强碱23. X、Y、Z和W为原子序数依次增大的短周期主族元素, X、Z同主族且能形成离子化合物,YW同主族且原子序数之和为24。四种元素组成的一种化合物 M具有下列性质: 白色沉淀M 溶液褪色并产生气泡。下列说法正确的是( )A、原子半径: W>Z>Y>X . B、简单氢化物的稳定性: W>Y C、Y与X、Z、W均能形成具有漂白性的物质 D、X、Z形成的离子化合物中阴阳离子核外电子排布相同二、多选题
-
24. 某种化合物的结构式如图所示,其中W、X、Y、Z为原子序数依次增大的短周期元素,只有X、Y在同一周期,Z的单质是黄绿色气体。下列有关说法错误的是( )
 A、非金属性:X<Y B、XW4的沸点高于W2Y的沸点 C、W与Y形成的化合物中可能含有σ键、π键 D、Z2Y中所有原子最外层都满足8电子结构
A、非金属性:X<Y B、XW4的沸点高于W2Y的沸点 C、W与Y形成的化合物中可能含有σ键、π键 D、Z2Y中所有原子最外层都满足8电子结构三、非选择题
-
25. 1962年首个稀有气体化合物XePtF6问世,目前已知的稀有气体化合物中,含氙(54Xe)的最多,氪(36Kr)次之,氩(18Ar)化合物极少。[BrOF2][AsF6]•xKrF2是[BrOF2]+、[AsF6]-与KrF2分子形成的加合物,回答下列问题:(1)、As元素原子序数为33,在周期表中的位置是。As原子的价电子排布式为。与磷酸相比,最高价氧化物的水化物酸性强弱的顺序是:。(2)、Ar、Kr、Xe原子半径大小顺序为。Ar、Kr、Xe原子的活泼性依序增强,原因是。(3)、晶体熔点:KrF2XeF2(填“>”“<”或“=”),判断依据是。(4)、试猜想:[BrOF2][AsF6]•xKrF2晶体中的化学键类型有。26. 卤族元素能形成多种物质,结构和性质之间充满联系。(1)、部分卤族元素的某种性质a随核电荷数的变化趋势如图所示,则a表示正确的是。(填字母)

a.原子半径 b.氢化物的稳定性
c.单质的氧化性 d.元素的非金属性
(2)、溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为;溴原子核外电子能量最高的电子层符号是。(3)、ClF3的熔、沸点比BrF3的(填“高”或“低”),理由是。ClO2气体可处理污水中的CN- , 以下是ClO2的两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
(4)、ClO2与CN- (C是+2价)反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为。(5)、请评价上述哪一种方法制备的ClO2更适合用于饮用水的消毒。27. 新工艺采用金属氧化物催化尿素与甲醇合成碳酸二甲酯 , 副产物氨气回收重新生成尿素,有关的方程式如下:反应①:
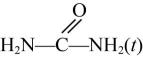 +2CH3OH(g)
+2CH3OH(g)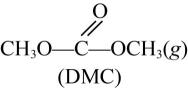 +2NH3(g)
+2NH3(g)反应②:2NH3(g)+CO2(g)
 +H2O(l)
+H2O(l)完成下列填空:
(1)、C原子核外能量最高的电子有个,比较、N、O简单离子的半径大小。(2)、下列事实能说明氮的非金属性比碳强的是(选填编号)。a.酸性: b.最高正价:氮>碳
c.沸点: d.吸引电子能力强弱:氮>碳
(3)、达到平衡时,反应①碳酸二甲酯的产率随温度T的变化关系如图所示,则反应是反应(选填“放热”或“吸热”),(选填“>”或“<”)。 (4)、某一恒温恒容装置内,与发生反应②,后,气体的密度减少 , 则内氨气的平均反应速率为。(5)、传统合成DMC的方法是以光气( , 有剧毒)和甲醇为原料,请写出相应的化学方程式。(6)、新工艺合成DMC的方法和传统方法相比,优点有(任写两点)。28. 我国嫦娥五号探测器带回1.731kg的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素A、B、C、D,原子序数依次增大,最外层电子数之和为15。B、C、D为同周期相邻元素,A为地壳中含量最多的元素。回答下列问题:(1)、元素D在周期表中的位置为 , A、C的简单离子半径大小顺序为 (填离子符号)。(2)、化合物BA的电子式为(填元素符号)。A和D形成的化合物中的化学键类型为。(3)、B和C两元素相比较,金属性较强是 (填元素符号),可以证明该结论的实验。
(4)、某一恒温恒容装置内,与发生反应②,后,气体的密度减少 , 则内氨气的平均反应速率为。(5)、传统合成DMC的方法是以光气( , 有剧毒)和甲醇为原料,请写出相应的化学方程式。(6)、新工艺合成DMC的方法和传统方法相比,优点有(任写两点)。28. 我国嫦娥五号探测器带回1.731kg的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素A、B、C、D,原子序数依次增大,最外层电子数之和为15。B、C、D为同周期相邻元素,A为地壳中含量最多的元素。回答下列问题:(1)、元素D在周期表中的位置为 , A、C的简单离子半径大小顺序为 (填离子符号)。(2)、化合物BA的电子式为(填元素符号)。A和D形成的化合物中的化学键类型为。(3)、B和C两元素相比较,金属性较强是 (填元素符号),可以证明该结论的实验。A.比较两种元素的单质与冷的浓硫酸反应的速率
B.比较两种元素最高价氧化物对应的水化物的碱性
C.将相同大小的两种元素单质分别放入沸水中,观察反应现象
D.比较相同物质的量的两种元素的单质与足量稀盐酸反应产生的多少
29. 氢是宇宙中最丰富的元素,H2有多种制法。完成下列填空:(1)、氢原子的核外电子排布轨道表示式是。三种含氢微粒:H、H+、H-的半径由大到小依次为。(2)、充填气象观测气球时,可用CaH2与H2O反应制H2 , 反应的化学方程式为。从物质结构角度解释熔点:CaH2>BaH2的原因(3)、实验室用含杂质的锌粒与稀H2SO4反应制得的H2中,含杂质PH3、AsH3和H2S,杂质气体的热稳定性由强到弱依次为 , PH3的空间构型是。(4)、水直接热解条件苛刻,人们设计了Ca-Fe-Br循环制H2。涉及反应:FeBr2(s)+H2O(g)
 Fe3O4(s)+HBr(g)+H2(g)
Fe3O4(s)+HBr(g)+H2(g)配平上述化学方程式并标出电子转移的方向和数目。
30. 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: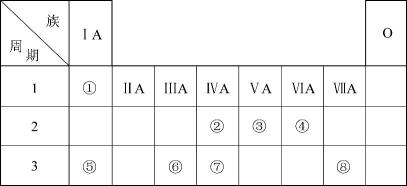 (1)、在此元素周期表的一部分中,金属性最强的元素是(填元素符号)。(2)、⑤、⑥的原子半径由大到小的顺序为(填元素符号)。(3)、⑦、⑧两种元素的氢化物稳定性较强的是 (用化学式表示)。(4)、⑤、⑧的最高价氧化物对应的水化物相互反应的离子方程式为。31. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子2p轨道上有3个电子,Z是元素周期表中电负性最大的元素,W与Y同主族。下列说法正确的是( )A、原子半径:r(W)>r(Z)>r(Y)>r(X) B、X氧化物的水化物是一定是强酸 C、Y的第一电离能比同周期相邻元素小 D、W的简单气态氢化物的稳定性比Y的强32. 光电材料在能源军事等领域有重要应用,分为无机光电材料如ZnS、ZnSe、GaAs、等,及有机光电材料(如图1所示化合物)。回答下列问题:(1)、基态Zn原子的价层电子排布图为;Ga、As、Se的第一电离能由大到小的顺序为。(2)、图1所示化合物中所含有的化学键类型有(填选项字母),N原子的杂化方式为。
(1)、在此元素周期表的一部分中,金属性最强的元素是(填元素符号)。(2)、⑤、⑥的原子半径由大到小的顺序为(填元素符号)。(3)、⑦、⑧两种元素的氢化物稳定性较强的是 (用化学式表示)。(4)、⑤、⑧的最高价氧化物对应的水化物相互反应的离子方程式为。31. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子2p轨道上有3个电子,Z是元素周期表中电负性最大的元素,W与Y同主族。下列说法正确的是( )A、原子半径:r(W)>r(Z)>r(Y)>r(X) B、X氧化物的水化物是一定是强酸 C、Y的第一电离能比同周期相邻元素小 D、W的简单气态氢化物的稳定性比Y的强32. 光电材料在能源军事等领域有重要应用,分为无机光电材料如ZnS、ZnSe、GaAs、等,及有机光电材料(如图1所示化合物)。回答下列问题:(1)、基态Zn原子的价层电子排布图为;Ga、As、Se的第一电离能由大到小的顺序为。(2)、图1所示化合物中所含有的化学键类型有(填选项字母),N原子的杂化方式为。A.共价键 B.离子键 C.配位键 D.氢键
 (3)、在水溶液中,以为电子供体,在光催化剂上可还原为CO,部分氧化物的沸点如表所示:
(3)、在水溶液中,以为电子供体,在光催化剂上可还原为CO,部分氧化物的沸点如表所示:氧化物
沸点/℃
100
-10
-78.5
①表中氧化物之间沸点差异的原因为。
②的VSEPR模型为。
③和分子中,键角更大的是。
(4)、ZnS和ZnSe晶体的立方晶胞结构相似,均可看作将金刚石晶胞(如图2)内部的碳原子用Zn代替,晶胞顶角与面心位置的碳原子被S或Se代替。①ZnS晶体中,Zn原子在S原子围成的正四面体空隙中的占用率为。
②若阿伏加德罗常数的值为 , ZnS晶体的密度为 , ZnSe晶体的密度为 , 则ZnS晶体中Zn与S原子最短距离和ZnSe晶体中Zn与Se原子最短距离之比为。
33. 镍铜合金是由60%镍、33%铜、6.5%铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能,耐腐蚀性好,耐磨性好,容易加工,无磁性,是制造电子管较好的结构材料。请回答下列问题:(1)、基态的价电子轨道表示式为。(2)、元素与的第二电离能分别为、 , 的原因是。(3)、O与形成的化合物为 , 与S形成的化合物为 , 的熔点比的(填“低”、“高”或“无法确定”)。(4)、可以形成一种离子化合物 , 若要确定该物质是晶体还是非晶体,最科学的方法是对它进行实验;其阴离子的空间构型是;加热该物质时,首先失去的是分子,原因是。(5)、甲基丙烯酸铜是一种重要的有机铜试剂,其结构为 。此有机铜试剂中,C原子的杂化类型有 , 1mol此有机铜试剂中含有键的物质的量为mol。 (6)、的化合物种类有很多,与形成的化合物的立方晶胞结构如图,已知立方晶胞的边长为 , 则与形成的化合物的密度(表示阿伏加德罗常数的值,用含a、的代数式表示)。
。此有机铜试剂中,C原子的杂化类型有 , 1mol此有机铜试剂中含有键的物质的量为mol。 (6)、的化合物种类有很多,与形成的化合物的立方晶胞结构如图,已知立方晶胞的边长为 , 则与形成的化合物的密度(表示阿伏加德罗常数的值,用含a、的代数式表示)。 34. 新型半导体材料GaN、SiC主要应用于功率半导体、射频和光电器件领域。(1)、N、Si、Ga三种元素的基态原子中,第一电离能由大到小的顺序是 , 其中未成对电子数最少原子的外围电子排布式为 , 该元素位于周期表的区。(2)、制备GaN的工艺中用到GaCl3。GaCl3分子的空间构型为 , 其中Ga的杂化方式为;GaCl3的熔点为77.9℃,GaN的熔点为1700℃,二者熔点差异的原因是。(3)、GaN的一种六方晶胞如图所示,品胞参数为anm、cnm。晶体中N原子的配位数为;晶体密度ρ=g·cm-3(设阿伏加德罗常数的值为NA , 用含a、c、NA的代数式表示)。
34. 新型半导体材料GaN、SiC主要应用于功率半导体、射频和光电器件领域。(1)、N、Si、Ga三种元素的基态原子中,第一电离能由大到小的顺序是 , 其中未成对电子数最少原子的外围电子排布式为 , 该元素位于周期表的区。(2)、制备GaN的工艺中用到GaCl3。GaCl3分子的空间构型为 , 其中Ga的杂化方式为;GaCl3的熔点为77.9℃,GaN的熔点为1700℃,二者熔点差异的原因是。(3)、GaN的一种六方晶胞如图所示,品胞参数为anm、cnm。晶体中N原子的配位数为;晶体密度ρ=g·cm-3(设阿伏加德罗常数的值为NA , 用含a、c、NA的代数式表示)。
-