高考二轮复习知识点:无机物的推断3
试卷更新日期:2023-07-29 类型:二轮复习
一、选择题
-
1. 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2 , Y、W最外层电子数相同。下列说法正确的是( )A、第一电离能:W>X>Y>Z B、简单离子的还原性:Y>X>W C、简单离子的半径:W>X>Y>Z D、氢化物水溶液的酸性:Y>W2. X、Y、Z、W是原子序数依次增大的短周期主族元素,这些元素形成的常见二元化合物或单质存在如图所示的转化关系(部分生成物已省略),其中只有乙为单质。丁是淡黄色固体。焰色反应呈黄色,已为红棕色气体,对下列说法正确的是( )
 A、简单离子半径大小:W>Y>Z>X B、丁中阴阳离子于个数比为1∶1 C、X、Y、Z三种元素可组成离子化合物 D、最简单气态氢化物的热稳定性:T>Z3. 短周期主族元素X、Y、Z、W的原子序数依次增大,Z的最外层电子数是电子层数的3倍,W和Z同主族。甲、乙、丙是上述元素的单质,丁、戊、己是由这些元素组成的二元化合物,其中由X、Y组成的化合物丁的水溶液显碱性。上述物质的转化关系如图所示。下列说法正确的是( )
A、简单离子半径大小:W>Y>Z>X B、丁中阴阳离子于个数比为1∶1 C、X、Y、Z三种元素可组成离子化合物 D、最简单气态氢化物的热稳定性:T>Z3. 短周期主族元素X、Y、Z、W的原子序数依次增大,Z的最外层电子数是电子层数的3倍,W和Z同主族。甲、乙、丙是上述元素的单质,丁、戊、己是由这些元素组成的二元化合物,其中由X、Y组成的化合物丁的水溶液显碱性。上述物质的转化关系如图所示。下列说法正确的是( ) A、原子半径大小为W>Z>Y>X B、X和Z两种元素形成的化合物中可能含有非极性共价键 C、二元化合物沸点大小为戊>己>丁 D、四种元素组成的化合物一定能促进水的电离4. X、Y、Z、W是原子序数依次增大的短周期元素。Z是短周期中金属性最强的元素,M是Y元素的单质,甲、乙、丙、丁、戊是由这些元素组成的二元化合物,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,戊是具有漂白性的无色气体。上述物质间的转化关系如图所示,下列说法中正确的是( )
A、原子半径大小为W>Z>Y>X B、X和Z两种元素形成的化合物中可能含有非极性共价键 C、二元化合物沸点大小为戊>己>丁 D、四种元素组成的化合物一定能促进水的电离4. X、Y、Z、W是原子序数依次增大的短周期元素。Z是短周期中金属性最强的元素,M是Y元素的单质,甲、乙、丙、丁、戊是由这些元素组成的二元化合物,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,戊是具有漂白性的无色气体。上述物质间的转化关系如图所示,下列说法中正确的是( ) A、甲的水溶液显中性 B、化合物乙也具有漂白性,且漂白原理和戊相同 C、Z分别与X、Y、W形成的化合物中,各元素原子均满足最外层8电子结构 D、丁的稳定性和沸点均比丙高5. 合成氨及其相关工业中,部分物质间的转化关系如图所示,下列说法错误的是( )
A、甲的水溶液显中性 B、化合物乙也具有漂白性,且漂白原理和戊相同 C、Z分别与X、Y、W形成的化合物中,各元素原子均满足最外层8电子结构 D、丁的稳定性和沸点均比丙高5. 合成氨及其相关工业中,部分物质间的转化关系如图所示,下列说法错误的是( ) A、I、Ⅱ、III和IV都属于氧化还原反应 B、I、Ⅱ、III和IV都是氮的固定 C、反应Ⅵ的部分产物可在流程中循环利用 D、反应Ⅴ的化学方程式为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl6. 下列各组物质中,满足下图物质一步转化关系的选项是( )
A、I、Ⅱ、III和IV都属于氧化还原反应 B、I、Ⅱ、III和IV都是氮的固定 C、反应Ⅵ的部分产物可在流程中循环利用 D、反应Ⅴ的化学方程式为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl6. 下列各组物质中,满足下图物质一步转化关系的选项是( )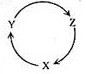
选项
X
Y
Z
A
Na
NaOH
NaHCO3
B
Cu
CuSO4
Cu(OH)2
C
C
CO
CO2
D
Si
SiO2
H2SiO3
A、A B、B C、C D、D7. 下列物质的转化在给定条件下能实现的是( )①
②
③
④
A、①③ B、①④ C、②③ D、②④8. 科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2 HCOONa+H2O下列有关说法正确的是( )
A、储氢、释氢过程均无能量变化 B、NaHCO3、HCOONa均含有离子键和共价键 C、储氢过程中,NaHCO3被氧化 D、释氢过程中,每消耗0.1molH2O放出2.24L的H29. 一种化合物Y2ZW3X可用作牙膏的添加剂,W、X、Y、Z为原子序数依次增大的短周期主族元素,其中Z的最高价氧化物的水化物是三元酸,Y的原子半径是短周期主族元素中最大的,W与X的最外层电子数之和为13。下列说法错误的是( )A、简单氢化物的沸点:W>X B、离子半径:Y>W>X C、Z的最高价氧化物可用作干燥剂 D、Y与X形成的化合物的水溶液呈碱性10. 下列叙述正确的是( )A、常温下,相同浓度的溶液碱性比较: B、常温下,往 溶液中滴加稀盐酸至中性时,溶质的主要成分有 、 C、加热 溶液至蒸干,可得到纯净的 固体 D、常温下,若 溶液中含有 可用 溶液鉴别11. 在 溶液中通入 气体,未见到沉淀。若再通入或加入下列物质中的一种,则可以看到沉淀,则该物质不可能为( )A、 B、 C、 D、二、多选题
-
12. 根据下列实验操作和现象所得到的实验结论正确的是( )
选项
实验操作和现象
实验结论
A
将废铁屑溶于过量盐酸,滴入KSCN溶液,未见溶液变为红色
而该废铁屑中不含Fe(III)
B
向Na2SO3溶液中先加入少量Ba(NO3)2溶液,生成白色沉淀,过滤、洗涤,然后再向沉淀中加入稀盐酸,沉淀不溶解
Na2SO3溶液已经变质
C
向CuSO4溶液中加入KI溶液,再加入苯,振荡,上层呈紫红色,下层有白色沉淀生成
Cu2+可以氧化I- , 白色沉淀可能为CuI
D
向盛有Ag2O固体的两支试管中分别加入稀硝酸和氨水,Ag2O均溶解
Ag2O是两性氧化物
A、A B、B C、C D、D13. 利用镍铂靶材废料(主要成分为Ni、Pt以及微量Fe、Al的单质)回收铂的一种工艺流程如下。
已知:①“沉铂”时发生的反应为[ PtCl6]2- +2 = (NH4)2PtCl6↓。
②隔绝空气“煅烧”时有两种单质生成,其中一种是 N2。
下列说法正确的是( )
A、“酸浸”时应在较高温度下进行 B、滤液②可返回“酸浸”工序循环利用 C、“溶解”时发生的离子反应为3Pt+ 16H++4+18Cl-= 3[ PtCl6]2- +4NO↑+8H2O D、隔绝空气“煅烧”时每生成117.0g Pt,理论上产生标准状况下13.44 L N214. 根据下列框图分析,下列说法正确的是( ) A、E2+的氧化性比M2+的氧化性强 B、在③反应中若不加稀硫酸可能看到红褐色沉淀 C、反应④的离子方程式可表示为:E3++3SCN﹣═E(SCN)3↓ D、在反应①中只用浓硫酸,既表现了酸性,又表现了氧化性
A、E2+的氧化性比M2+的氧化性强 B、在③反应中若不加稀硫酸可能看到红褐色沉淀 C、反应④的离子方程式可表示为:E3++3SCN﹣═E(SCN)3↓ D、在反应①中只用浓硫酸,既表现了酸性,又表现了氧化性三、非选择题
-
15.(1)、Ⅰ.化合物Ⅹ由四种短周期元素组成,加热X,可产生使湿润的红色石蕊试纸变蓝的气体Y,Y为纯净物;取 ,用含 的盐酸完全溶解得溶液A,将溶液A分成 和 两等份,完成如下实验(白色沉淀C可溶于 溶液):

请回答:
组成X的四种元素是N、H和(填元素符号),X的化学式是。
(2)、溶液B通入过量 得到白色沉淀C的离子方程式是。(3)、写出一个化合反应(用化学方程式或离子方程式表示)。要求同时满足:①其中一种反应物的组成元素必须是X中除N、H外的两种元素;
②反应原理与“ ”相同。
(4)、Ⅱ.某兴趣小组为验证浓硫酸的性质进行实验,如图。实验中观察到的现象有:锥形瓶内有白雾,烧杯中出现白色沉淀。请回答:
将浓硫酸和浓盐酸混合可产生 气体的原因是。
(5)、烧杯中出现白色沉淀的原因是。16. 某废铁铬催化剂(含Fe3O4、Cr2O3、MgO、Al2O3及少量不溶性杂质)回收铁、铬的工艺流程如下图所示:
已知:i.0.1mol·L-1金属离子形成氢氧化物沉淀与氢氧化物沉淀溶解的pH范围如下:
金属离子
Fe3+
Al3+
Cr3+
Fe2+
Mg2+
开始沉淀的pH
1.5
4.0
4.6
7.6
9.5
沉淀完全的pH
2.8
5.2
6.8
9.7
11.1
金属氢氧化物
Al(OH)3
Cr(OH)3
开始溶解的pH
7.8
12
溶解完全的pH
10.8
>14
ii.Cr(OH)3+OH-=+2H2O
iii.已知Cr的金属性强于Fe
(1)、加入铁粉后,调节pH的范围为。(2)、由滤渣1得到滤液3发生反应的离子方程式为。(3)、滤渣3成分的化学式为;回收铬时,铬的存在形式为(填化学式)。(4)、由滤液2得到结晶水合物的操作是、过滤、洗涤、干燥。(5)、滤渣2与FeS2混合后隔绝空气焙烧,总反应的化学方程式为;该过程加入少量CaO的目的是。(6)、酸浸过程中,在硫酸用量一定的情况下,随着酸浓度的增加,铁、铬的溶解度增大。实际生产中,硫酸的质量分数为50%,其原因是。(已知,Fe2(SO4)3▪ 9H2O,Cr2(SO4)3·18H2O在20℃时的溶解度分别为400g和64g)17. 磷精矿主要成分为 , 含少量、、、 , 其中代表稀土元素。从磷精矿分离稀土元素的工业流程如下. (1)、属于IIIB族,其中的基态原子核外电子排布式为。(2)、“酸浸”过程与反应的化学方程式如下,请补充完整。(3)、“萃取”的目的是富集 , 但其余元素也会按一定比例进入萃取剂中。
(1)、属于IIIB族,其中的基态原子核外电子排布式为。(2)、“酸浸”过程与反应的化学方程式如下,请补充完整。(3)、“萃取”的目的是富集 , 但其余元素也会按一定比例进入萃取剂中。①通过制得有机磷萃取剂 , 其中代表烃基,对产率的影响如下表。
产率/
82
62
20
由表可知,随着碳原子数增加,烃基(填“推电子”或“吸电子”)能力增强,键更难断裂,产率降低。
(4)、“萃取”过程使用的萃取剂的结构如图;与配位的能力:1号O原子2号O原子(填“”“”或“”)。 (5)、“反萃取”的目的是分离和元素.向“萃取液”中通入 , 、、的沉淀率随变化如图.
(5)、“反萃取”的目的是分离和元素.向“萃取液”中通入 , 、、的沉淀率随变化如图.
①试剂X为(填“”或“”),应调节为。
②通入得到沉淀的过程为:
i.
ii.(写出该过程的化学方程式)
③若萃取剂改用三丁基氧化膦会导致“反萃取”产率降低,其原因为。
(6)、若略去“净化”过程,则制得的草酸稀土会混有杂质(填化学式)。(7)、在整个工艺中,可从副产物中提取(填名称),用于生产氮肥。18. 工业以软锰矿(主要成分是 , 含有、等少量杂质)为主要原料制备高性能的磁性材料碳酸锰()。其工业流程如下: (1)、浸锰过程中与反应的离子方程式为 , 该反应是经历以下两步反应实现的。
(1)、浸锰过程中与反应的离子方程式为 , 该反应是经历以下两步反应实现的。i.
ii.……
写出ii的离子方程式:。
(2)、氧化过程中被氧化的物质主要有(写化学式):。(3)、“浸锰”反应中往往有副产物生成,温度对“浸锰”反应的影响如图所示:
为减少的生成,“浸锰”的适宜温度是 , 向过滤II所得的滤液中加入溶液时温度不宜太高的原因是。
(4)、加入溶液后,生成沉淀,同时还有气体生成,写出反应的离子方程式:。(5)、滴定法测产品纯度I.取固体产品1.160g于烧杯中,加入过量稀充分振荡,再加入NaOH溶液至碱性,发生反应:;
II.加入过量KI溶液和适量稀 , 沉淀溶解,溶液变黄;
III.取上述混合液的于锥形瓶中,加入淀粉溶液作指示剂,用0.1000mol/L 溶液进行滴定,发生反应: , 滴定终点时消耗溶液20.00mL。
①写出II中反应的离子方程式;
②判断滴定终点的方法是;
③假设杂质不参与反应,则产品纯度为。(保留四位有效数字)
19. 氧化钪可提高计算机记忆元件性能,利用钪精矿为原料(主要成分为 , 还含有、等杂质)生产氧化钪的一种工艺流程如下:
已知:钪与铝类似,其氢氧化物具有两性;是钪元素的萃取剂,萃取发生的反应为。
(1)、加入氨水调节 , 过滤,滤渣主要成分是。(2)、上述洗脱剂X最好选择(选填“酸性”、“碱性”或“中性”)溶液。(3)、过程中生成的离子方程式。(4)、“沉钪”前先加入稀盐酸调节溶液至酸性,然后用草酸“沉钪”。25℃时的草酸溶液中。(25℃时,草酸电离平衡常数为 , )。(5)、“沉钪”后所得到的草酸钪晶体的化学式为 , 灼烧发生分解反应的化学方程式为 , 写出固体产物溶于溶液的离子方程式。20. 镍、钴元素在锂电池材料和国防工业方面应用广泛。一种利用酸浸出法从冶金厂废炉渣(含Ni、Co及少量Cu、Mg、Ca的化合物)中提取镍和钴的工艺流程如图:
已知:i.Ksp(CaF2)=1.0×10-10 , Ksp(MgF2)=7.5×10-11;
ii.NiSO4在水中的溶解度随温度升高明显增大,不溶于乙醇和苯。
回答下列问题:
(1)、“酸浸渣”主要成分的名称为。(2)、基态Co原子的核外M层电子排布式为。Co的核电荷数比Ni小1,但Co的相对原子质量比却Ni的略大,原因是。(3)、“除铁”的离子方程式为。(4)、“除钙镁”时,pH不宜过低的原因是。Ca2+和Mg2+沉淀完全。时,溶液中c(F-)最小为mol·L-1(5)、“萃取”原理为Co2+(aq)+2HA(有机相)⇌Co(A)2(有机相)+2H+(aq)。“反萃取”时为促进Co2+的转移,应选择的实验条件或采取的实验操作有①;②多次萃取。(6)、获得NiSO4(s)的“一系列操作”中洗涤产品可选用(填字母标号)试剂。a.冷水 b.乙醇 c.苯
21. 高铁酸钾是一种紫黑色固体,在碱性、低温条件下较稳定,在中性或酸性溶液中易发生反应,能释放大量的氧气,同时自身被还原产生一种絮凝剂,因此成为一种集氧化、吸附、杀菌、脱色、除臭为一体的高效绿色水处理剂。I.制备
 (1)、写出高铁酸钾溶于水中发生反应的离子方程式。(2)、①中合成的离子方程式是。(3)、①中合成时,相同时间内产率受温度影响记录如图,产率曲线产生如图变化的可能原因是。
(1)、写出高铁酸钾溶于水中发生反应的离子方程式。(2)、①中合成的离子方程式是。(3)、①中合成时,相同时间内产率受温度影响记录如图,产率曲线产生如图变化的可能原因是。 (4)、操作②的目的是。(5)、已知高铁酸根在苛性钠溶液中的溶解度大于在苛性钾溶液中,则步骤⑤、⑥选择的试剂分别可能是____。A、饱和溶液、一定浓度的溶液 B、一定浓度的溶液、饱和溶液 C、饱和溶液、饱和溶液 D、一定浓度的溶液、饱和溶液(6)、II.产品纯度测定,可采用亚铬酸盐滴定法,滴定时有关反应的离子方程式为:
(4)、操作②的目的是。(5)、已知高铁酸根在苛性钠溶液中的溶解度大于在苛性钾溶液中,则步骤⑤、⑥选择的试剂分别可能是____。A、饱和溶液、一定浓度的溶液 B、一定浓度的溶液、饱和溶液 C、饱和溶液、饱和溶液 D、一定浓度的溶液、饱和溶液(6)、II.产品纯度测定,可采用亚铬酸盐滴定法,滴定时有关反应的离子方程式为:①
②
③
写出基态的价电子排布式。
(7)、现称取(摩尔质量为)粗产品溶于过量的碱性亚铬酸盐溶液中,充分反应后过滤,滤液在容量瓶中定容。每次取于锥形瓶中加入稀硫酸酸化,用标准溶液滴定至终点,消耗标准溶液。该粗产品中的质量分数为(用含a、c、V、M的代数式表示)。若滴定管只用蒸馏水洗涤而未用标准液润洗,则测得的结果(填“偏高”偏低”或“无影响”)。22. 蛇纹石矿的主要成分为MgO、SiO2、 CaO、 Fe2O3、 Al2O3、 NiO、FeS等,一种综合利用蛇纹石矿回收镁资源的工艺流程如下:
已知:
①当溶液中被沉淀离子的物质的量浓度小于1 × 10-5mol/L时,认为该离子沉淀完全。
②Ksp(NiS)=1 × 10-21 , 氢硫酸的两步电离常数分别为Ka1=1.4× 10-7 , Ka2=7.1×10-15。
(1)、“加压酸浸”中,要控制温度在110℃左右,但反应时几乎无需加热,原因是。 滤渣1的主要成分除S、CaSO4外还有 。(2)、“氧化”中空气的作用是 , NaClO3发生反应的离子方程式为。(3)、“ 除铁”中滤渣2为难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6],同时生成一种无色气体为 , Na2CO3溶液需缓慢加入,原因是。(4)、“沉镍”中,当Ni2+恰好完全沉淀时,若溶液中c(H2S)=1 ×10-3mol/L,则此时溶液的pH约为。23. 以钛铁矿(主要成分为FeO·TiO2 , 还含有MgO、CaO、SiO2等杂质)为原料合成锂离子电池的电极材料钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)的工艺流程如下:
回答下列问题:
(1)、“溶浸”后溶液中的滤渣主要为(填化学式)。“滤液”中TiOCl+经加热水解后转化为富钛渣(钛元素主要以TiO2·2H2O形式存在)。写出上述转变的化学方程式:。(2)、“溶钛”过程反应温度不能太高,其原因是。(3)、“沉铁”步骤反应的化学方程式为 , “沉铁”后的滤液经处理后可返回工序循环利用。(4)、“煅烧”制备LiFePO4过程中,Li2CO3和H2C2O4的理论投入量的物质的量之比为。(5)、从废旧LiFePO4电极中可回收锂元素。用硝酸充分溶浸废旧LiFePO4电极,测得浸取液中c(Li+)=4mol·L-1 , 加入等体积的碳酸钠溶液将Li+转化为Li2CO3沉淀,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中的浓度为mol·L-1[已知Ksp(Li2CO3)=2.8×10-3 , 假设反应后溶液体积为反应前两溶液之和。24. 钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。工业上利用固体废料“赤泥”(含FeO、Fe2O3、SiO2、Sc2O3、TiO2等)回收Sc2O3的工艺流程如图。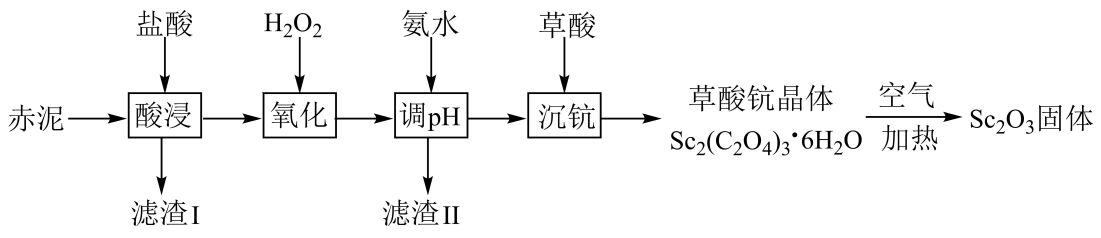
已知:TiO2难溶于盐酸;Ksp[Fe(OH)3]=1.0×10-38。
回答下列问题:
(1)、为提高“酸浸”速率,对“赤泥”的处理方式为;滤渣I的主要成分是(填化学式)。(2)、“氧化”时加入足量H2O2的目的是;氧化后溶液中Fe3+浓度为0.001mol•L-1 , 常温下“调pH”时,若控制pH=3,则Fe3+的去除率为(忽略调pH前后溶液的体积变化)。(3)、已知25℃时,Kh1(C2O)=a,Kh2(C2O)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4Sc2(C2O4)3↓+6H+ , 该反应的平衡常数K=(用含a、b、c的代数式表示)。(4)、Sc2(C2O4)3·6H2O在空气中加热分解时,随温度变化如图所示。已知:M[Sc2(C2O4)3·6H2O]=462g·mol-1。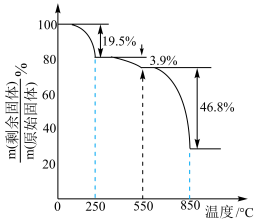
250℃时固体的主要成分是(填化学式);550~850℃时反应的化学方程式为。
25. 某废旧锂离子电池的正极材料成分为和 , 下图为从其中回收钴、镍的工艺流程。
回答下列问题:
(1)、中的元素为价,和个数比为 , 则元素化合价为。(2)、“碱浸过滤”所得滤液的主要成分为。(3)、“还原焙烧”过程发生反应的化学方程式为。(4)、“碳化水浸”过程中反应为: , 该反应的标准吉布斯自由能和标准生成焓随温度变化如图。该过程需要控制在(填“a”、“b”或c)进行,其原因是。a. b. c.
 (5)、常温下,为寻找“碳化水浸”的最佳 , 将固体加入水中,通入使固体逐步溶解,当固体恰好完全溶解时, , 则溶液中的为(保留两位有效数字,忽略体积变化)。
(5)、常温下,为寻找“碳化水浸”的最佳 , 将固体加入水中,通入使固体逐步溶解,当固体恰好完全溶解时, , 则溶液中的为(保留两位有效数字,忽略体积变化)。已知: , ,
(6)、“萃取”的原理是(M表金属离子,代表萃取剂,则反萃取时加入的试剂为。26. 从废脱硝催化剂(主要成分为、)中回收和 , 具有重要意义。(1)、碳氯化—氧化法提取。将粉碎后的催化剂渣料与过量焦炭混合投入高温氯化炉充分反应,将生成的与其他气体分离,并将其氧化得。该过程主要涉及以下反应:反应I
反应Ⅱ
已知常压下的沸点为136.4℃,C的燃烧热为 , CO的燃烧热为。
①反应I的。
②从反应I的混合体系中分离出的措施是。
③氯化炉中生成CO比生成更有利于转化为 , 其原因是。
(2)、碱溶法回收和 , 部分工艺流程如下:
“酸洗”时,转化为或“水解”后得到。
①写出“热碱浸取”时发生反应的离子方程式:。
②锐钛型和金红石型是最常见的两种晶体类型,煅烧过程中,会发生“锐钛型→金红石型”转化,固体质量残留率和晶型转化率随温度变化如图1所示,晶型转化过程中的能量变化如图2所示。设计用“过滤”所得制备金红石型的操作方案: , 金红石型的晶胞结构如图3所示。用“○”圈出所有位于晶胞体内的原子。

③为测定回收所得样品的纯度,进行如下实验:称取2.000g样品,用稀硫酸溶解、定容得100mL 溶液。量取20.00mL溶液放入锥形瓶中,加入10.00mL 0.5000 溶液(过量),再用0.01000 标准溶液液定至终点,消耗标准溶液24.00mL。滴定过程中发生如下反应(均未配平):;
计算样品的纯度(写出计算过程)。
27. 一种利用废脱硝催化剂(含、、等成分)提取钛、钒的工艺流程如下图所示。
已知:①钛酸钠难溶于水;
②溶液的酸性较强时,价钒主要以的形式存在;
③溶液中某离子浓度 , 认为该离子沉淀完全。
回答下列问题:
(1)、上述流程中,发生的氧化还原反应有个。(2)、“高温碱浸”中生成钛酸钠的离子方程式是。(3)、将氢氧化钙加入钨酸钠溶液中可得到钨酸钙,已知 , , 当溶液中沉淀完全时,溶液中最大值为。(4)、“沉钒”过程中,一般要加入过量 , 其原因是。(5)、沉钒过程中,沉钒率随溶液pH的变化如图所示。沉钒率随溶液pH的增加先升高后降低的原因可能是。 (6)、取固体加热时,固体减少的质量随温度的变化曲线如图所示。加热到200℃时,产生气体的分子式为。
(6)、取固体加热时,固体减少的质量随温度的变化曲线如图所示。加热到200℃时,产生气体的分子式为。 28. 铟被广泛应用于电子工业、航空航天、太阳能电池新材料等高科技领域。从铜烟灰氧压酸浸渣(主要含、、、S、、)中提取铟的工艺如图所示。已知:为强电解质;为磷酸二异辛酯。
28. 铟被广泛应用于电子工业、航空航天、太阳能电池新材料等高科技领域。从铜烟灰氧压酸浸渣(主要含、、、S、、)中提取铟的工艺如图所示。已知:为强电解质;为磷酸二异辛酯。
回答下列问题:
(1)、写出元素周期表前20号元素中,与铟化学性质相似的金属元素的符号。(2)、“硫酸化焙烧”后金属元素均以硫酸盐的形式存在。在其他条件一定时,测得焙烧温度对“水浸”时铟、铁浸出率的影响如图所示,则适宜的焙烧温度是℃,温度过高铟、铁浸出率降低的原因可能是。 (3)、“水浸”时,浸渣除了外,还含有。(4)、“还原铁”时反应的离子方程式为。(5)、“萃取除铁”时,用30%的作萃取剂时,发现当溶液后,铟萃取率随pH值的升高而下降,原因是。(6)、“置换铟”时,发现会有少量的气体生成,的电子式为 , 生成的离子方程式为。(7)、整个工艺流程中,可循环利用的溶液是。29. 工业上用电解溶液生成的氯气为原料,生产溴酸钾的工艺流程如下:
(3)、“水浸”时,浸渣除了外,还含有。(4)、“还原铁”时反应的离子方程式为。(5)、“萃取除铁”时,用30%的作萃取剂时,发现当溶液后,铟萃取率随pH值的升高而下降,原因是。(6)、“置换铟”时,发现会有少量的气体生成,的电子式为 , 生成的离子方程式为。(7)、整个工艺流程中,可循环利用的溶液是。29. 工业上用电解溶液生成的氯气为原料,生产溴酸钾的工艺流程如下:
回答下列问题:
(1)、惰性电极电解溶液产生氯气总反应的离子方程式为。(2)、“合成I”中得到 , 该反应的还原剂是;“合成II”中加入的目的是。(3)、结合溶解度曲线分析,“合成Ⅲ”为复分解反应,该反应能发生的原因是;若向溶液中加入粉末,可使溶液中的降为[假设溶液体积不变,已知该温度下]。“合成III”实际中用饱和溶液而不用粉末的优点是(写一条)。(4)、为了从过滤II后的滤液中获得氯化镁结晶,依次要经过、操作。(5)、另一种产生溴酸盐的方法是用溶液吸收 , 同时生成气体。写出相应的化学方程式;原子经济性更高的是(填“吸收法”或“氯气氧化法”)。 30. 硼化钛(结构式为B=Ti=B)常用于制备导电陶瓷材料和PTC材料。工业上以高钛渣(主要成分为、、和CaO,另有少量MgO、)为原料制取的流程如下:
30. 硼化钛(结构式为B=Ti=B)常用于制备导电陶瓷材料和PTC材料。工业上以高钛渣(主要成分为、、和CaO,另有少量MgO、)为原料制取的流程如下:
已知:①电弧炉是由石墨电极和石墨坩埚组成的高温加热装置;
②高温下蒸气压大、易挥发;
③可溶于热的浓硫酸形成。
回答下列问题:
(1)、滤渣的主要成分为(填化学式)。(2)、“水解”需在沸水中进行,离子方程式为 , 该工艺中,经处理可循环利用的物质为(填化学式)。(3)、“热还原”中发生反应的化学方程式为 , 的实际用量超过了理论化学计量所要求的用量,原因是。仅增大配料中的用量,产品中的杂质含量变化如图所示。杂质TiC含量随w%增大而降低的原因是(用化学方程式解释)。 (4)、原料中的可由硼酸脱水制得。以为原料,用电渗析法制备硼酸()的工作原理如图所示,产品室中发生反应的离子方程式为。若反应前后NaOH溶液的质量变化为m kg,则制得的质量为kg。
(4)、原料中的可由硼酸脱水制得。以为原料,用电渗析法制备硼酸()的工作原理如图所示,产品室中发生反应的离子方程式为。若反应前后NaOH溶液的质量变化为m kg,则制得的质量为kg。 31. 铋及其化合物广泛应用于电子材料、医药等领域。一种以含铋烧渣(主要成分为、 , 还含有少量MnS、、CuO及等)制取并回收锰的工艺流程如下:
31. 铋及其化合物广泛应用于电子材料、医药等领域。一种以含铋烧渣(主要成分为、 , 还含有少量MnS、、CuO及等)制取并回收锰的工艺流程如下: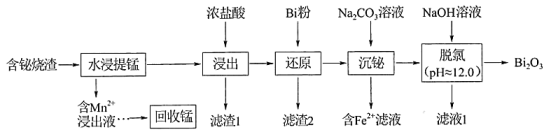
已知:①氧化性:;
②易水解成BiOCl沉淀;常温下,BiOCl存在的pH范围约为2.0~11.0;
③常温下,;。
回答下列问题:
(1)、基态锰原子的价电子排布式为。(2)、“水浸提锰”时,另加入少量稀硫酸可促进(填化学式)溶解,进一步提高锰的浸取率。(3)、“滤渣2”的主要成分有(填化学式)、Bi。(4)、常温下,“含滤液”中的浓度为。为保证BiOCl产品的纯度,理论上,“沉铋”时应控制溶液的pH<(保留一位小数)。(5)、“脱氯”过程中发生主要反应的离子方程式为。(6)、BiOCl是一种性能优良的光催化剂,可催化降解有机污染物对硝基苯酚(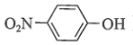 )等。对硝基苯酚的熔点高于邻硝基苯酚(
)等。对硝基苯酚的熔点高于邻硝基苯酚(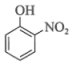 )的熔点,其原因是。 (7)、我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展。硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为a pm,a pm,b pm。
)的熔点,其原因是。 (7)、我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展。硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为a pm,a pm,b pm。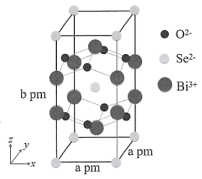
①该晶胞沿z轴方向的投影图为(填标号)。
A.
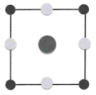 B.
B. C.
C. D.
D.
②该晶体中,每个周围紧邻的共有个。
③该晶体的密度为(列出计算式,为阿伏加德罗常数的值)。
32. 一种利用黄铁矿烧渣和硫酸铵废液制备铵铁蓝颜料的工艺如下: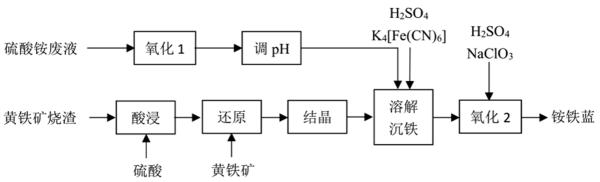
已知:黄铁矿的主要成分是FeS2;铵铁蓝的化学式为 , 难溶于水。
(1)、高纯度硫酸铵溶液能够提高铵铁蓝的品质,为除去硫酸铵废液中的Fe2+和Fe3+ , “氧化1”工序使用酸化的H2O2作为氧化剂,写出反应的离子方程式 , “调pH”工序应加入(写出一种物质的化学式)。(2)、黄铁矿在空气中焙烧得到黄铁矿烧渣,其主要成分是(写化学式)。(3)、“还原”工序获得FeSO4溶液,则“结晶”工序的操作方法是。(4)、“沉铁”工序产生的白色沉淀中Fe的化合价为 , “氧化”工序发生反应的离子方程式为。33. 镍是重要的战略金属资源,一种从某高镁低品位铜镍矿(主要成分为CuFeS2、FeS2、3NiO●4SiO2●H2O、3MgO●4SiO2●H2O等)中回收Cu、Ni的工艺流程如图所示: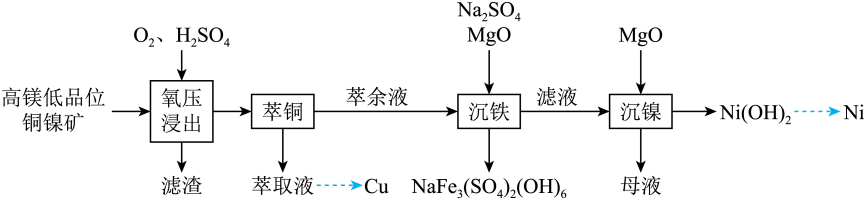
回答下列问题:
(1)、 中,元素的化合价为。(2)、为提高“氧压浸出”的速率,可行的操作有(任填一个)。(3)、“氧压浸出”的滤渣有S和 , 该环节中发生的化学反应方程式为。(4)、“萃铜”时的反应为:(有机相)(水相)(有机相)(水相),下列说法正确的有_______。A、向萃取液中加入稀硫酸进行“反萃取”,可得到单质 B、萃余液中的阳离子为: C、一定条件下,萃取平衡时, , 则的萃取率为80% D、为提高的萃取率,可适当提高溶液(5)、已知 , “滤液”中 , “沉镍”时,控制为8.50,此时的沉淀率为 , “沉镍”后的母液,含有的主要溶质为(填化学式)。