高考二轮复习知识点:无机物的推断1
试卷更新日期:2023-07-29 类型:二轮复习
一、选择题
-
1. 钼酸钠是一种白色结晶性粉末,广泛应用于颜料和化工等领域。工业上用钼精矿(主要成分是 , 含少量的)制备钼酸钠晶体()的简化流程如图所示。下列说法错误的是
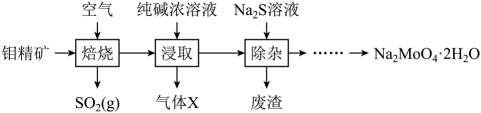
已知:浸取液溶质主要为和。
A、焙烧时发生反应 B、气体X为 , 废渣的主要成分为 C、从滤液中获得的操作为蒸发结晶 D、利用纯碱吸收 , 可获得副产品亚硫酸钠2. 短周期主族元素R、X、Y、Z原子序数依次递增,它们中的两种元素可组成化合物甲,另外两种元素可组成化合物乙。常温下,甲为液态,乙为固态。甲+乙→白色沉淀+气体(臭鸡蛋气味),Y原子的电子层数等于最外层电子数。下列说法正确的是A、原子半径Z > Y > X > R B、气态氢化物的热稳定性:X > Z C、R、X、Z只能组成一种共价化合物 D、工业上,电解熔融的氯化物制备Y的单质3. 有一包固体粉末,由NaOH、Na2SO3、MgCl2、CaCO3、Ba( NO3)2、FeSO4中的几种组成,取少量样品进行如下实验:①将样品加入水中,得到白色不溶物a和无色溶液
②向①中加入足量稀盐酸,产生气体,仍存在不溶物
该固体粉末一定含有的是
A、CaCO3、Ba( NO3)2 B、CaCO3、Na2SO3 C、Na2SO3、Ba( NO3)2 D、CaCO3、Na2SO3、Ba( NO3)24. 从菱锰矿(主要成分为 , M为、或)提取的转化关系如下:菱锰矿, , 已知 , 关系如图。下列说法错误的是
 A、“焙烧”过程最大的是 B、“焙烧”过程最大的是 C、“焙烧”温度应控制在 D、“操作X”为加热5. 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室中以废铜屑为原料,制取碱式碳酸铜的流程如下。下列说法错误的是
A、“焙烧”过程最大的是 B、“焙烧”过程最大的是 C、“焙烧”温度应控制在 D、“操作X”为加热5. 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室中以废铜屑为原料,制取碱式碳酸铜的流程如下。下列说法错误的是 A、“加热”步骤可选用水浴加热 B、“酸浸”产生的气体可用NaOH溶液吸收 C、“滤液”中溶质的主要成分为 D、可用盐酸和溶液检验“滤液”中是否有6. 为平面结构,可以作为和CO反应制备的催化剂,反应历程如下图所示,下列说法错误的是
A、“加热”步骤可选用水浴加热 B、“酸浸”产生的气体可用NaOH溶液吸收 C、“滤液”中溶质的主要成分为 D、可用盐酸和溶液检验“滤液”中是否有6. 为平面结构,可以作为和CO反应制备的催化剂,反应历程如下图所示,下列说法错误的是 A、A离子中Rh原子的杂化轨道类型为 B、反应的总方程式为 C、化合物E生成的过程为取代反应 D、和CO反应制备的反应历程有2种7. 中国是世界上最大的钨储藏国。以黑钨精矿(主要成分为、 , 含少量)为原料冶炼钨的流程如图所示:
A、A离子中Rh原子的杂化轨道类型为 B、反应的总方程式为 C、化合物E生成的过程为取代反应 D、和CO反应制备的反应历程有2种7. 中国是世界上最大的钨储藏国。以黑钨精矿(主要成分为、 , 含少量)为原料冶炼钨的流程如图所示:
已知:钨酸酸性很弱,难溶于水。25℃时,和开始沉淀的pH分别为10.3和7.3,完全沉淀的pH分别为8和5。下列说法错误的是
A、位于元素周期表第六周期 B、“系列操作”步骤仅涉及物理变化 C、流程中“调pH”范围为8~10.3 D、参与反应的化学方程式为8. 实验室以工业废渣(主要含CaSO4•2H2O,还含少量SiO2)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如图。下列说法正确的是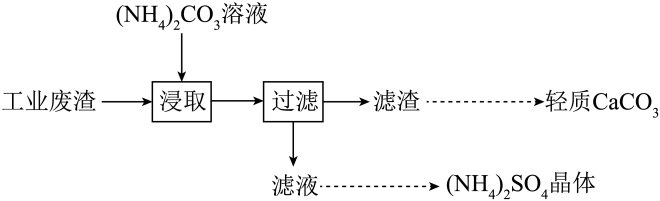 A、为提高浸取效率,浸取时需在高温下进行 B、浸取时,需向(NH4)2CO3溶液中加入适量浓氨水,抑制水解 C、滤渣经洗涤和干燥后得纯净的轻质CaCO3 D、对滤液进行蒸发浓缩、冷却结晶可得到纯净的(NH4)2SO4晶体9. 部分含氯物质的分类与相应化合价关系如图,c、d、f均为钠盐,下列叙述正确的是( )
A、为提高浸取效率,浸取时需在高温下进行 B、浸取时,需向(NH4)2CO3溶液中加入适量浓氨水,抑制水解 C、滤渣经洗涤和干燥后得纯净的轻质CaCO3 D、对滤液进行蒸发浓缩、冷却结晶可得到纯净的(NH4)2SO4晶体9. 部分含氯物质的分类与相应化合价关系如图,c、d、f均为钠盐,下列叙述正确的是( ) A、b在化学反应中只能被氧化 B、电解饱和c溶液可得到钠单质 C、a→d→e的转化可以通过一步反应实现 D、f的阴离子空间构型为正四面体10. 某白色固体样品,可能含有、、、、中的一种或几种。对该样品进行如下实验:
A、b在化学反应中只能被氧化 B、电解饱和c溶液可得到钠单质 C、a→d→e的转化可以通过一步反应实现 D、f的阴离子空间构型为正四面体10. 某白色固体样品,可能含有、、、、中的一种或几种。对该样品进行如下实验:①取少量固体加入足量水中,固体部分溶解;
②取①中滤液做焰色试验,透过蓝色钴玻璃未观察到紫色;
③取①中滤渣,向其中加入足量的盐酸,产生气泡,固体部分溶解.
下列说法错误的是
A、固体粉末中一定不含 B、固体粉末中一定含有和 C、取①中滤液,加入硝酸酸化的溶液,若未产生白色沉淀,则样品中无 D、为进一步确定原样品组成,可以向③未溶解的固体中加入溶液11. 由含硒废料(主要含S、Se、、CuO、ZnO、等)在实验室中制取硒的流程如图:
下列说法错误的是
A、“分离”时得到含硫煤油的方法是分液 B、“酸溶”操作的目的是除去废料中的金属氧化物 C、“浸取”后的分离操作所用玻璃仪器为烧杯、漏斗、玻璃棒 D、“酸化”时发生反应的离子方程式:12. 甲、乙、丙、丁四种物质之间的转化关系如图所示,则下列选项错误的是
选项
甲
乙
A
B
C
溶液
D
溶液
稀盐酸
A、A B、B C、C D、D13. 溶液(X)可能含有下列离子中的几种:NH4+、Na+、Ba2+、I-、SO32-、SO42-。为确定该溶液的组成,取X进行实验:①向X中加入少量氯水,再滴加淀粉溶液,未显蓝色;
②另取100 mL X加入过量氯水,再滴加足量BaCl2(aq),得到沉淀6.99 g;
③将②反应后的混合液过滤,在滤液中加足量NaOH(aq)加热,生成0.01 mol气体。
根据上述实验,原溶液中( )
A、一定存在Na+、NH4+ B、一定存在NH4+、SO32- C、一定不含Ba2+、I- D、可能存在Na +、SO42-14. 部分含硫物质的分类与相应化合价及部分物质间转化关系如图所示。下列说法不正确的是( ) A、a是一种有臭鸡蛋气味的气体 B、工业上由b制备e的路线:bcd C、c造成的酸雨雨水在空气中放置一段时间pH会增大 D、f、g正盐的阴离子可以在碱性溶液中共存15. 氧化锆是一种高级耐火材料,氧化钇主要用作制造微波用磁性材料。一种利用玻璃窑炉替换下的锆废砖(主要成分ZrO2、Y2O3、CaO等)提纯氧化锆和氧化钇的工艺流程如下:
A、a是一种有臭鸡蛋气味的气体 B、工业上由b制备e的路线:bcd C、c造成的酸雨雨水在空气中放置一段时间pH会增大 D、f、g正盐的阴离子可以在碱性溶液中共存15. 氧化锆是一种高级耐火材料,氧化钇主要用作制造微波用磁性材料。一种利用玻璃窑炉替换下的锆废砖(主要成分ZrO2、Y2O3、CaO等)提纯氧化锆和氧化钇的工艺流程如下:
下列说法正确的是( )
A、“酸化”是锆废砖粉和硫酸在硫酸铵催化作用下进行的焙烧反应,硫酸适宜用盐酸代替 B、“中和1”发生反应的离子方程式为Zr4+ +4OH- =Zr(OH)4 ↓ C、实验室模拟“焙烧”时使用的硅酸盐仪器只有烧杯和酒精灯 D、滤液2可以处理后返回“酸化”使用,实现循环16. 工业上以铬铁矿( FeCr2O4 , 含Al、Si氧化物等杂质)为主要原料制备红矾钠(Na2Cr2O7·2H2O)的工艺流程如下,已知焙烧的目的是将FeCr2O4转化为Na2CrO4 , 并将Al、Si氧化物转化为可溶性钠盐。下列说法错误的是( ) A、可代替纯碱的化学试剂有烧碱、小苏打 B、中和后所得滤渣主要成分是Al(OH)3、Fe(OH)3 C、在上述流程中得到副产品Na2SO4时需趁热过滤 D、母液最适宜返回酸化步骤循环利用17. 煤和石油是重要的能源物质,一方面对其开发利用推动人类社会快速进入工业文明时代,另一方面化石燃料燃烧产生带来的环境问题日益凸显,“碳中和”已成为新时代绿色发展理念。煤经汽化、液化后再利用,可提高效能、降低污染,其常见原理为:
A、可代替纯碱的化学试剂有烧碱、小苏打 B、中和后所得滤渣主要成分是Al(OH)3、Fe(OH)3 C、在上述流程中得到副产品Na2SO4时需趁热过滤 D、母液最适宜返回酸化步骤循环利用17. 煤和石油是重要的能源物质,一方面对其开发利用推动人类社会快速进入工业文明时代,另一方面化石燃料燃烧产生带来的环境问题日益凸显,“碳中和”已成为新时代绿色发展理念。煤经汽化、液化后再利用,可提高效能、降低污染,其常见原理为:等产物在化工生产中都有广泛用途。在指定条件下,下列选项所示的物质间转化不能实现的是( )
A、 B、 C、 D、18. 某研究小组利用的还原性提纯并制取的方案如下:
下列说法正确的是( )
A、“沉淀”步骤中可使用溶液代替硫酸 B、滤渣中只有 C、“转化”步骤中发生反应的离子方程式为 D、将直接加热得到固体19. 镓是化学史上第一个先从理论预言,后在自然界中被发现验证的化学元素,镓的活动性与锌相似。粉煤灰(主要成分为Ga2O3 , 含CaO、SiO2、Al2O3等杂质)中提取镓的工艺流程如下图所示,下列叙述错误的是( ) A、“溶浸”的目的是溶解两性氧化物,除去含钙、硅的杂质 B、向“滤液1”中加入酸性物质使pH减小,“滤渣2”是Al(OH)3 C、生成Ga(OH)3的化学方程式为:2NaGaO2+3H2O+CO2=Na2CO3+2Ga(OH)3↓ D、工业上采用电解熔融三氧化二镓的方法制备金属镓20. 以电石渣[主要成分为 , 含少量等杂质]为原料制备纳米碳酸钙的一种工艺流程如下:
A、“溶浸”的目的是溶解两性氧化物,除去含钙、硅的杂质 B、向“滤液1”中加入酸性物质使pH减小,“滤渣2”是Al(OH)3 C、生成Ga(OH)3的化学方程式为:2NaGaO2+3H2O+CO2=Na2CO3+2Ga(OH)3↓ D、工业上采用电解熔融三氧化二镓的方法制备金属镓20. 以电石渣[主要成分为 , 含少量等杂质]为原料制备纳米碳酸钙的一种工艺流程如下:
下列说法错误的是( )
A、“浸渍”时,适当提高温度,有利于提高浸取率 B、滤液II中主要成分是 , 可以循环使用 C、“碳化”中反应的离子方程式为 D、已知 , 则滤液II中沉淀完全时,小于二、多选题
-
21. 锰及其化合物用途广泛,以菱锰矿(主要成分为 , 还含有铁、镍、钴的碳酸盐以及杂质)为原料生产金属锰和高品位的工艺流程如图所示:
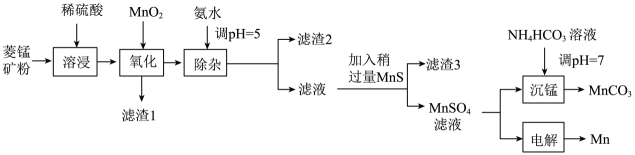
已知25℃时,部分物质的溶度积常数如表所示:
物质
MnS
NiS
CoS
说明:整个流程中Co、Ni均为+2价。下列说法正确的是
A、“氧化”时的主要作用是氧化 B、“滤渣3”的成分为CoS、NiS C、“沉锰”时,为了增强沉淀效果,应将溶液滴加到溶液中 D、“电解”时,以Fe作电极,、溶液为电解液、阳极产物为 , 每生成1mol 转移电子数为6三、非选择题
-
22. 以焙烧黄铁矿(杂质为石英等)产生的红渣为原料制备铵铁蓝颜料。工艺流程如下:

回答下列问题:
(1)、红渣的主要成分为(填化学式),滤渣①的主要成分为(填化学式)。(2)、黄铁矿研细的目的是。(3)、还原工序中,不生成S单质的反应的化学方程式为。(4)、工序①的名称为 , 所得母液循环使用。(5)、沉铁工序产生的白色沉淀中的化合价为 , 氧化工序发生反应的离子方程式为。(6)、若用还原工序得到的滤液制备和 , 所加试剂为和(填化学式,不引入杂质)。23. 化合物X由三种元素组成,某学习小组按如下流程进行实验: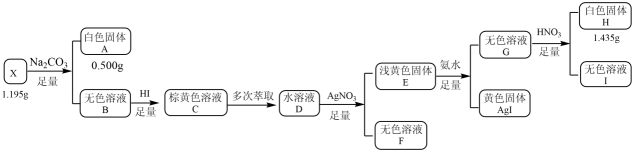
已知:白色固体A用溶解后,多余的酸用恰好中和,请回答:
(1)、X的组成元素是 , X的化学式是。(2)、写出溶液呈棕黄色所发生的化学反应方程式。(3)、写出生成白色固体H的离子方程式。(4)、设计实验检验溶液Ⅰ中的阳离子。24. 乳酸亚铁{ , }是一种常见的食品铁强化剂,溶于水,难溶于乙醇。某研究小组以矿渣X(主要成分是 , 含少量、杂质)制备乳酸亚铁并进行产品含量测定,制备流程如下(部分环节已略去):
已知:①一定浓度的金属离子生成相应的氢氧化物沉淀的pH如下表所示,
金属氢氧化物
开始沉淀时的pH
完全沉淀时的pH
7.6
9.6
2.2
3.4
4.1
5.4
②
(无色配离子)
请回答:
(1)、步骤Ⅳ,转化时使用如图装置,仪器A的名称是。 (2)、下列有关说法不正确的是____。A、步骤Ⅱ,加入氨水调节pH后,组分A中主要含铁成分为、 B、步骤Ⅲ,固体B为铁 C、固体C为和Fe D、重结晶后可选择乙醇洗涤晶体 E、为得到干燥的乳酸亚铁晶体,采用高温烘干的方式(3)、实验室常用已知浓度的重铬酸钾标准溶液滴定。
(2)、下列有关说法不正确的是____。A、步骤Ⅱ,加入氨水调节pH后,组分A中主要含铁成分为、 B、步骤Ⅲ,固体B为铁 C、固体C为和Fe D、重结晶后可选择乙醇洗涤晶体 E、为得到干燥的乳酸亚铁晶体,采用高温烘干的方式(3)、实验室常用已知浓度的重铬酸钾标准溶液滴定。①从下列选项中选择合理的仪器和操作,补全如下步骤[“ ”上填写一件最关键仪器,“( )”内填写一种操作,均用字母表示]
蒸馏水洗涤→润洗→( )→装液→( )→( )→用(量取一定体积的)→加指示剂,准备开始滴定。
仪器:a.烧杯;b.酸式滴定管;c.碱式滴定管;d.锥形瓶
操作:e.调整液面至“0”或“0”刻度以下,记录读数
f.橡皮管向上弯曲,挤压玻璃球,放液
g.打开活塞快速放液
h.控制活塞,将洗涤液从滴定管下部放出
i.将洗涤液从滴定管上口倒出
②滴定曲线如下图所示(曲线a未加磷酸,曲线b加磷酸)。滴定操作中向溶液中加入磷酸溶液的原因是:溶液酸化抑制水解、(写出两个理由)。
 (4)、研究小组为了测定乳酸亚铁产品中的含量,称取5.600 g乳酸亚铁产品溶于蒸馏水,定容至250 mL,进行如下实验。
(4)、研究小组为了测定乳酸亚铁产品中的含量,称取5.600 g乳酸亚铁产品溶于蒸馏水,定容至250 mL,进行如下实验。【实验一】铈量法测定含量。
取25.00 mL试液,用0.1000 mol/L的标准溶液滴定至终点。滴定反应为: , 4次滴定消耗溶液的体积如下,
实验次数
1
2
3
4
消耗溶液的体积/mL
18.75
20.05
18.70
18.65
①则该产品中含量为%(保留四位有效数字)。
【实验二】高锰酸钾法测定含量。
取25.00 mL试液,加入适量硫酸,用0.0200 mol/L的高锰酸钾标准溶液滴定至终点。4次滴定测得的含量如下,
实验次数
1
2
3
4
含量(%)
19.61
20.17
21.26
19.46
②比较实验一、二测得的产品中含量,认为铈量法适合于乳酸亚铁中含量的测定,原因是。
25. 钽()和铌()的性质相似,因此常常共生于自然界的矿物中。一种以钽铌伴生矿(主要成分为和少量的)为原料制取钽和铌的流程如下: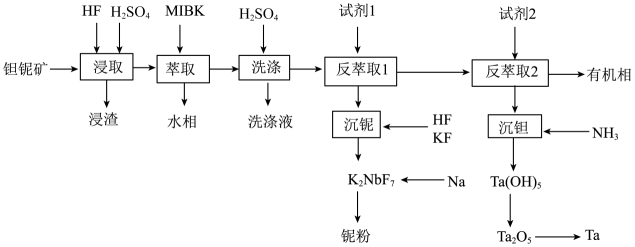
“浸取”后,浸出液中含有两种二元强酸和锰、钛等元素。
已知:①为甲基异丁基酮;②
(1)、“浸取”时通常在____材料的反应器中进行(填标号)。A、陶瓷 B、玻璃 C、铅 D、塑料(2)、浸渣的主要成分是 , 与氢氟酸反应的离子方程式为。(3)、“浸取”时,的浓度对铌、钽的浸出率的影响如下图所示,则的最佳浓度为 , 理由是。 (4)、金属铌可用金属钠还原制取,也可用电解熔融的制取。
(4)、金属铌可用金属钠还原制取,也可用电解熔融的制取。①流程中钠热还原法制备铌粉的化学方程式为。
②传统的熔盐电解法采用的电解质体系通常为 , 电解总化学反应方程式为。
26. 锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患.(1)、某锅炉水垢的主要成分有、、、 , 用酸洗法可除去该水垢,其基本原理如图1所示.
酸洗时,为使水垢尽可能溶解,不宜选用的是 填标号 .
A.稀硫酸 盐酸 硝酸 醋酸
不溶物用碳酸钠溶液浸泡时,反应的离子方程式是 .
洗出液中的会腐蚀铁质管道,反应的离子方程式是 ,因此,常在洗出液中加入具有强还原性的溶液,反应中的与的物质的量之比为1:2,转化为 填离子符号 .
柠檬酸用表示可用作酸洗剂,溶液中、、、的含量与pH的关系如图2所示.图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是 调节柠檬酸溶液的 , 有利于除去水垢中的氧化铁.时,溶液中上述4种微粒含量最多的是 .
 (2)、利用下图所示装置对锅炉水含、、进行预处理,可有效防止锅炉水垢的形成. 电解过程中,、在 填“a”或“b”极附近形成沉淀.27. Be被主要用于原子能反应堆材料、宇航工程材料等,有“超级金属、尖端金属、空间金属”之称。硫酸法是现代工业用绿柱石(主要成分为 , 还含有铁等杂质)生产氧化铍的方法之一,其简化的工艺流程如下:
(2)、利用下图所示装置对锅炉水含、、进行预处理,可有效防止锅炉水垢的形成. 电解过程中,、在 填“a”或“b”极附近形成沉淀.27. Be被主要用于原子能反应堆材料、宇航工程材料等,有“超级金属、尖端金属、空间金属”之称。硫酸法是现代工业用绿柱石(主要成分为 , 还含有铁等杂质)生产氧化铍的方法之一,其简化的工艺流程如下:
已知几种金属阳离子的氢氧化物沉淀时的pH如下表:
金属阳离子
开始沉淀时pH
1.5
3.3
6.5
5.2
沉淀完全时pH
3.7
5.0
9.7
—
(1)、步骤②中还可以采取什么措施提高反应速率(除粉碎外,任写一点)。(2)、滤渣1成分的化学式为。(3)、步骤③中加入的目的是。(4)、步骤④不宜使用溶液来沉淀 , 原因是(用必要的文字和离子方程式说明);已知 , 则沉淀完全时,溶液中(通常认为溶液中离子浓度小于时为沉淀完全)。(5)、绿柱石因含有不同杂质而产生不同的颜色。各种绿柱石中最名贵的是祖母绿,这是由铬、钒元素的存在造成的。①基态的最高能层中成对电子与未成对电子的数目之比为。
②重铬酸铵常用作有机合成催化剂,的结构如图。中键数目为。
 28. 某研究小组制备纳米ZnO,再与金属有机框架(MOF)材料复合制备荧光材料ZnO@MOF,流程如图:
28. 某研究小组制备纳米ZnO,再与金属有机框架(MOF)材料复合制备荧光材料ZnO@MOF,流程如图:
已知:①含锌组分间的转化关系:Zn2+Zn(OH)2
②ε−Zn(OH)2是Zn(OH)2的一种晶型,39℃ 以下稳定。
请回答:
(1)、步骤I,初始滴入ZnSO4溶液时,反应的化学方程式。(2)、下列有关说法错误的是____ 。A、步骤I,搅拌的作用是避免反应物浓度局部过高,使反应充分 B、步骤I,若将过量NaOH溶液滴入ZnSO4溶液制备ε−Zn(OH)2 , 可提高ZnSO4的利用率 C、步骤Ⅱ,为了更好地除去杂质,可用50℃的热水洗涤(3)、步骤Ⅲ,控温煅烧的目的是。(4)、步骤Ⅲ中,实验室盛放样品的容器名称是。(5)、用(CH3COO)2Zn和过量(NH4)2CO3反应,得到的沉淀可直接控温煅烧得纳米ZnO,沉淀无需洗涤的原因是。(6)、为测定纳米ZnO产品的纯度,可用已知浓度的EDTA标准溶液滴定Zn2+。用称量ZnO样品0.081g,在中用酸溶解样品,然后在中配制一 定体积的Zn2+溶液,再用移液管量取一定体积的 Zn2+溶液,最后用滴定管盛装EDTA标准溶液,滴定Zn2+。从下列选项中选择合理的仪器(按顺序填写且用字母作答)补全以上步骤。仪器: a.烧杯 b.托盘天平 c.容量瓶 d.分析天平 e.试剂瓶
(7)、制备的ZnO@MOF荧光材料可测Cu2+浓度。已知ZnO@MOF的荧光强度比值与Cu2+在一定浓度范围内的关系如图。某研究小组取7.5 ×10−3g人血浆铜蓝蛋白(相对分子质量为1.5 ×105),经预处理,将其中Cu元素全部转化为Cu2+并定容至1L。取样测得荧光强度比值为9.7,则1个人血浆铜蓝蛋白分子中含个铜原子。 29. 重铬酸钾()在实验室和工业上都有广泛应用。如工业中常将其用于制铬矾、火柴、电镀、有机合成等。工业上以铬铁矿(主要成分为 , 杂质主要为硅、铁、铝的氧化物)制备重铬酸钾的工艺流程如下图所示:
29. 重铬酸钾()在实验室和工业上都有广泛应用。如工业中常将其用于制铬矾、火柴、电镀、有机合成等。工业上以铬铁矿(主要成分为 , 杂质主要为硅、铁、铝的氧化物)制备重铬酸钾的工艺流程如下图所示:
已知:①焙烧时中的Fe元素转化为 , 铝的氧化物转化为
②矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示,当溶液中可溶性组分浓度时,可认为已除尽

请回答下列问题:
(1)、写出焙烧过程中发生的主要反应的化学方程式。(2)、水浸滤渣的主要成分是 , 写出生成此滤液的离子方程式。(3)、中和步骤中理论pH的范围是 , 中和后滤渣的主要成分是(填化学式)。(4)、酸化时加冰醋酸调节pH约等于5,写出酸化过程中反应的离子方程式。(5)、工序I经过过滤、洗涤后获得粗产品,则工序II的操作方法是。(6)、可以采用氧化还原滴定法测定产品的纯度,还可以采用分光光度法测定(溶液的吸光度与其浓度成正比),但测得的质量分数明显偏低,分析原因,发现配制待测液时少加了一种试剂,该试剂可以是(填字母)。a.硫酸 b.氢碘酸 c.硝酸钾 d.氢氧化钾
30. 碲被誉为现代工业的维生素,某工艺从精炼铜的阳极泥(主要含有Cu2Te,还有Au、Ag、SiO2等)中分别回收碲和重金属的流程如下图所示:
已知:“焙烧”后,碲主要以TeO2形式存在,TeO2溶于强碱生成。
(1)、基态Te原子的价电子排布式为。(2)、“焙烧”时气体与固体原料逆流而行,目的是;“滤液①”中 的成分为(填化学式)。(3)、“氧化”步骤中,双氧水需分批加入的目的是。(4)、写出“热还原”时发生反应的化学方程式。(5)、滤渣①中含CuO、Au和Ag,“酸浸①”可用浸取(填选项,下同),“酸浸②”可用浸取。A.王水 B.稀硝酸 C.浓氢氧化钠溶液 D.稀硫酸
(6)、粗碲粉中碲质量分数的测定步骤如下:取mg粗碲粉,加入酸使其转化为亚碲酸(H2TeO3),配制成100mL 溶液,取25.00mL 于锥形瓶中。向锥形瓶中加入V1mLc1mol·L-1酸性K2Cr2O7溶液,充分反应使亚碲酸转化为原碲酸(H6TeO6)。用c2mol·L-1硫酸亚铁铵[ (NH4)2 Fe(SO4)2 ]标准溶液滴定剩余的酸性K2Cr2O7溶液,消耗V2mL硫酸亚铁铵标准溶液。该粗碲粉中碲的质量分数为。31. 碲在冶金工业中用途广泛。某精炼铜的阳极泥经过处理后的主要成分为Cu2Te、TeO2、CuO等,从中回收碲和胆矾的工艺如下:
已知:①高温焙烧后的产物为TeO2和Cu2O;
②Cu2O在酸性条件下会发生歧化反应;
③Te元素在酸化和碱浸后分别转化为TeOSO4和Na2TeO3两种易溶于水的盐。
回答下列问题:
(1)、“高温焙烧”时,Cu2Te发生反应的化学方程式为;从结构的角度分析此时产物是Cu2O而不是CuO的原因为。(2)、“酸化”时需要加入一定量的H2O2 , 其目的为。(3)、“还原”时发生反应的离子方程式为。(4)、胆矾中存在的化学键有(填标号)。a.离子键 b.配位键 c.氢键 d.σ键
(5)、“电解”制Te的原理如图。其中N与电源的(填“正极”或“负极”)相连;与M相连的惰性电极上的电极反应式为。 (6)、Cu2Te的立方晶胞结构如图。其中Te的配位数为;已知晶胞参数为apm,NA为阿伏加德罗常数的值,则该晶体的密度为g·cm-3(列出计算式即可)。
(6)、Cu2Te的立方晶胞结构如图。其中Te的配位数为;已知晶胞参数为apm,NA为阿伏加德罗常数的值,则该晶体的密度为g·cm-3(列出计算式即可)。 32. 金属锂、钴是重要但又匮乏的战略资源,利用含钴废料(主要成分为Co3O4 , 还含有少量的铝箔、LiCoO2等杂质)制备碳酸钴的工艺流程如图:
32. 金属锂、钴是重要但又匮乏的战略资源,利用含钴废料(主要成分为Co3O4 , 还含有少量的铝箔、LiCoO2等杂质)制备碳酸钴的工艺流程如图:
回答下列问题:
(1)、“滤液①”主要成分是;“操作②”的分离方法是。(2)、“酸溶”中H2O2的作用是:;若用Na2S2O3代替H2O2则有两种硫酸盐生成,写出Na2S2O3在“酸溶”时发生的化学方程式:。(3)、H2O2 的电子式为。(4)、Co2+萃取的反应原理如下:Co2++2HR(有机层) =CoR2+2H+ , 若酸浸后的浸取液pH=1.000,c (Co2+ )=0.01001mol·L-1 , 多次萃取后水相中c(H+)为0.1200mol·L-1 , 则钴的萃取率为。(变化忽略,用百分数表示,保留小数点后两位)(5)、“碱浸”时少量未浸出的残余铝可在“酸浸”时浸出,萃取锂后的溶液需调pH至5.0以上将铝离子沉淀除去。若c(Co2+)=0.16mol·L-1 , 为避免析出Co(OH)2沉淀,则调pH不能超过。(已知Ksp [Co(OH)2]=1.6×10-15)。(6)、在空气中煅烧CoCO3生成钴的氧化物和CO2 , 测得充分煅烧后固体质量为24.1g, CO2的体积为6.72L (标准状况),则该钴氧化物的化学式为 。33. 三氧化钼(MoO3)和五氧化二钒(V2O5)是石油炼制中的重要催化剂,可利用炼油废催化剂(主要成分为V2O5、V2O4、 MoO3 , 还有少量的Al2O3、Fe2O3、有机物等)来制备。工艺流程图如图:
已知:①[Al(OH)4]-+H+ Al(OH)3+H2O,K=1013.38
②NH4VO3的溶解度( g/100g水): 0.48(20℃)、 1.32(40℃)、 2.42(60℃)
回答下列问题:
(1)、“焙烧”的目的是 。(2)、滤渣的主要成分是_ (填化学式)。(3)、向滤液①中加H2O2的作用是(用离子方程式表示)。(4)、当滤液①的pH调控为时,铝元素恰好沉淀完全(通常认为溶液中离子浓度不大于10-5mol·L-1为沉淀完全)。(5)、NH4VO3的沉淀过程中,沉钒率受温度影响,关系如图得所示。温度高于80℃沉钒率降低的主要原因可能是(答出一点即可)。NH4VO3 沉淀分解生成V2O5的化学方程式是。 (6)、催化剂V2O5溶于NaOH溶液中,可得到钒酸钠或偏钒酸钠,偏钒酸钠的阴离子呈如图所示的无限链状结构,写出偏钒酸钠的化学式。
(6)、催化剂V2O5溶于NaOH溶液中,可得到钒酸钠或偏钒酸钠,偏钒酸钠的阴离子呈如图所示的无限链状结构,写出偏钒酸钠的化学式。 (7)、仪器分析检测[Al(OH)4]-在水中带有结晶水,[Al(OH)4]-·xH2O中存在的作用力类型有____(填字母)。A、离子键 B、配位键 C、金属键 D、共价键34. 钼酸铋作为新型半导体光催化材料,因其具有优异的离子导电性、介电性、气体传感性和催化性而广泛应用于生产生活中。以氧化铋渣(主要成分是、、还含有、ZnO、和等杂质)为原料制备钼酸铋( , 其中Mo为+6价)的工艺流程如下:
(7)、仪器分析检测[Al(OH)4]-在水中带有结晶水,[Al(OH)4]-·xH2O中存在的作用力类型有____(填字母)。A、离子键 B、配位键 C、金属键 D、共价键34. 钼酸铋作为新型半导体光催化材料,因其具有优异的离子导电性、介电性、气体传感性和催化性而广泛应用于生产生活中。以氧化铋渣(主要成分是、、还含有、ZnO、和等杂质)为原料制备钼酸铋( , 其中Mo为+6价)的工艺流程如下:
回答下列问题:
(1)、基态的价电子排布式为。(2)、“浸渣”的主要成分为(填化学式)。(3)、“除锑”过程中发生反应的化学方程式为;该过程需要加热的原因为。(4)、已知:硫代乙酰胺( )在酸性溶液中会水解为乙酰胺(
)在酸性溶液中会水解为乙酰胺( )和硫化氢;的 , ;。
)和硫化氢;的 , ;。①硫化氢会进一步发生反应 , 计算该反应的平衡常数K=。
②硫代乙酰胺比乙酰胺的沸点低,解释其原因为。
(5)、“酸溶”时会有NO逸出,此过程中氧化剂与还原剂的物质的量之比为。(6)、已知钼酸铋在空气中放置会变质,生成和 , 该过程中的化学方程式为。(7)、的立方晶胞结构如图所示,以A点为原点建立分数坐标,已知A点坐标为(0,0,0),B点坐标为 , 则C点坐标为。
-