高考二轮复习知识点:常见金属元素的单质及其化合物的综合应用2
试卷更新日期:2023-07-29 类型:二轮复习
一、选择题
-
1. 探究铁及其化合物的性质,下列方案设计、现象和结论都正确的是
实验方案
现象
结论
A
往溶液中加入片
短时间内无明显现象
的氧化能力比弱
B
往溶液中滴加溶液,再加入少量固体
溶液先变成血红色后无明显变化
与的反应不可逆
C
将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加溶液
溶液呈浅绿色
食品脱氧剂样品中没有价铁
D
向沸水中逐滴加5~6滴饱和溶液,持续煮沸
溶液先变成红褐色再析出沉淀
先水解得再聚集成沉淀
A、A B、B C、C D、D2. 武当山金殿是铜铸鎏金大殿。传统鎏金工艺是将金溶于汞中制成“金汞漆”,涂在器物表面,然后加火除汞,使金附着在器物表面。下列说法错误的是( )A、鎏金工艺利用了汞的挥发性 B、鎏金工艺中金发生了化学反应 C、鎏金工艺的原理可用于金的富集 D、用电化学方法也可实现铜上覆金3. 下列推测不合理的是( )A、与足量反应生成两种强酸 B、与结构具有相似性 C、向混盐中加入足量稀硫酸会有产生 D、可看成是 , 但不可以看成是4. 三氧化二铬(Cr2O3) 是一种深绿色的固体,熔点很高,难溶于水,其化学性质类似于Al2O3 , 水溶液中Cr(+3)具有还原性。下列关于Cr2O3的说法错误的是( )A、与稀硫酸反应: Cr2O3+ 3H2SO4 = Cr2(SO4)3+ 3H2O B、与NaOH溶液反应: Cr2O3+ 4OH- = 2+2H2O C、碱性条件下被H2O2氧化为Cr(+6): Cr2O3+ 3H2O2+ 4OH- =2+ 5H2O D、由于金属性铝强于铬,且铬的熔点较高,故可用铝热法还原Cr2O3制取金属铬5. 化学与生产、生活和社会发展密切相关,下列叙述正确的是( )A、碳纳米管属于胶体,具有较高强度 B、淀粉、纤维素、脂肪、蛋白质都是天然高分子化合物 C、除去锅炉中的水垢时,可先用碳酸钠溶液处理,使水垢蓬松,再加入酸去除 D、碳酸钡可用于肠胃X射线造影检查6. 某废催化剂含 、 、 及少量的 .某实验小组以该废催化剂为原料,回收锌和铜,设计实验流程如图:
下列说法正确的是( )
A、步骤①操作中,生成的气体可用 溶液吸收 B、检验滤液1中是否含有 ,可以选用 和新制的氯水 C、步骤③和④操作中,均采用蒸发结晶方式从溶液中获得溶质 D、滤渣2成分是7. 央视《典籍里的中国》因袁隆平、宋应星两位科学家跨越时空的“握手”被刷上热搜。宋应星所著《天工开物》被誉为“百科全书之祖”。下列说法错误的是( )A、“凡播种先以稻麦稿包浸数日俟其生芽撒于田中生出寸许其名曰秧。”。其中“稻麦稿”的主要成分纤维素。 B、“水火既济而土合······后世方土效灵人工表异陶成雅器有素肌、玉骨之象焉”以上所述的“陶成雅器”的主要原料是黏土、石灰石 C、“凡火药,硫为纯阳,硝为纯阴,此乾坤幻出神物也”,“硝”指的是硝酸钾。 D、“凡铸镜模用灰沙铜用锡和”该法所制铜镜主要成分为青铜。8. 下列说法错误的是( )A、分子筛常用于分离、提纯气体混合物,但不能用于液体混合物分离 B、 可用作医疗上检查肠胃的钡餐,还可用作白色颜料 C、光照下, 在空气中与碳氢化合物发生作用,可产生光化学烟雾 D、铁的化合物应用广泛, 常用作净水剂9. 下列关于物质性质说法合理的是( )A、 、 、 均可以由相应单质直接化合生成 B、浓盐酸、浓硝酸、浓硫酸均可用铝罐车运输 C、等质量的铜分别与足量的浓硝酸和稀硝酸充分反应,转移的电子数相等 D、将氯气通入紫色石蕊溶液中,溶液先变红后褪色,说明氯气具有漂白性和酸性10. 下列物质间的每次转化都能通过一步反应实现的是( )A、 B、 C、 D、11. 在给定条件下,下列物质间转化能实现的是( )A、S SO2 H2SO3 B、NH3 NO2 HNO3 C、Fe2O3 Fe FeCl3 D、Al NaAlO2 Al(OH)312. 能实现下列物质间直接转化的元素是( )单质 氧化物 酸或碱 盐
A、Fe B、Si C、Na D、Cu13. 金属材料的发展极大地促进了人类社会的文明程度。如图是两种金属及其化合物的转化关系。下列说法错误的是( ) A、根据反应③可知氧化性:Fe3+>H2O2 B、向X溶液中滴入K3[Fe(CN)6]溶液,生成蓝色沉淀 C、反应③中稀硫酸仅表现酸性 D、反应①的离子方程式为Cu+H2O2+2H+=Cu2++2H2O14. 废旧电池的回收利用对保护环境、节约资源意义重大。某化学兴趣小组利用废旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO,部分实验过程如图所示。下列叙述错误的是( )
A、根据反应③可知氧化性:Fe3+>H2O2 B、向X溶液中滴入K3[Fe(CN)6]溶液,生成蓝色沉淀 C、反应③中稀硫酸仅表现酸性 D、反应①的离子方程式为Cu+H2O2+2H+=Cu2++2H2O14. 废旧电池的回收利用对保护环境、节约资源意义重大。某化学兴趣小组利用废旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO,部分实验过程如图所示。下列叙述错误的是( ) A、“溶解”过程中发生的反应有2Cu+O2+4H+=2Cu2++2H2O B、“溶解”操作中的空气可以用双氧水代替 C、“调节pH”过程中NaOH溶液的作用是使Cu2+转化为Cu(OH)2 D、“过滤II”所得滤渣只需洗涤,无需干燥15. 工业上用NaOH溶液进行 脱硫并制备高纯PbO的过程为 。已知 ;PbO的溶解度曲线如图所示。
A、“溶解”过程中发生的反应有2Cu+O2+4H+=2Cu2++2H2O B、“溶解”操作中的空气可以用双氧水代替 C、“调节pH”过程中NaOH溶液的作用是使Cu2+转化为Cu(OH)2 D、“过滤II”所得滤渣只需洗涤,无需干燥15. 工业上用NaOH溶液进行 脱硫并制备高纯PbO的过程为 。已知 ;PbO的溶解度曲线如图所示。
下列说法正确的是( )
A、PbO在NaOH溶液中的溶解是放热反应 B、碱浸1适宜用高浓度的NaOH溶液 C、降低NaOH溶液的浓度有利于PbO溶解 D、M点溶液中存在16. 利用废铝箔(主要成分为 ,含少量 、 等)制明矾 的一种工艺流程如图:
下列说法错误的是( )
A、①中生成了 : B、操作 是过滤,以除去难溶于 溶液的杂质 C、②③中加入稀硫酸的作用均是除去杂质 D、由④可知,室温下明矾的溶解度小于 和 的溶解度17. 同学们探究不同金属和浓硫酸的反应。向三等份浓硫酸中分别加入大小相同的不同金属片,加热,用生成气体进行下表实验操作并记录实验现象。实验操作
实验现象
金属为铜
金属为锌
金属为铝
点燃
不燃烧
燃烧
燃烧
通入 酸性溶液
褪色
褪色
褪色
通入 溶液
无明显变化
无明显变化
出现黑色沉淀
通入品红溶液
褪色
褪色
不褪色
已知: (CuS为黑色固体); 可燃
下列说法错误的是( )
A、加入铜片的实验中,使 酸性溶液褪色的气体是 B、加入铝片的实验中,燃烧现象能证明生成气体中一定含 C、加入锌片的实验中,生成的气体一定是混合气体 D、金属与浓硫酸反应的还原产物与金属活动性强弱有关18. 在给定的条件下,下列选项所示的物质间转化均能实现的是( )A、N2(g) NO(g) HNO3(aq) B、Al2O3(s) Al(s) NaAlO2(aq) C、BaCl2(aq) BaCO3(s) BaSO4(s) D、MgCl2·6H2O(s) MgCl2(s) Mg(s)19. 给定条件下,下列选项中所示的物质间转化均能一步实现的是( )A、粗硅 SiCl4 Si B、Mg(OH)2 MgCl2(aq) Mg C、Fe2O3 FeCl3(aq) 无水FeCl3 D、AgNO3(aq) [Ag(NH3)2]OH(aq) Ag二、非选择题
-
20. 氯化铁是重要的化工原料。针对氯化铁的实验室制备方法,回答下列问题:(1)、Ⅰ.的制备
制备流程图如下:

将废铁屑分批加入稀盐酸中,至盐酸反应完全。判断反应完全的现象为。含有少量铜的废铁屑比纯铁屑反应快,原因为。
(2)、操作①所必需的玻璃仪器中,除烧杯外还有。(3)、检验溶液中是否残留的试剂是。(4)、为增大溶液的浓度,向稀溶液中加入纯Fe粉后通入。此过程中发生的主要反应的离子方程式为。(5)、操作②为。(6)、Ⅱ.由制备无水将与液体混合并加热,制得无水。已知沸点为77℃,反应方程式为: , 装置如下图所示(夹持和加热装置略)。

仪器A的名称为 , 其作用为。NaOH溶液的作用是。
(7)、干燥管中无水不能换成碱石灰,原因是。(8)、由下列结晶水合物制备无水盐,适宜使用上述方法的是(填序号)。a. b. c.
21. 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:(1)、基态Na原子的价层电子轨道表示式为。(2)、NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na,电解反应方程式: , 加入的目的是。(3)、的电子式为。在25℃和101kPa时,Na与反应生成1mol 放热510.9kJ,写出该反应的热化学方程式:。(4)、采用空气和Na为原料可直接制备。空气与熔融金属Na反应前需依次通过、(填序号)a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.溶液
(5)、钠的某氧化物晶胞如下图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为。 (6)、天然碱的主要成分为 , 1mol 经充分加热得到的质量为g。22. 对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝( )、钼( )、镍( )等元素的氧化物,一种回收利用工艺的部分流程如下:
(6)、天然碱的主要成分为 , 1mol 经充分加热得到的质量为g。22. 对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝( )、钼( )、镍( )等元素的氧化物,一种回收利用工艺的部分流程如下: 已知:25℃时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。(1)、“焙烧”中,有 生成,其中 元素的化合价为。(2)、“沉铝”中,生成的沉淀 为。(3)、“沉钼”中, 为7.0。
已知:25℃时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。(1)、“焙烧”中,有 生成,其中 元素的化合价为。(2)、“沉铝”中,生成的沉淀 为。(3)、“沉钼”中, 为7.0。①生成 的离子方程式为。
②若条件控制不当, 也会沉淀。为避免 中混入 沉淀,溶液中 (列出算式)时,应停止加入 溶液。
(4)、①滤液Ⅲ中,主要存在的钠盐有 和 , 为。②往滤液Ⅲ中添加适量 固体后,通入足量(填化学式)气体,再通入足量 ,可析出 。
(5)、高纯 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止 刻蚀液与下层 (砷化镓)反应。
①该氧化物为。②已知: 和 同族, 和 同族。在 与上层 的反应中, 元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为。
23. 锂、铍等金属广泛应用于航空航天、核能和新能源汽车等高新产业。一种从萤石矿(主要含BeO、 、 及少量 、 、FeO、 、 )中提取铍的工艺如图: 已知:苯甲酸是一元弱酸,白色片状晶体,常温下微溶于水,温度升高,溶解度增大。
已知:苯甲酸是一元弱酸,白色片状晶体,常温下微溶于水,温度升高,溶解度增大。回答下列问题:
(1)、铍的化学性质与铝相似,写出BeO溶于NaOH溶液的化学方程式。(2)、“微波焙烧”使矿物内部变得疏松多孔,目的是。(3)、“浸出渣”的主要成分是。(4)、“除铁”中发生反应的离子方程式: 、。(5)、“除铝”时,溶液的pH越小,铝的去除率(填“越高”、“越低”或“不变”)。利用“除铝”所得苯甲酸铝沉淀再生苯甲酸的方案为:将苯甲酸铝沉淀溶于热的稀硫酸中,。(6)、由油酸铍制备BeO的方法是。24. 某兴趣小组对某种储氢材料X开展探究实验。 其中:X由三种短周期元素组成,且阴、阳离子个数比为2:1;金属互化物——全部由金属元素组成的化合物。
其中:X由三种短周期元素组成,且阴、阳离子个数比为2:1;金属互化物——全部由金属元素组成的化合物。请回答:
(1)、X的化学式是 , 化合物H的电子式为:。(2)、金属互化物C和过量NaOH溶液发生反应的离子方程式为:。(3)、某种钠盐和X具有相同的阴离子,且该钠盐可由两种二元化合物发生非氧化还原反应合成,请写出一个可能的化学方程式:。(4)、X中的某种元素单质可用来制造信号弹的原因是。(5)、通过气体A与单质D制备化合物H的过程中,通常产物中会夹杂单质D,请设计一个实验方案,检验产品中D杂质的含量,写出简要的实验步骤及需要测量的物理量:。25. 锂电池材料的回收利用已经成为重要的研究课题。已知经过预处理的某锂电池正极材料中主要存在LiCoO2和Cu、Al和Fe,某课题组利用如图工艺流程对其进行处理。
回答下列问题:
(1)、LiCoO2中,钴元素的化合价为。实验室里通常是在铝盐溶液滴加溶液制备Al(OH)3。(2)、图中用NaOH溶液调节溶液pH,得到的固体应为。为了使该物质从溶液中完全沉淀,应控制溶液pH在3.5左右。则该物质的Ksp数值约为(已知某离子浓度小于10-5 mol·L-1 时沉淀完全)。(3)、生成Li2CO3的反应加热的目的为 , 最恰当的加热方法为。(4)、LiCoO2“酸浸”阶段发生反应的化学反应方程式为。其“酸浸”过程也可以使用盐酸完成,与使用H2SO4相比,其缺点为。经萃取分液得到的CoSO4 , 再经加碱、过滤、热分解得到Co2O3 , 实现钴的富集回收。其中热分解生成Co2O3的化学方程式是。26. 某化工厂利用软锰矿(主要成分为MnO2 , 另含有少量Fe2O3、CaO、CuO、SiO2等杂质)脱除燃煤尾气中的SO2 , 同时制得电池材料MnO2.工艺流程如下: (1)、滤渣1的成分是(填化学式),提高软锰矿酸浸速率的措施有(任答一条)。(2)、写出脱硫过程中二氧化锰转化为硫酸锰的化学反应方程式。(3)、加入碳酸锰的作用。(4)、写出高锰酸钾与硫酸锰发生反应的离子方程式。(5)、实验室检验钾离子的操作方法是(6)、已知25℃时Ksp[Fe(OH)3]=4.0×10-38 , 欲使铁离子沉淀完全,应调节溶液pH不低于。(设 =a,结果用含a的代数式表示)。27. 以含锂的电解铝废渣(主要含AlF3、NaF、LiF、CaO)和浓硫酸为原料,制备电池级碳酸锂,同时得到副产品冰晶石的工艺流程如下:
(1)、滤渣1的成分是(填化学式),提高软锰矿酸浸速率的措施有(任答一条)。(2)、写出脱硫过程中二氧化锰转化为硫酸锰的化学反应方程式。(3)、加入碳酸锰的作用。(4)、写出高锰酸钾与硫酸锰发生反应的离子方程式。(5)、实验室检验钾离子的操作方法是(6)、已知25℃时Ksp[Fe(OH)3]=4.0×10-38 , 欲使铁离子沉淀完全,应调节溶液pH不低于。(设 =a,结果用含a的代数式表示)。27. 以含锂的电解铝废渣(主要含AlF3、NaF、LiF、CaO)和浓硫酸为原料,制备电池级碳酸锂,同时得到副产品冰晶石的工艺流程如下:
已知:LiOH易溶于水,Li2CO3微溶于水。回答下列问题:
(1)、加快酸浸速率的方法有 , 电解铝废渣与浓硫酸反应产生的气体的化学式为。苛化反应过程中加入氧化钙将碳酸锂转化为氢氧化锂溶液,若氧化钙过量则可能造成。(2)、碱解反应中,同时得到气体和沉淀,反应的离子方程式为。(3)、一般地说K>105时,该反应就基本进行完全了。苛化反应中存在如下平衡:Li2CO3(s)+ Ca2+(aq) 2Li+(aq)+CaCO3(s),通过计算说明该反应是否进行完全:[已知Ksp(Li2CO3)=8.64×10-4、Ksp(CaCO3)=2.5×10-9]。(4)、由碳化反应后的溶液得到Li2CO3 的具体实验操作有:加热浓缩, , 过滤, , 干燥。(5)、上述流程得到的副产品冰晶石的化学方程式(6)、电池级Li2CO3可由高纯度LiOH转化而来。将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式为。28. 氢氧化镍[Ni(OH)2]常用于制备金属镍及镍的重要化合物。一种用铁镍合金废料(还含有少量铜、钙、镁、硅的氧化物)制备纯度较高氢氧化镍的工艺流程如下:
已知:H2S的电离常数K1=1.3×10-7 , K2=7.1×10-15;Ksp[CuS]=6.0×10-36;Ksp[Ni(OH)2]=1.0×10-15.6
回答下列问题:
(1)、合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,还原产物为N2 , 金属镍溶解的离子方程式是;“酸溶”时产生的废渣主要成分为。(2)、“除铁”加入Na2CO3时,生成黄钠铁矾(NaFe3(SO4)2(OH)6)的离子方程式是;“除铁”时,将“铁”转化成颗粒较大的黄钠铁矾沉淀对后续操作较为有利,原因是。(3)、“除铜”时,反应的离子方程式为H2S+Cu2+=CuS↓+2H+ , 该反应平衡常数K=。(4)、“除钙镁”过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是。(5)、“沉镍”前c(Ni2+)=1.0mol/L,加入少量浓NaOH溶液,若忽略加入浓NaOH溶液对溶液体积的影响,则开始沉淀时溶液的pH=。(6)、用含镍21%的100kg铁镍合金废料经上述工艺制得31kgNi(OH)2固体,镍的回收率为。29. Ba是第六周期ⅡA族的元素,常见的矿物重品石(主要成分是 含少量 、CaO、MgO等)中,以下是某工业制取 流程示意图:
完成下列填空:
(1)、重晶石和煤磨成粉能加快反应速率,原因是。(2)、焙烧时主要反应为: ,不同温度下反应达到平衡时,各成分的物质的量如图所示。
①依图判断生成BaS的反应是反应(填“放热”或“吸热”),焙烧温度至少应控制在℃上。某次焙烧在真空容器中进行,1.5h时,测得容器中气体的密度为26.88g/L,该反应的化学反应速率为。
②已知:90℃时BaS的溶解度为50g/100g水,浸取液中还存在三种碱 、 、 ,其中碱性最弱的是(填化学式)。浸取液中产生 的原因是。(用离子方程式表示)
(3)、向BaS溶液中加入 生成 , 过量会析出 晶体,利用平衡移动原理,解释析出品体的原因。(4)、工业上用 制备高纯 ,其流程图是:
①碳化时,先向 溶液中通入(写化学式),写出碳化时发生反应的化学方程式。
②写出检验母液中主要阳离子的实验方案。
30. 黄金(Au)的一种化学精炼过程如下图所示,其中王水为浓盐酸和浓HNO3的混合物。
回答下列问题:
(1)、步骤①中部分Cu与稀H2SO4、O2反应,该反应的离子方程为。(2)、步骤②的反应中作氧化剂的物质是。(3)、滤液A含有的金属离子主要有Zn2+、Cu2+、。(4)、步骤④中王水与Au反应生成了HAuCl4、NO和H2O,该反应的化学方程式为。该步骤产生的尾气中有NO,可向尾气中通入适量的空气后,再通入溶液(填一种试剂)中的方法将其除去。(5)、步骤⑤中工业上若加入甲醛脱硝,反应生成CO2、NO和H2O,若加入尿素脱硝则生成N2、CO2和H2O。工业上应选择脱硝,原因是。(6)、若步骤⑥制纯金时反应amolH2C2O4 , 产生bL滤液C。取25.00mL滤液C,加入NaOH溶液中和,再加入足量的CaCl2饱和溶液,得到沉淀,过滤,将沉淀晾干得到CaC2O4 , 固体0.128g。步骤⑥加入的草酸晶体(H2C2O4∙2H2O)的质量至少为g(写出计算式)。31. CuCl是有机合成工业中应用较广的催化剂,是一种白色粉末,微溶于水,不溶于稀硫酸和乙醇;在潮湿的空气中易水解氧化为碱式氯化铜。工业上用黄铜矿(主要成分是 CuFeS2 , 还含有少量SiO2)制备CuCl的工艺流程如下:
回答下列问题:
(1)、为了提高矿砂浸取率,可以(任答两种)。(2)、“浸取”时NO 中N元素主要被还原为最低价态,则反应的离子方程式为。(3)、“滤渣①”的成分为SiO2、S;“滤渣②”的成分是 (填化学式)。(4)、已知在水溶液中存在平衡: (无色)。“还原”中所发生反应的离子方程式为 , 当出现现象时,表明“还原”进行完全。(5)、“一系列操作”是指加入去氧水、过滤、用无水乙醇洗涤、真空干燥,加去氧水的目的 。(6)、准确称取所制备的氯化亚铜产品mg,将其置于过量的FeCl3 溶液中,待样品完全溶解后,加入适量稀硫酸,用amol∙L-1的K2Cr2O7溶液滴定到终点(滴定过程中Cl-不参加反应),消耗K2Cr2O7溶液bmL,反应中Cr2O 被还原为Cr3+ ,产品中CuCl的纯度为。32. 综合利用富钛废渣(含 、ZnO、 和少量有机物)制备锂离子电池正极材料中间体,并获得部分副产品的工艺流程如下: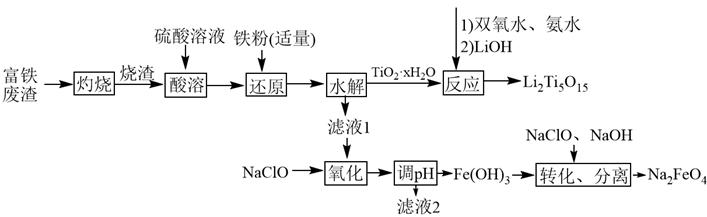
已知: 、 、 ,溶液中离子浓度 时认为该离子沉淀完全。回答下列问题:
(1)、“灼烧”的目的为;“酸溶”时用硝酸代替硫酸的不足之处为。(2)、若省略“还原”工序可能导致的后果为;当观察到现象时,即可停止加入铁粉。(3)、“酸溶”后钛以 形式存在,则“水解”反应的离子方程式为; 中过氧键的数目为。(4)、“氧化”后所得溶液中过渡金属离子浓度均为 ,则“调pH”的合理范围为。(5)、滤液2可用于制备活性ZnO,其方法为。(6)、“转化”反应的化学方程式为;以铁、石墨为电极,电解NaOH溶液也可制得 ,其中Fe作(填“阳极”或“阴极”),阳极的电极反应式为。33. 过氧化钙 在水中能缓慢放出氧气,是一种用途广泛的供氧剂,可用于鱼塘养殖。(1)、 中所含化学键的类型是、。(2)、 与水反应的化学方程式是。(3)、由电石渣(主要成分为氢氧化钙)制备过氧化钙可实现工业废渣的资源化,其制备流程如下:
①滤液Y可循环使用,其主要溶质的质量与反应前的加入量几乎没有变化,该溶质是。解释其质量不变的原因:(用化学方程式表示)。
②Ⅰ和Ⅱ的反应装置均需置于冰水浴中,解释Ⅱ中冰水浴的作用:(答出一点即可)。
(4)、 样品纯度测定
ⅰ.按上图连接装置(夹持和加热装置均略去),从水准管口加入适量水,并检查气密性;
ⅱ.准确称量 样品加入试管,并使其在试管底部均匀铺成薄层;
ⅲ.上下移动水准管,使水准管中液面与量气管中液面平齐;读取量气管中液面对应的刻度,记为 ;
ⅳ.加热发生反应: ,充分反应至不再有气体产生,停止加热,;再次读取量气管中液面对应的刻度,记为 ;
Ⅴ.计算样品中 的纯度。
①补全ⅳ中操作:。
②该实验条件下,气体摩尔体积为 ,样品中 的纯度为(用质量分数表示)。
34. 学习小组探究AgNO3、Ag2O(棕黑色固体,难溶于水)对氯水漂白性的影响。实验记录如下:
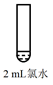
实验
方案和现象
ⅰ
加入1mL蒸馏水,再滴加1滴品红溶液,品红溶液较快褪色
ⅱ
加入少量Ag2O固体,产生白色沉淀a。再加入1mL蒸馏水和
1滴品红溶液,品红溶液褪色比i快
ⅲ
加入1mL较浓AgNO3溶液,产生白色沉淀b。再滴加1滴品红溶液,品红溶液褪色比i慢
(1)、用离子方程式表示i中品红溶液褪色的原因:。(2)、经检验,ii中的白色沉淀a是AgCl。产生AgCl的化学方程式是。(3)、ⅰ是iii的对比实验,目的是排除iii中造成的影响。(4)、研究白色沉淀b的成分。进行实验iv(按实验iii的方案再次得到白色沉淀b,过滤、洗涤,置于试管中):实验iv:
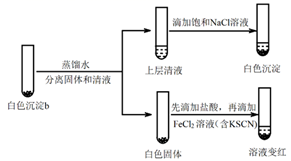
①设计对比实验证实白色沉淀b不只含有AgCl,实验方案和现象是。
②FeCl2溶液的作用是。由此判断,白色沉淀b可能含有AgClO。
(5)、进一步研究白色沉淀b和实验iii品红溶液褪色慢的原因,进行实验v:实验v:
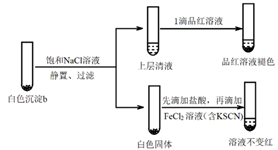
①结合离子方程式解释加入饱和NaCl溶液的目的:。
②推测品红溶液褪色的速率:实验iii比实验v(填“快”或 “慢”)。
35. 无水氯化锰 在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。I.向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II.向I的滤液中加入一定量盐酸,再加入 溶液,充分反应后加入 固体调节溶液的pH约为5,过滤;
III.向II的滤液中通入 气体,待充分反应后加热一段时间,冷却后过滤;
IV.浓缩、结晶、过滤、洗涤、脱水得到无水MnCl2。
各步骤中对杂质离子的去除情况
初始浓度/mg·L–1
21.02
4.95
5.86
步骤I后/ mg·L–1
12.85
3.80
3.39
步骤II后/ mg·L–1
0.25
3.76
3.38
步骤III后/ mg·L–1
0.10(达标)
3.19(未达标)
0.12(达标)
已知:金属活动性Mn>Fe>Ni>Pb
(1)、锰和盐酸反应的化学方程式是。(2)、步骤I中:①Fe2+浓度降低,滤渣中存在 。结合离子方程式解释原因:。
②Pb2+浓度降低,分析步骤I中发生的反应为:Pb + 2H+ = Pb2+ + H2↑、。
(3)、步骤II中:① 酸性溶液的作用:。
②结合离子方程式说明MnCO3的作用: 。
(4)、步骤III通入H2S后, Ni2+不达标而 达标。推测溶解度:PbSNiS(填“>”或“<”)。(5)、测定无水 的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量 ,使 氧化为 。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵 滴定 ,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)①样品中MnCl2的质量分数是(已知:MnCl2的摩尔质量是126 g·mol-1)。
②“持续加热”的目的是使过量的 分解。若不加热,测定结果会(填“偏高”、“偏低”或“无影响”)。