高考二轮复习知识点:铁盐和亚铁盐的相互转变
试卷更新日期:2023-07-29 类型:二轮复习
一、选择题
-
1. 部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
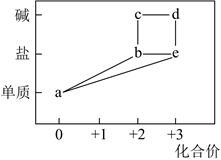
A、 可与 反应生成 B、 既可被氧化,也可被还原 C、可将 加入浓碱液中制得 的胶体 D、可存在 的循环转化关系2. 为探究 的性质,进行了如下实验( 和 溶液浓度均为 )。实验
操作与现象
①
在 水中滴加2滴 溶液,呈棕黄色;煮沸,溶液变红褐色。
②
在 溶液中滴加2滴 溶液,变红褐色;
再滴加 溶液,产生蓝色沉淀。
③
在 溶液中滴加2滴 溶液,变红褐色;
将上述混合液分成两份,一份滴加 溶液,无蓝色沉淀生成;
另一份煮沸,产生红褐色沉淀。
依据上述实验现象,结论不合理的是( )
A、实验①说明加热促进 水解反应 B、实验②说明 既发生了水解反应,又发生了还原反应 C、实验③说明 发生了水解反应,但没有发生还原反应 D、整个实验说明 对 的水解反应无影响,但对还原反应有影响3. 下列说法正确的是( )A、 在空气中加热可得固体 B、 加入到过量 溶液中可得 C、 在沸腾炉中与 反应主要生成 D、 溶液中加入少量 粉末生成 和4. 由实验操作和现象,得出的相应结论正确的是实验操作
现象
结论
A
将铜丝插入 FeCl3溶液中
铜丝溶解
铜的金属性大于铁
B
向Zn-Fe-酸化的NaCl溶液形成的原电池的铁电极附近滴加K3[Fe(CN)6]溶液
铁表面有蓝色沉淀生成
锌不能作为保护铁的牺牲阳极
C
25℃时测盐(MR)溶液的pH
pH=7
不能判断MOH和HR是否均为强电解质
D
向苯酚浊液中滴加饱和Na2CO3溶液
浊液变澄清
苯酚的Ka大于碳酸的Ka1
A、A B、B C、C D、D5. 一种用溶液浸取黄铁矿(主要含 , 还含有少量难溶性杂质)的流程如图所示,下列叙述中错误的是 A、浸取时主要反应的离子方程式为: B、可以向操作后的溶液X中加入KSCN溶液,检验是否存在 C、中含有离子键和共价键,阴阳离子个数比为2:1 D、由溶液X制取绿矾晶体的主要操作是蒸发浓缩、冷却结晶、过滤6. 下列关于氯化铁说法错误的是A、铁元素位于周期表d区 B、氯化铁属于强电解质 C、氯化铁溶液与金属铜发生置换反应 D、氯化铁能与硫氰化钾溶液反应显红色7. 室温下,向新制酸化的和未酸化的0.1 mol·L-1的FeSO4溶液中通入氧气且搅拌时,pH变化曲线如图。
A、浸取时主要反应的离子方程式为: B、可以向操作后的溶液X中加入KSCN溶液,检验是否存在 C、中含有离子键和共价键,阴阳离子个数比为2:1 D、由溶液X制取绿矾晶体的主要操作是蒸发浓缩、冷却结晶、过滤6. 下列关于氯化铁说法错误的是A、铁元素位于周期表d区 B、氯化铁属于强电解质 C、氯化铁溶液与金属铜发生置换反应 D、氯化铁能与硫氰化钾溶液反应显红色7. 室温下,向新制酸化的和未酸化的0.1 mol·L-1的FeSO4溶液中通入氧气且搅拌时,pH变化曲线如图。
已知:Fe(OH)3的;Fe(OH)2的;Fe3+开始沉淀时的pH≈1.5;Fe2+开始沉淀时的pH≈6.3
下列说法错误的是
A、M点对应的溶液中Fe2+水解程度小于P点对应的溶液中Fe2+水解程度 B、导致M点→N点pH升高的反应为: C、导致P点→Q点pH降低的反应为: D、O点和Q点后,Fe2+全部转化为Fe(OH)3 , 不再发生Fe2+的氧化反应8. 下列生活应用或生产活动,没有运用相应化学知识的是( )选项
生活应用或生产活动
化学知识
A
用二氧化碳跨临界直接制冰
液态二氧化碳汽化时吸热
B
用小苏打焙制糕点
受热易分解生成气体
C
用溶液蚀刻电路板上的铜
溶液呈酸性
D
丙三醇可用于配制化妆品
丙三醇与水形成氢键,有很强的保湿性
A、A B、B C、C D、D9. 下列有关金属及其化合物的应用不合理的是( )A、将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2 B、铝中添加适量Li,制得低密度、高强度的铝合金,可用于航空工业 C、盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良 D、水果放置于盛有浸泡过高锰酸钾溶液硅藻土包装箱中,水果可保鲜10. 部分含铁微粒所带的电荷数与其中铁元素化合价的关系如图所示,由该图可预测含铁微粒间相互转化时所需试剂。下列推断不合理的是( ) A、常温下,可用R材质容器储运浓硫酸 B、M可用K3[Fe(CN)6]溶液检验 C、若Q为金属阳离子,可通过Fe2O3与稀HI溶液反应生成 D、Fe3+与氧化剂在碱性条件下反应可生成FeO11. 高铁酸钾(K2FeO4)是一种新型的污水处理剂。为充分利用资源,变废为宝,在实验室中探究采用暖贴残渣制备高铁酸钾,流程如下
A、常温下,可用R材质容器储运浓硫酸 B、M可用K3[Fe(CN)6]溶液检验 C、若Q为金属阳离子,可通过Fe2O3与稀HI溶液反应生成 D、Fe3+与氧化剂在碱性条件下反应可生成FeO11. 高铁酸钾(K2FeO4)是一种新型的污水处理剂。为充分利用资源,变废为宝,在实验室中探究采用暖贴残渣制备高铁酸钾,流程如下
下列说法错误的是( )
A、步骤 i 适当加热搅拌可以加快反应速率 B、ii 中的试剂为 H2O2 C、iii 中反应为 2Fe3+ + 5H2O +3ClO- =2 FeO +3Cl-+10H+ D、iv 中反应说明溶解度:Na2FeO4>K2FeO412. 下列物质的溶液在实验室不宜长期保存,必须现用现配的是( )A、H2SO4 B、NaOH C、FeSO4 D、FeCl313. 用硫酸渣(主要含 、 ,杂质为 和 等)为原料制备氢氧化氧铁( )的流程如下: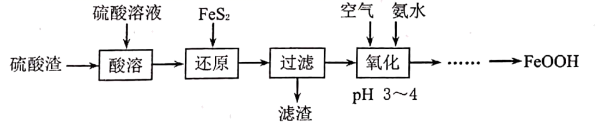
下列说法错误的是( )
A、滤渣中一定含有 B、“还原”时可以用铁粉代替 C、“氧化”的目的是将二价铁氧化成三价铁 D、“……”一系列操作为蒸发浓缩、冷却结晶二、非选择题
-
14. (14分)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途.某化学兴趣小组对绿矾的一些性质进行探究.回答下列问题:(1)、在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化.再向试管中通入空气,溶液逐渐变红.由此可知:、 .(2)、为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g.将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g.按下图连接好装置进行实验.
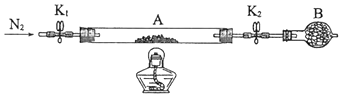
①仪器B的名称是 .
②将下列实验操作步骤正确排序(填标号);重复上述操作步骤,直至A恒重,记为m3 g.
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2 , 缓缓通入N2e.称量Af.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示).若实验时按a、d次序操作,则使x(填“偏大”“偏小”或“无影响”).
(3)、为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2 , 缓缓通入N2 , 加热.实验后反应管中残留固体为红色粉末.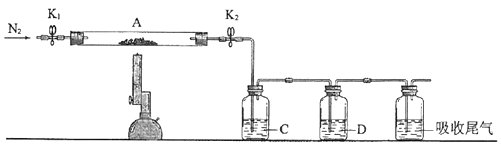
①C、D中的溶液依次为(填标号).C、D中有气泡冒出,并可观察到的现象分别为 .
a.品红b.NaOHc.BaCl2d.Ba(NO3)2e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式 .
15. 以焙烧黄铁矿(杂质为石英等)产生的红渣为原料制备铵铁蓝颜料。工艺流程如下:
回答下列问题:
(1)、红渣的主要成分为(填化学式),滤渣①的主要成分为(填化学式)。(2)、黄铁矿研细的目的是。(3)、还原工序中,不生成S单质的反应的化学方程式为。(4)、工序①的名称为 , 所得母液循环使用。(5)、沉铁工序产生的白色沉淀中的化合价为 , 氧化工序发生反应的离子方程式为。(6)、若用还原工序得到的滤液制备和 , 所加试剂为和(填化学式,不引入杂质)。16. 为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
回答下列问题:
(1)、由FeSO4·7H2O固体配制0.10 mol·L−1 FeSO4溶液,需要的仪器有药匙、玻璃棒、(从下列图中选择,写出名称)。 (2)、电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择作为电解质。
(2)、电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择作为电解质。阳离子
u∞×108/(m2·s−1·V−1)
阴离子
u∞×108/(m2·s−1·V−1)
Li+
4.07
4.61
Na+
5.19
7.40
Ca2+
6.59
Cl−
7.91
K+
7.62
8.27
(3)、电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入电极溶液中。(4)、电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L−1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=。(5)、根据(3)、(4)实验结果,可知石墨电极的电极反应式为 , 铁电极的电极反应式为。因此,验证了Fe2+氧化性小于 , 还原性小于。(6)、实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是。17. (14分)水泥是重要的建筑材料.水泥熟料的主要成分为CaO、SiO2 , 并含有一定量的铁、铝和镁等金属的氧化物.实验室测定水泥样品中钙含量的过程如图所示: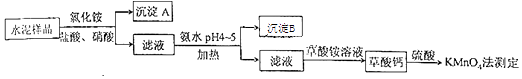
回答下列问题:
(1)、在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸.加入硝酸的目的是 , 还可使用代替硝酸.(2)、沉淀A的主要成分是 , 其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为 .(3)、加氨水过程中加热的目的是 . 沉淀B的主要成分为、(填化学式).(4)、草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO4﹣+H++H2C2O4→Mn2++CO2+H2O.实验中称取0.400g水泥样品,滴定时消耗了0.0500mol•L﹣1的KMnO4溶液36.00mL,则该水泥样品中钙的质量分数为 .18. 从铜电解液(主要含、Ni2+、、、、Zn2+等)中提纯得到粗硫酸镍晶体,为了进一步纯化并回收胆矾晶体,某课题小组设计了如图流程:
已知:相关离子浓度为0.1mol/L时,形成氢氧化物沉淀的pH范围如下:
金属离子
Cu2+
Fe2+
Fe3+
Ca2+
Zn2+
Ni2+
开始沉淀的pH
4.2
6.3
1.5
11.8
6.2
6.9
沉淀完全的uH
6.7
8.3
2.8
13.8
8.2
8.9
(1)、为加快“水浸”时的浸出率,可采取的措施有(任写一点)。(2)、为了使“溶液1”中的反应充分进行,需要通入稍过量的H2S,写出Fe3+与H2S发生反应的离子方程式:。(3)、请结合离子方程式解释向“溶液2”中加入Ni(OH)2的原因。(4)、“操作X”为在(填仪器名称)中加热至 , 冷却结晶、过滤、洗涤、干燥后得到结晶水合物晶体。(5)、若“溶液3”中Ca2+的浓度为0.001mol/L,取等体积的NiF2溶液与该溶液混合,要使反应结束时c(Ca2+)<10-5mol/L,则所加NiF2溶液的浓度至少为mol/L。[已知室温下Ksp(CaF2)=4×10-11](6)、室温下选择萃取剂P204(二乙基已基磷酸,用HR表示),其萃取原理为nHR+Mn+⇌MRn+nH+ , 试剂a为(填化学式)。溶液pH对几种离子的萃取率的影响如图,则萃取锌时,应控制pH的范围为3~4,请解释原因:。 19. 工业上以软锰矿(主要成分为 , 还含少量的铁、硅和铝的氧化物等杂质)为原料生产的工艺流程如图:
19. 工业上以软锰矿(主要成分为 , 还含少量的铁、硅和铝的氧化物等杂质)为原料生产的工艺流程如图:
常温下,各种离子沉淀时的pH如下表:
离子
开始沉淀时的pH
1.5
3.4
8.2
完全沉淀时的pH
2.8
4.7
10.2
(1)、“酸浸”过程中生成一种黄色沉淀,写出该反应的离子方程式: , “滤渣Ⅰ”的主要成分有。(2)、“工序①”需要用到的玻璃仪器为烧杯、。(3)、向“有机相”中滴加溶液,有蓝色沉淀生成,可推出“有机相”中含(填离子符号),中提供空轨道的是 , 中心离子的配位数为。(4)、“沉锰”时,不能加入太多碳酸钠溶液,可能的原因为(答两条)。(5)、若100kg软锰矿在生产过程中锰的损失率为8%,最终得到405kg(摩尔质量为285),则软锰矿中锰的质量分数约为(保留三位有效数字)。20. 硫酸锰是一种重要的化工中间体。一种以高硫锰矿(主要成分为含锰化合物及FeS)与氧化锰矿(主要成分为MnO2等锰的氧化物)为原料制备硫酸锰的工艺流程如下:
已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中沉淀的pH范围如下表所示(25℃):
物质
Fe(OH)3
Fe(OH)2
Mn(OH)2
Al(OH)3
开始沉淀的pH
1.9
7.6
7.3
3.0
完全沉淀的pH
3.2
9.6
9.3
5.2
③离子浓度≦10-5mol·L-1时,离子沉淀完全。
(1)、“混合焙烧”的主要目的是。(2)、若试剂a为MnO2 , 则氧化步骤发生反应的离子方程式为 , 若省略“氧化”步骤,造成的影响是。(3)、“中和除杂”时,应控制溶液的pH范围是。(4)、“氟化除杂”后,若使溶液中Mg2+沉淀完全,需维持c(F-)不低于。(已知:Ksp(MgF2)=6.4×10-10)(5)、“碳化结晶”时发生反应的离子方程式为 , 最后一步系列操作主要是。21. 我国锂云母矿石储量丰富,现有产自内蒙古的锂云母矿石(主要成分为SiO2·Al2O3·2(Li,K)(F,OH)],内含少量镁、钙、铁的氧化物),工业上欲采用硫酸法用其制备Li2CO3具体流程如下:
查阅资料可知:
I.“焙烧”温度对锂提取率的影响如下图所示

II.“焙烧”过程中铁的氧化物未参与反应
III.3SiO2·Al2O3·2(Li,K)(F,OH)]+H2SO4(浓)Li2SO4+Al2(SO4)3+K2SO4+SiO2+SiF4↑+H2O
IV.Li2SO4+Na2CO3→Li2CO3↓+Na2SO4
回答下列问题:
(1)、“焙烧”温度理论上选择为宜,同时为提高“焙烧”效率,还可采取的措施有;(2)、“焙烧”产生的气体可用NaOH溶液吸收,且元素化合价均不发生变化,该反应的化学方程式为;(3)、在“中和”过程中,为使Fe3+和Al3+完全沉淀,pH值至少调整为;部分金属氢氧化物的pKsp(pKsp=-lgKsp)如图所示: (4)、“中和”所得“滤渣1”中除氢氧化物沉淀外还含有;(5)、“氧化”过程中发生氧化还原反应的离子方程式为;(6)、“滤渣2”的主要成分是;(7)、工业上还可以通过“苛化反应”,利用Li2CO3(s)+Ca2+(aq)CaCO3(s)+2Li+(aq)反应原理得到氢氧化锂溶液,进而生产出纯度更高的工业碳酸锂,请通过计算过程证实该方案的可行性。[已知Ksp(Li2CO3)=8.64×10-4;KspCaCO3)=2.5×10-9]22. 如图是以硼镁矿(含Mg2B2O5 ·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程:
(4)、“中和”所得“滤渣1”中除氢氧化物沉淀外还含有;(5)、“氧化”过程中发生氧化还原反应的离子方程式为;(6)、“滤渣2”的主要成分是;(7)、工业上还可以通过“苛化反应”,利用Li2CO3(s)+Ca2+(aq)CaCO3(s)+2Li+(aq)反应原理得到氢氧化锂溶液,进而生产出纯度更高的工业碳酸锂,请通过计算过程证实该方案的可行性。[已知Ksp(Li2CO3)=8.64×10-4;KspCaCO3)=2.5×10-9]22. 如图是以硼镁矿(含Mg2B2O5 ·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程:
回答下列问题:
(1)、为了提高硼镁矿的“溶浸”速率,工业中可以采取下列适当措施____( 填序号)。A、升高溶浸温度 B、加快搅拌速度 C、缩短酸浸时间(2)、滤渣的主要成分有。(3)、吸收过程中发生的离子方程式为 , 的空间构型为。(4)、沉镁时调pH≈6.5的原因是。(5)、已知溶浸后得1000L含Mg2+3.0mol·L-1的溶液,假定过滤I和过滤II两步Mg2+损.耗率共10%,沉镁时沉淀率99.9% ,最多能生成Mg( OH)2· MgCO3kg(保留到小数点后第1位)。23. 聚合硫酸铁(PFS)也称碱式硫酸铁或羟基硫酸铁,是新型、优质、高效铁盐类无机高分子絮凝剂。PFS固体为淡黄色无定型粉状固体,极易溶于水,高于130℃发生分解,有较强的吸湿性。下图是以回收废铁屑为原料制备PFS的一种工艺流程。
回答下列问题:
(1)、粉碎过筛的目的是。(2)、酸浸没时最合适的酸是。(3)、反应釜中加入的氧化剂是双氧水,其作用是 , 反应的离子方程式为。(4)、聚合釜中溶液的pH必须控制在一定的范围内,原因是。(5)、相对于常压蒸发,减压蒸发的优点是。(6)、盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用cmol/L的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液VmL。按照上述步骤做空白对照试验,消耗NaOH溶液mL,已知该样品中Fe的质量分数ω,则B的表达式。24. 碳酸亚铁在干燥空气中为白色固体,可用于制铁盐、兽药、补血剂等。利用废铁屑(含少量碳、氧化铝和氧化铁杂质)为原料制取碳酸亚铁,并探究碳酸亚铁的部分性质。回答下列问题:(1)、Ⅰ.制碳酸亚铁,工艺流程如图:
常温下几种金属阳离子开始沉淀与完全沉淀时的pH如表:
Fe2+
Fe3+
Al3+
开始沉淀
7.5
2.7
3.8
完全沉淀
9.5
3.7
4.7
酸浸时,所发生氧化还原反应的离子方程式为。
(2)、加入氨水调控pH的范围是 , “固体”的成分是。(3)、在工业生产中加入的NH4HCO3 , 需过量,下列分析不正确的是(填标号)。a.使Fe2+充分转化为碳酸亚铁
b.碳酸氢铵受热分解
c.促进Fe2+、CO的水解
(4)、Ⅱ.探究碳酸亚铁的性质
实验:
由上面实验可以得出碳酸亚铁的相关性质是 , 写出碳酸亚铁变成红褐色固体所发生反应的化学方程式。
(5)、已知:100.8≈6.3,25℃时,Ksp(FeCO3)=3.0×10-11、Ksp[Fe(OH)2]=1.6×10-14。现将碳酸亚铁加入0.1mol·L-1Na2CO3(pH=11.6)溶液中,经计算可知(填“有”或“无”)Fe(OH)2生成。25. 黄钠铁矾[Na3Fe3(SO4)3(OH)6]被用于作净水剂。以高品质的硫铁矿(主要成分为FeS2 , 含少量SiO2)为原料制取黄钠铁矾,工艺流程如图: (1)、“盐浸”时的反应为FeS2+Fe2(SO4)3→FeSO4+S↓(未配平),其中氧化剂和还原剂的物质的量之比为;滤渣的主要成分为SiO2和。(2)、“氧化”时发生反应的离子方程式为;用空气代替NaClO进行该反应具有成本低等优点,但存在的缺点。(3)、“沉铁”过程,控制不同条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示黄钠铁矾稳定产生的区域)。
(1)、“盐浸”时的反应为FeS2+Fe2(SO4)3→FeSO4+S↓(未配平),其中氧化剂和还原剂的物质的量之比为;滤渣的主要成分为SiO2和。(2)、“氧化”时发生反应的离子方程式为;用空气代替NaClO进行该反应具有成本低等优点,但存在的缺点。(3)、“沉铁”过程,控制不同条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示黄钠铁矾稳定产生的区域)。
①80℃时,加入碳酸钠偏多时得到的黄钠铁矾中含有的杂质是。
②生成黄钠铁矾的离子反应方程式。
③由图在pH=2时,温度过高或过低,不易制得黄钠铁矾。试解释其原因。
(4)、测定黄钠铁矾样品中铁的质量分数:称取样品2.000g置于锥形瓶中,加入足量稀H2SO4溶解,滴入稍过量的KI溶液,待充分反应后,调节溶液近中性,滴入几滴淀粉溶液,用0.1500mol•L-1Na2S2O3溶液平行滴定,平均消耗20.00mL。(已知:I2+2S2O=2I-+S4O)①滴定终点的实验现象是。
②样品中铁的质量分数为。
26. 目前新能源技术被不断利用,高铁电池技术就是科研机构着力研究的一个方向。(1)、高铁酸钾—锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是。(2)、工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定。反应原理为:Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O
Ⅱ.Na2FeO4与KOH反应生成K2FeO4 , 主要的生产流程如下:

①写出反应①的离子方程式。
②请写出生产流程中“转化”(反应③)的化学方程式。
③该反应是在低温下进行的,说明此温度下Ksp(K2FeO4)Ksp(Na2FeO4)(填“>”“<”或“=”)。
④“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液。
a.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(3)、已知K2FeO4在水溶液中可以发生:4+10H2O 4Fe(OH)3+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是。(4)、在水溶液中的存在形态图如图所示。
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO的分布分数的变化情况是。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,转化为。(填化学式)
27. 镍氢电池有着广泛的应用,旧电池的回收和再利用同样的重要。废旧镍氢电池中常含有NiOOH、Ni(OH)2、及少量Co(OH)2、FeO等,以下为金属分离以及镍的回收流程,按要求回答下列问题: (1)、N2H4的电子式是;“酸浸”中,加入N2H4的主要作用是。(2)、“氧化”过程中与Fe2+有关的离子方程式是 , 滤渣1主要成分是弱碱,其化学式是。(3)、已知 =8.0×10-44 , 当三价钴沉淀完全时,溶液pH=。(已知:lg2=0.3)(4)、滤液A的主要溶质是;操作X是(5)、用滴定法测定NiCO3产品中镍元素含量。取2.500g样品,酸溶后配成250mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.1000mol/L的Na2H2Y溶液进行滴定。
(1)、N2H4的电子式是;“酸浸”中,加入N2H4的主要作用是。(2)、“氧化”过程中与Fe2+有关的离子方程式是 , 滤渣1主要成分是弱碱,其化学式是。(3)、已知 =8.0×10-44 , 当三价钴沉淀完全时,溶液pH=。(已知:lg2=0.3)(4)、滤液A的主要溶质是;操作X是(5)、用滴定法测定NiCO3产品中镍元素含量。取2.500g样品,酸溶后配成250mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.1000mol/L的Na2H2Y溶液进行滴定。已知:①Ni2++H2Y2-=[NiY]2-+2H+
②紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的现象是。
②如果紫脲酸胺滴入过多,终点延迟,则会导致。
28. 硫酸亚铁在印染、医药、化肥等多个行业有广泛应用.某学习小组对硫酸亚铁晶体(FeSO4·7H2O)的热分解产物进行探究.回答下列问题: (1)、装置A中石棉绒的作用为;装置D中的仪器名称为。(2)、按气流方向,上述装置合理的连接顺序为a→、→、→、→h(填装置口小写字母)(3)、该小组同学按上述顺序连接各装置并进行实验,请为他们补全表格:
(1)、装置A中石棉绒的作用为;装置D中的仪器名称为。(2)、按气流方向,上述装置合理的连接顺序为a→、→、→、→h(填装置口小写字母)(3)、该小组同学按上述顺序连接各装置并进行实验,请为他们补全表格:装置编号
填装试剂
实验现象
实验结论
A
FeSO4·7H2O
绿色固体逐渐变为红色粉末
B
①
②
分解产物中含有SO2
C
BaCl2溶液
产生白色沉淀
③
D
无水CuSO4粉末
白色固体逐渐变为蓝色
分解产物中含有水蒸气
E
④
(4)、硫酸亚铁晶体分解的化学方程式为。(5)、设计实验证明A中得到的红色粉末不含+2价铁元素:(简述实验操作及现象)。29. 近年来,我国的钢铁产量居世界首位。炼铁时产生大量瓦斯泥,若不合理利用,会对环境造成不利影响。一种以瓦斯泥(主要含ZnO、Bi2O3、Bi2S3、Bi、Fe2O3 , 还含少量PbO、FeO、CuO;锌、铋两元素的质量分数分别为8.92%、0.75%)为原料提取锌、铋的工艺流程如下图所示: 回答下列问题:(1)、“浸取”时,为避免“瓦斯泥”在反应器的底部沉淀、结块,可采取的措施为。(2)、“过程I”中发生反应的离子方程式为。(3)、“过程II”产生的气体(填化学式)可在流程的步骤中循环使用。(4)、“酸盐浸提”时,为使铋充分浸出,加入适量NaCl作助溶剂。单质铋在Fe3+的氧化作用下被溶解。
回答下列问题:(1)、“浸取”时,为避免“瓦斯泥”在反应器的底部沉淀、结块,可采取的措施为。(2)、“过程I”中发生反应的离子方程式为。(3)、“过程II”产生的气体(填化学式)可在流程的步骤中循环使用。(4)、“酸盐浸提”时,为使铋充分浸出,加入适量NaCl作助溶剂。单质铋在Fe3+的氧化作用下被溶解。①含铋物质发生反应的化学方程式为:
i.Bi2O3+3H2SO4+6NaCl=2BiCl3+3Na2SO4+3H2O
ii.Bi2S3+3Fe2(SO4)3+6NaCl=2BiCl3+3Na2SO4+6FeSO4+3S
iii.。
②“滤渣2”的主要成分除S外还有。
(5)、已知:此工艺中,Bi3+水解得到BiOCl沉淀的适宜pH范围为1.6~2.0;溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:金属离子
Fe2+
Fe3+
Zn2+
开始沉淀时pH
7.0
1.9
6.2
完全沉淀时pH
9.0
3.2
8.0
①结合上述信息分析,“水解”时加入适量Zn粉的目的是。
②“水解”后的“系列操作”为。
(6)、处理3.6t“瓦斯泥”,得到26.05kg“BiOCl产品”,其中BiOCl质量分数为90%,则铋的回收率为。(结果精确到1%)。30. 莫尔盐[(NH4)2Fe(SO4)2·6H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某学习小组设计如下实验制备少量的莫尔盐。
回答下列问题:
(1)、Ⅰ.制取莫尔盐连接装置,检査装置气密性。将0.1mol(NH4)2SO4晶体置于玻璃仪器(填仪器名称)中,将6.0g洁净铁屑加入锥形瓶中。
(2)、①打开分液漏斗瓶塞,关闭活塞K3 , 打开K2、K1 , 加完55.0mL2mol·L-1稀硫酸后关闭K1 , A装置中反应的离子方程式为。②待大部分铁粉溶解后,打开K3、关闭K2 , 此时可以看到的现象为 , 原因是。
③关闭活塞K2、K3 , 采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶、、用无水乙醇洗涤晶体。装置A中的反应,硫酸需过量,保持溶液的pH在1~2之间,其目的为。
④装置C的作用为 , 装置C存在的缺点是。
31. 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。提出问题: 、Br2哪个氧化性更强?
(1)、猜想:①甲同学认为氧化性: >Br2 , 故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含(填化学式,下同)所致。②乙同学认为氧化性:Br2> ,故上述现象是发生氧化还原反应所致,则溶液呈黄色是含所致。(2)、设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。供选用的试剂:a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象。
选用试剂(填序号)
实验现象
方案1
方案2
(3)、结论:氧化性Br2> 。故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为。实验后的思考:根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是。
某实验室用含少量铁的废铜渣为原料生产胆矾的流程如下:
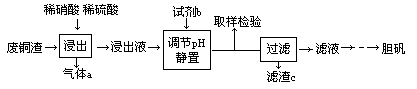
已知: 在pH为2.7时开始沉淀,到3.7时沉淀完全; 在pH为4.7时开始沉淀。
(4)、“浸出”时,原料中的铜均转化为硫酸铜。写出相应的离子方程式:。(5)、试剂b是(填物质名称),其反应的离子方程式:。(6)、调节pH的目的是。滤渣c是。(7)、将得到的胆矾与其他液体混合物分离的方法为。32. 合理利用工厂烟灰,变废为宝,对保护环境具有重要意义.以某钢铁厂烟灰 主要成分为ZnO,并含少量的CuO、 、 等 为原料制备氧化锌的工艺流程如图。 回答下列问题: (1)、“浸取”工序中加入过量氨水的目的:①使ZnO、CuO溶解,转化为 和 配离子;②使NH4HCO3部分转化为 。(2)、将滤渣①用稀 溶液处理后得到 溶液和 固体,检验该溶液中金属阳离子的方法是。(3)、“除杂”工序加入过量的A是一种金属,其化学式为 , 该反应的离子方程式为 。(4)、滤渣②的主要成分有 填化学式 ,回收后可用作冶金原料。(5)、ZnO与 NH4HCO3和NH3·H2O 的混合物三者在“浸取”反应时离子方程式为 。(6)、“蒸氨沉锌”工序中,“蒸氨”是将氨及其盐从固液混合物中蒸出,蒸出物冷凝吸收后得到的碳化氨水,产物可返回 工序循环使用 。从碱式碳酸锌得到氧化锌的工序为 。33. 奥秘无穷的面观世界让我们深度认识丰言多形的宏观世界的本质,请要求回答下列问题:(1)、第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图:
回答下列问题: (1)、“浸取”工序中加入过量氨水的目的:①使ZnO、CuO溶解,转化为 和 配离子;②使NH4HCO3部分转化为 。(2)、将滤渣①用稀 溶液处理后得到 溶液和 固体,检验该溶液中金属阳离子的方法是。(3)、“除杂”工序加入过量的A是一种金属,其化学式为 , 该反应的离子方程式为 。(4)、滤渣②的主要成分有 填化学式 ,回收后可用作冶金原料。(5)、ZnO与 NH4HCO3和NH3·H2O 的混合物三者在“浸取”反应时离子方程式为 。(6)、“蒸氨沉锌”工序中,“蒸氨”是将氨及其盐从固液混合物中蒸出,蒸出物冷凝吸收后得到的碳化氨水,产物可返回 工序循环使用 。从碱式碳酸锌得到氧化锌的工序为 。33. 奥秘无穷的面观世界让我们深度认识丰言多形的宏观世界的本质,请要求回答下列问题:(1)、第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图:
①元素a位于元素周期表五个区中的区,基态原子a核外电子占据最高能层电子的电子云轮廓图形状为。
②据所学知识,预测与元素a同主族短周期元素b的I1在上图中相应位置上用圆点(•)画出,并标注该元素的元素符号。
③基态原子b的价层电子排布图:。
(2)、H2O与H2S的稳定性较强的是 , 其原因:。(3)、储氢材料Li2NH中所含元素的电负性由大到小排列的顺序是。(4)、储氢合金M的晶胞结构如图所示。该晶体中原子之间的作用力是 , 已知该晶胞的边长为a cm,阿伏加德罗常数的值为NA , 则该晶体的密度=g/cm3(列出算式)。在实现储氢功能时,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中心如图所示,若所有四面体空隙都填满氢,该晶体储氢后的化学式为。 (5)、某补铁剂中铁元素价态的检验,取一补铁剂药片,加少量蒸馏水溶解,取上层淡黄色清液于试管中,测得pH=3.0,先向其中滴加KSCN溶液,未发现明显变化,再向其中滴加少许稀盐酸,溶液变红色。由此得出结论:该补铁剂中含有价铁。又已知稀溶液中Fe[(H2O)6]3+无色,Fe[(OH)]2+黄色,请结合相关知识对上述现行推理解释:。
(5)、某补铁剂中铁元素价态的检验,取一补铁剂药片,加少量蒸馏水溶解,取上层淡黄色清液于试管中,测得pH=3.0,先向其中滴加KSCN溶液,未发现明显变化,再向其中滴加少许稀盐酸,溶液变红色。由此得出结论:该补铁剂中含有价铁。又已知稀溶液中Fe[(H2O)6]3+无色,Fe[(OH)]2+黄色,请结合相关知识对上述现行推理解释:。