高考二轮复习知识点:镁、铝的重要化合物
试卷更新日期:2023-07-29 类型:二轮复习
一、选择题
-
1. 化学与生活密切相关,下列说法错误的是()A、碳酸钠可用于去除餐具的油污 B、漂白粉可用于生活用水的消毒 C、氢氧化铝可用于中和过多的胃酸 D、碳酸钡可用于胃肠X射线造影检查2. 向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是( )A、c(CO32﹣) B、c(Mg2+) C、c(H+) D、Ksp(MgCO3)3. 已知NaOH+Al(OH)3→Na[Al(OH)4].向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起.上述实验过程中没有发生的离子反应是( )A、CO2+2OH﹣→CO32﹣+H2O B、Al2O3+2OH﹣+3H2O→2[Al(OH)4]﹣ C、2 Al+2OH﹣+6H2O→2[Al(OH)4]﹣+3H2↑ D、Al3++4 OH﹣→[Al(OH)4]﹣4. 某企业利用含钽废渣(主要含、及油脂等)制备钽酸锂的工艺流程如下,已知:“钠盐和氧化物”中主要成分有、、等。下列分析正确的是
 A、通入空气的目的只是为了去油污 B、“滤渣I”中主要成分是 C、“沸腾炉焙烧”中发生的反应有 , 体现了两性氧化物的性质 D、流程中可循环的物质有5. 刚玉(主要成分为)硬度仅次于金刚石,常用于高级研磨材料,它( )A、是分子晶体 B、是共价化合物 C、可做铝热剂 D、熔融状态下能导电6. 下列物质应用错误的是A、可用于制作耐火材料 B、CuO可代替做打印机墨粉 C、波尔多液可用于农作物杀菌 D、可用于冷冻麻醉应急处理7. 室温下,取四根打磨后形状大小相同的镁条,通过下列实验探究镁在溶液中的反应。
A、通入空气的目的只是为了去油污 B、“滤渣I”中主要成分是 C、“沸腾炉焙烧”中发生的反应有 , 体现了两性氧化物的性质 D、流程中可循环的物质有5. 刚玉(主要成分为)硬度仅次于金刚石,常用于高级研磨材料,它( )A、是分子晶体 B、是共价化合物 C、可做铝热剂 D、熔融状态下能导电6. 下列物质应用错误的是A、可用于制作耐火材料 B、CuO可代替做打印机墨粉 C、波尔多液可用于农作物杀菌 D、可用于冷冻麻醉应急处理7. 室温下,取四根打磨后形状大小相同的镁条,通过下列实验探究镁在溶液中的反应。实验1 将镁条放入滴有酚酞的蒸馏水中,无明显现象,加热溶液,镁条表面产生气泡,溶液逐渐变红
实验2 将镁条放入滴有酚酞的1 溶液中,产生气泡,溶液逐渐变红
实验3 将镁条放入滴有酚酞的1溶液(pH≈7),产生气泡,溶液逐渐变红
实验4 将镁条放入滴有酚酞的1NaCl溶液中,产生气泡,溶液逐渐变红
下列基于相应实验现象得出的结论错误的是
A、实验1加热时发生反应的化学方程式为 B、实验2反应后的溶液中存在: C、实验3产生的气体中可能含 D、实验1和实验4表明对Mg与反应有催化作用8. 下列有关物质的性质与用途具有对应关系的是A、细铁粉具有还原性,可用作食品抗氧剂 B、NaHCO3受热易分解,可用于制胃酸中和剂 C、漂白粉在空气中不稳定,可用于漂白纸张 D、Al2O3是两性氧化物,可用作耐高温材料9. 宏观辨识与做观探析是化学学科核心素养之一,下列物质性质实验对应的反应方程式错误的是( )A、溶液中加入足量溶液产生白色沉淀: B、用饱和氨盐水和制备小苏打: C、以为原料由铝热反应冶炼铬: D、用硼酸中和溅在皮肤上的溶液:10. 化学创造美好生活。下列物质性质与用途的对应关系错误的是( )选项
物质性质
物质用途
A
小苏打能与碱反应
可用作抗酸药
B
熔点高
可用作耐高温材料
C
能吸收产生
可用作呼吸面具供氧剂
D
漂白粉具有强氧化性
可用于生活用水的消毒
A、A B、B C、C D、D11. 关于下列物质的用途的说法错误的是( )A、Al2O3熔点高,可作为耐高温材料 B、乙二醇可用于配制汽车防冻液 C、部分卤代烃可用作灭火剂 D、聚乙炔不可用作导电材料12. 下列由实验现象所得结论正确的是( )A、用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔,在酒精灯上加热,铝箔熔化但不滴落,证明铝的熔点很高 B、用pH试纸测得 溶液的pH约为9, 溶液的pH约为8,证明 酸性大于醋酸 C、向 溶液中滴入硫酸酸化的 溶液,溶液由浅绿色变为棕黄色,证明 的氧化性强于 D、取三支试管各加入等量的己烷、苯、甲苯,再分别加入几滴等量的酸性 溶液,微热,仅盛有甲苯的试管中溶液褪色,证明苯环能使甲基更易被氧化13. 下列有关物质的性质与用途具有对应关系的是( )A、晶体Si熔点高,可用作计算机芯片 B、NH4HCO3受热易分解,可用作氮肥 C、SO2具有还原性,可用于漂白纸浆 D、Al(OH)3能与酸反应,可用作抗胃酸药14. 下列说法错误的是A、能杀菌消毒,是一种食品添加剂 B、可作阻燃剂 C、是治疗胃酸的药剂 D、石墨烯是一种具有优异性能的新型材料15. 废易拉罐(含有Al和少量Fe、Mg杂质)制备明矾,分析流程,正确的是( ) A、为尽量少引入杂质,NaOH溶液应改用KOH或氨水 B、“沉淀”为Al2(CO3)3 C、上述流程中可用过量CO2代替NH4HCO3 D、滤渣的主要成分是Fe(OH)3和Mg(OH)216. 铝土矿的主要成分是Al2O3 , 还含有SiO2和Fe2O3等杂质,以铝土矿为原料制备铝的一种工艺流程如图:
A、为尽量少引入杂质,NaOH溶液应改用KOH或氨水 B、“沉淀”为Al2(CO3)3 C、上述流程中可用过量CO2代替NH4HCO3 D、滤渣的主要成分是Fe(OH)3和Mg(OH)216. 铝土矿的主要成分是Al2O3 , 还含有SiO2和Fe2O3等杂质,以铝土矿为原料制备铝的一种工艺流程如图:
已知:SiO2在“碱溶”时转化为铝硅酸钠沉淀。下列说法正确的是( )
A、“过滤I”所得的滤渣除铝硅酸钠外还有Fe(OH)3 B、向“过滤I”所得滤液中加入NaHCO3溶液,同时有沉淀和气体生成 C、“电解I”冶炼铝时可选用不锈钢材料做电极 D、通过“电解II”可实现NaOH和NaHCO3的循环利用17. 下列方案设计、现象和结论都正确的是( )目的
方案设计
现象和结论
A
比较金属铝和氧化铝熔点的高低
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
铝箔熔化但不滴落,说明金属铝的熔点比氧化铝低
B
检验某牙膏中是否存在甘油
取少量该牙膏样品于试管中,加适量蒸馏水,搅拌、静置,取上层清液,加入适量新制氢氧化铜,观察现象
若产生绛蓝色沉淀,则该牙膏中含甘油
C
检验乙醇的消去产物中有乙烯
将产生的气体通入酸性高锰酸钾溶液
若高锰酸钾褪色,则证明产物中有乙烯
D
检验Cu2O中是否含有Cu
取样,加入稀硝酸,观察现象
若有气泡产生,则说明样品中有Cu
A、A B、B C、C D、D18. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、NaCl(aq) Cl2(g) FeCl2(s) B、S(s) SO3(g) H2SO4(aq) C、MgCl2(aq) Mg(OH)2(s) MgO(s) D、N2(g) NH3(g) NO2二、非选择题
-
19. 碱式硫酸铝溶液可用于烟气脱硫。室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为
(2−x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1−x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
生成物(1−x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
(1)、制备碱式硫酸铝溶液时,维持反应温度和反应时间不变,提高x值的方法有。(2)、碱式硫酸铝溶液吸收SO2过程中,溶液的pH(填“增大”、“减小”、“不变”)。(3)、通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L−1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L−1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1−x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。
20.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4
 27H2O↑+10MgO+3Al2O3(1)、写出该化合物作阻燃剂的两条依据;(2)、用离子方程式表示除去固体产物中Al2O3的原理;(3)、已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理 .21. 硫酸镍广泛应用于电镀、电池等工业。以红土镍矿(主要成分为 , 含、、、、、、、等杂质)为原料制备,工艺流程如下。
27H2O↑+10MgO+3Al2O3(1)、写出该化合物作阻燃剂的两条依据;(2)、用离子方程式表示除去固体产物中Al2O3的原理;(3)、已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理 .21. 硫酸镍广泛应用于电镀、电池等工业。以红土镍矿(主要成分为 , 含、、、、、、、等杂质)为原料制备,工艺流程如下。
已知:①相关金属离子形成氢氧化物沉淀的范围如下:
金属离子
开始沉淀的
6.3
1.8
3.4
8.9
6.2
6.9
沉淀完全的
8.3
3.2
4.7
10.9
8.2
8.9
②当离子完全沉淀时,。
回答下列问题:
(1)、为提高“酸溶”中镍的浸出率,可采取的措施有(写一条即可)。“滤渣1”的主要成分为。(2)、写出“硫化除铜”过程中涉及反应的离子方程式、。(3)、“氧化除杂”中加入和的作用分别是 , 溶液的应调节为~6之间。(4)、“氟化除杂”中,若 , 取等体积的溶液加入体系中发生反应,则加入的溶液的浓度至少为。[已知](5)、称取硫酸镍晶体( , 摩尔质量)样品溶于水,配成溶液。量取用标准溶液滴定,反应为。重复三次,平均消耗EDTA标准溶液 , 则样品纯度为。22. 铬广泛应用于冶金、化工、航天等领域。工业上以铬铁矿(主要成分为 , 含有少量)为原料制备金属铬的工艺流程如图所示:
回答下列问题:
(1)、中为价,的化合价为 , “焙烧”中反应的化学方程式为。(2)、“沉铝”中所得滤渣的成分为 , 需控制的原因为。(3)、“酸化”中反应的离子方程式为 , 若该反应的平衡常数 , 已知:酸化”后溶液中 , 则溶液中。(4)、氧铬酸钙是一种常见含铬矿石,其立方晶胞如图所示。
①氧铬酸钙的化学式为。
②1个钙原子与个氧原子最近且等距离。
③该晶体密度为(列出计算式即可。已知和O的最近距离为 , 代表阿伏加德罗常数)
23. 硼砂的化学式为。利用硼镁矿(主要成分为)制取金属镁及粗硼的工艺流程为:
回答下列有关问题:
(1)、硼镁矿加入NaOH溶液后过滤得到的滤渣的主要成分为。(2)、硼砂中B的化合价为 , 溶于热水后,常用稀H2SO4调pH=2~3得到H3BO3 , 该反应的离子方程式为。(3)、需要在HCl氛围中加热,其目的是。(4)、Mg—H2O2酸性电池的反应机理为。则该电池的正极反应式为:;常温下,当电路中通过的电子的物质的量为0.08mol时,溶液的pH=6,此时(填“有”或“无”)Mg(OH)2沉淀析出。(已知①Ksp[Mg(OH)2]=5.6×10-12;②电解质溶液的体积为1L,忽略电解前后溶液体积的变化)(5)、制得的粗硼在一定条件下生成BI3 , BI3加热分解可以得到纯净的单质硼。现将0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol/LNa2S2O3(强碱弱酸盐)溶液滴定至终点,消耗Na2S2O3溶液16.00mL。盛装Na2S2O3溶液的仪器应为(填“酸式”或“碱式”)滴定管。该粗硼样品的纯度为(提示:)。24. 碳酸锂广泛应用于化工、冶金、陶瓷、医药、制冷、焊接、锂合金等行业。从煤粉灰(、、、等)中回收提取铝、锂元素的化合物的流程如图所示:
已知:碳酸锂的溶解度为(g/L)
温度/℃
0
10
20
30
40
50
60
80
100
1.54
1.43
1.33
1.25
1.17
1.08
1.01
0.85
0.72
(1)、如何提高酸浸速率?(任写一条)(2)、滤渣2的主要成分为;刚好沉淀完全的pH为。{已知: , 离子浓度≤时表示该离子沉淀完全}。(3)、从滤渣2中分离出 , 可用如图所示的方法,步骤1的离子方程式为。 (4)、“沉锂”的化学反应方程式为。(5)、“沉锂”中的“一系列操作”依次为、、洗涤、干燥,检验碳酸锂已经洗涤干净的方法为。25. 回答下列问题:(1)、Al(OH)3具有一元弱酸的性质,在水中电离时产生的含铝微粒具有正四面体结构,写出其电离方程式。(2)、卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示。
(4)、“沉锂”的化学反应方程式为。(5)、“沉锂”中的“一系列操作”依次为、、洗涤、干燥,检验碳酸锂已经洗涤干净的方法为。25. 回答下列问题:(1)、Al(OH)3具有一元弱酸的性质,在水中电离时产生的含铝微粒具有正四面体结构,写出其电离方程式。(2)、卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示。
TiF4的熔点比TiCl4熔点高很多的原因是。
26. 牙膏中的摩擦剂可以帮助我们去除牙垢,减轻牙结石。某化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行探究:(该牙膏摩擦剂由CaCO3、Al(OH)3组成,牙膏中的其它成分与NaOH和盐酸均不反应)(1)、I.摩擦剂中氢氧化铝的定性检验。取适量牙膏样品于烧杯中,加水充分搅拌后过滤,滤渣中加入过量NaOH溶液,过滤,向滤液中通入过量CO2有白色沉淀生成。在上述操作中,需要用到图中的实验仪器有(填选项)。
 (2)、氢氧化铝与NaOH溶液反应的离子方程式为。
(2)、氢氧化铝与NaOH溶液反应的离子方程式为。 (3)、装置A的作用是 , 反应结束后,还要持续通一段时间空气的目的是。(4)、下列各项措施中,能提高测定准确度的是(选填编号)。
(3)、装置A的作用是 , 反应结束后,还要持续通一段时间空气的目的是。(4)、下列各项措施中,能提高测定准确度的是(选填编号)。①把盐酸换成不具有挥发性的硫酸
②在A~B之间增添盛有浓硫酸的干燥装置
③滴加盐酸的速率不宜过快
④在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)、实验中准确称取6.0g样品三份,进行三次测定,测得生成BaCO3平均质量为1.97g。则样品中碳酸钙的质量分数为。(6)、有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,就可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是。27. 下图是以铝土矿(主要成分是 和少量 、 杂质)为原料制取铵明矾晶体 的一种工艺流程。
请回答:
(1)、试剂Ⅰ为 , 滤渣a可以“变废为宝”,写出它的一种用途。(2)、证明铁元素已除尽的实验方法是。(3)、滤液2中通入足量 进行酸化得到固体c,则生成固体c的离子方程式为。(4)、由溶液d制取铵明矾溶液的化学方程式为 , 从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、、、干燥(填操作名称)。28. 2020年比亚迪汉EV和特斯拉Model3均搭载了磷酸亚铁锂(LiFePO4)电池组。某企业设计了磷酸亚铁锂电池正极生产和回收的工艺流程如图:
已知:①Ksp[Fe(OH)3]=10-39;②Li2CO3的溶解度:0℃为1.54g,100为0.72g。
(1)、H3PO4和Li2CO3反应的化学方程式为。(2)、获得LiH2PO4晶体的分离操作是。(3)、写出一条可以提高“碱浸”效率的措施。(4)、向滤液1中加入过量CO2可得到白色胶状物质,该反应的离子方式为。(5)、“酸浸”时若用HNO3代替H2O2 , 缺点是 , 若“沉铁”后溶液中c(Fe3+)=10-6mol·L-1 , 则该过程应调节pH= , “沉锂”时,所得Li2CO3应选择(“冷水”或“热水”)进行洗涤。29. 是中学常见的几种化合物,相关物质间的转化关系如图所示:
已知: 是生活中常见的金属单质, 都是氧化物且A是红棕色粉末。回答下列问题:
(1)、单质X与A反应的化学方程式是。(2)、若试剂1和试剂2均为强电解质。①若试剂1为强碱,则试剂1与B反应的离子方程式为。
②若试剂1和试剂2为同种物质,则C溶液显(填“酸性”、“碱性”或“中性”)。
(3)、若试剂2是稀硝酸。①写出单质Y与稀硝酸反应生成E的离子方程式。
②可用于检验D的阳离子的试剂是。
30. 碳酸镍是制备合成纳米镍的一种前驱体。以镍废渣(主要成分为Ni,含少量Fe、Al、Fe3O4、Al2O3和不溶性杂质等)为原料获得碳酸镍流程如图:
回答下列问题:
(1)、“碱浸”时加入NaOH溶液的作用是。(2)、“操作A”的名称是。(3)、“酸浸”滤液中含有的阳离子主要为H+、。(4)、“转化”时加入H2O2的目的是(用离子方程式表示),该过程温度不宜过高,原因可能是。(5)、请写出“沉镍”时的离子方程式。(6)、若选用Na2CO3溶液“沉镍”,当溶液中总碳浓度[ c(C)T ]为0.1mol·L-1时,溶液中总镍浓度的对数[lgc(Ni)T]与溶液pH关系如图。注:c(C)T=c(CO )+c(HCO )+c(H2CO3)

①a点(pH≈8.2)时溶液中析出的沉淀主要为(填化学式)。
②b点溶液中Ni2+是否沉淀完全(填“是”或“否”)[溶液中总镍浓度c(Ni)T≤10-5mol·L-1时,Ni2+沉淀完全] 。
(7)、取“操作A”所得的NiSO4溶液VmL,用c mol·L-1 EDTA(Na2H2Y)的标准溶液滴定至终点(发生反应Ni2++H2Y2-=NiY2-+2H+),消耗标准液20.00 mL,则“沉镍”过程中,当NiCO3开始沉淀时,溶液中CO 浓度为。[已知常温下,Ksp(NiCO3)=1.42×10-7 , 只列计算式,不考虑杂质反应]。31. 甲、乙、丙三种不同的物质中均含有同一种元素,它们之间的转化关系如图示(部分反应物及生成物已略去)。 (1)、若甲为气态氢化物,乙为黄色固体,写出此时反应①的化学方程式。(2)、若甲为两性氧化物,乙的水溶液呈酸性,请用离子方程式写出乙的水溶液呈酸性的原因 , 写出此时反应④的离子方程式。(3)、若甲为金属单质,反应④为置换反应,则往乙溶液中滴加KSCN,溶液变为。(4)、若甲为气体单质,乙为含有极性共价键的非极性分子,请写出乙的电子式。32. 纳米氧化镁是在磁性、催化方面有许多特异功能的新材料,具有重要价值. 工业以菱镁矿(主要成分为 MgCO3 , 少量 FeCO3和 SiO2杂质)为原料制备纳米氧化镁工艺流程如下:
(1)、若甲为气态氢化物,乙为黄色固体,写出此时反应①的化学方程式。(2)、若甲为两性氧化物,乙的水溶液呈酸性,请用离子方程式写出乙的水溶液呈酸性的原因 , 写出此时反应④的离子方程式。(3)、若甲为金属单质,反应④为置换反应,则往乙溶液中滴加KSCN,溶液变为。(4)、若甲为气体单质,乙为含有极性共价键的非极性分子,请写出乙的电子式。32. 纳米氧化镁是在磁性、催化方面有许多特异功能的新材料,具有重要价值. 工业以菱镁矿(主要成分为 MgCO3 , 少量 FeCO3和 SiO2杂质)为原料制备纳米氧化镁工艺流程如下:试回答下列问题:
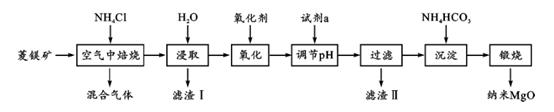 (1)、“焙烧”时生成的主要气体有 ;滤渣Ⅰ的主要成分为(2)、氧化剂常用空气或 H2O2而不选用酸性 KMnO4 , 解释其原因 .
(1)、“焙烧”时生成的主要气体有 ;滤渣Ⅰ的主要成分为(2)、氧化剂常用空气或 H2O2而不选用酸性 KMnO4 , 解释其原因 .已知在该条件下金属离子开始沉淀和完全沉淀的pH 如下:
金属离子
Fe2+
Fe3+
Mg2+
开始沉淀pH
6.3
1.5
8.9
完全沉淀pH
8.1
2.8
10.9
上述流程中“氧化”是否可省掉及理由是 .
(3)、试剂a可能是 .(4)、资料显示锻烧 MgCO3比锻烧 Mg(OH)2更容易生成 MgO 纳米材料. “沉淀”时若将NH4HCO3更换成 Na2CO3 , 则产生的后果是 .(5)、该流程中可以循环利用的物质是.33. 矿业废水中Al3+含量的测定和处理是环境保护的重要课题。(1)、向矿业废水中加入NaOH溶液至沉淀不再溶解,再加入一定量的NaHCO3溶液搅拌,反应生成丝钠铝石[NaAl(OH)2CO3]沉淀,过滤除去。写出加入NaHCO3溶液生成丝钠铝石沉淀的离子方程式:。(2)、为确定加入NaHCO3溶液的量,需测定矿业废水中Al3+的含量。工业上常采用EDTA络合滴定法,步骤如下:步骤1:CuSO4标准液的配制与标定。取一定量胆矾溶于水,加入适量稀H2SO4 , 转移到1 L容量瓶中定容。准确量取25.00 mL所配溶液置于250 mL锥形瓶中,用0.005 0 mol·L-1EDTA标准液滴定至终点。重复3次实验,平均消耗EDTA标准液10.00 mL 。
步骤2:样品分析。取10.00 mL矿业废水置于250 mL锥形瓶中,加入一定体积柠檬酸,煮沸;再加入0.005 0 mol·L-1的EDTA标准液20.00 mL,调节溶液pH至4.0,加热;冷却后用CuSO4标准液滴定至终点,消耗CuSO4标准液30.00 mL。(已知:Cu2+、Al3+与EDTA反应的化学计量比均为1∶1)
步骤1中,重复3次实验的目的是。
② Fe3+也可与EDTA反应,步骤2中加入的柠檬酸是作为掩蔽剂,消除Fe3+的干扰。若该矿业废水样品中含有Fe3+ , 而上述实验中未加入柠檬酸,则测定的Al3+含量将(填“偏大”“偏小”或“无影响”)。
③计算该矿业废水中Al3+的含量(用mg·L-1表示)(写出计算过程)。