高考二轮复习知识点:铝的化学性质
试卷更新日期:2023-07-29 类型:二轮复习
一、选择题
-
1. 下列说法错误的是( )A、 会破坏铝表面的氧化膜 B、 的热稳定性比 强 C、 具有氧化性,其稀溶液可用于消毒 D、钢铁在潮湿空气中生锈主要是发生了电化学腐蚀2. 下列有关物质的性质与用途具有对应关系的是( )A、铝的金属活泼性强,可用于制作铝金属制品 B、氧化铝熔点高,可用作电解冶炼铝的原料 C、氢氧化铝受热分解,可用于中和过多的胃酸 D、明矾溶于水并水解形成胶体,可用于净水3. 下列方程式不能准确解释相应实验现象的是( )A、酚酞滴入醋酸钠溶液中变为浅红色:CH3COO-+H2O⇌CH3COOH+OH- B、金属钠在空气中加热生成淡黄色固体:4Na+O2=2Na2O C、铝溶于氢氧化钠溶液,有无色气体产生:2Al+2OH-+2H2O=2 +3H2↑ D、将二氧化硫通入氢硫酸中产生黄色沉淀:SO2+2H2S=3S↓+2H2O4. 下列说法不正确的是( )A、硅酸钠是一种难溶于水的硅酸盐 B、镁在空气中燃烧可生成氧化镁和氮化镁 C、钠与水反应生成氢氧化钠和氢气 D、常温下,铝遇浓硝酸或浓硫酸时会发生钝化5. 下列有关化学反应的叙述正确的是( )A、室温下,Na在空气中反应生成Na2O2 B、室温下,Al与4.0 mol﹒L-1NaOH溶液反应生成NaAlO2 C、室温下,Cu与浓HNO3反应放出NO气体 D、室温下,Fe与浓H2SO4反应生成FeSO46. 向100mL1mol·L-1NH4Al(SO4)2溶液中逐滴加入1mol·L-1Ba(OH)2溶液。沉淀总物质的量n随加入Ba(OH)2溶液体积V的变化如图。下列说法错误的是
 A、沉淀质量:b点>a点>c点 B、a点到c点过程中,b点溶液中水的电离程度最小 C、a点离子浓度的大小关系为:[NH]>[SO]>[H+]>[OH-] D、b点到c点过程中,发生的离子方程式为:Al(OH)3+OH-=AlO+2H2O7. 下列反应的离子方程式错误的是A、次氯酸钠溶液中通入过量的二氧化碳: B、氢氧化铝溶于氢氧化钠溶液: C、过氧化钠与水反应: D、氯化银中滴加浓氨水:8. 劳动开创未来。下列劳动项目与所述的化学知识没有关联的是( )
A、沉淀质量:b点>a点>c点 B、a点到c点过程中,b点溶液中水的电离程度最小 C、a点离子浓度的大小关系为:[NH]>[SO]>[H+]>[OH-] D、b点到c点过程中,发生的离子方程式为:Al(OH)3+OH-=AlO+2H2O7. 下列反应的离子方程式错误的是A、次氯酸钠溶液中通入过量的二氧化碳: B、氢氧化铝溶于氢氧化钠溶液: C、过氧化钠与水反应: D、氯化银中滴加浓氨水:8. 劳动开创未来。下列劳动项目与所述的化学知识没有关联的是( )选项
劳动项目
化学知识
A
工人将模具干燥后再注入熔融钢水
铁与水蒸气高温下会反应
B
用墨汁绘制国画
常温下碳单质性质稳定
C
用含NaOH和Al粉的管道疏通剂疏通厨卫管道
NaOH与Al粉反应放热产生大量气体,且NaOH有一定腐蚀性
D
用富含淀粉的谷物酿酒
淀粉水解生成乙醇
A、A B、B C、C D、D9. 室温下,能完全溶解和反应后的固体混合物的试剂是A、稀 B、浓 C、溶液 D、浓10. 下列现象与所述的化学知识没有关联的是选项
现象
化学知识
A
工厂将模具干燥后再注入熔融钢水
铁与水高温下会反应
B
开发高端耐腐蚀镀铝钢板
铝能形成致密氧化膜
C
石蜡油加强热产生的气体使溴水褪色
气体中含有饱和烃
D
氧化铝用于制作耐高温材料
氧化铝熔点高
A、A B、B C、C D、D11. 去了膜的铝条放入硫酸铜溶液中,不可能观察到的现象A、金属表面有气泡 B、银白色金属转变为紫红色 C、出现蓝色沉淀 D、溶液蓝色变浅12. 化学与生产、生活、社会密切相关。下列有关说法中正确的是( )A、可用明矾使海水淡化来解决饮水危机 B、雾是一种气溶胶,能产生丁达尔现象 C、在日常生活中,造成钢铁腐蚀的主要原因是化学腐蚀 D、工业上运输浓硫酸可以使用铝制槽罐车,因为铝与浓硫酸常温下不反应13. 铝,氧化铝,氢氧化铝和可溶性铝盐与过量强碱溶液的反应,其生成物有一定的规律,下列说法中正确的是( )A、都有水生成 B、都有氢气生成 C、都有偏铝酸根生成 D、都有三价铝离子生成14. 五高并举,劳动先行。下列劳动项目涉及的化学知识正确的是( )选项
劳动项目
化学知识
A
用小苏打做蛋糕膨松剂
Na2CO3与酸反应产生气体
B
将新切土豆丝浸没在水里防止变色
土豆中的氧化性物质遇空气变色
C
煮豆浆点卤水制作豆腐
胶体聚沉
D
用铁质槽罐车运输浓硫酸
常温下,浓硫酸和铁不反应
A、A B、B C、C D、D15. 下列说法正确的是( )A、石墨转化为金刚石是化学变化 B、常温下,铁、铝与浓硫酸不发生反应 C、标准状况下,2.24LNO2中含有的氧原子的数目为0.2NA D、向硫酸铵溶液中加入氢氧化钡溶液。发生反应的离子方程式为Ba2++=BaSO4↓16. 劳动是光荣的。下列劳动项目所对应原理的化学方程式不正确的是( )选项
劳动项目
化学方程式
A
家务劳动:巧用食醋除水垢
2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O
B
社区服务:学习用小苏打烘焙糕点
NaHCO3+HCl=NaCl+H2O+CO2↑
C
工厂参观:工业生产漂白粉
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
D
自主探究:用含铝粉和氢氧化钠的疏通剂疏通管道
2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑
A、A B、B C、C D、D17. 中国空间站天和核心舱的主要能量来源是砷化镓(GaAs)太阳电池阵,其中Ga与Al同主族,化学性质相似。下列说法不正确的是( )A、砷化镓属于金属材料 B、GaAs中As的化合价是-3 C、镓既能与盐酸反应,又能与NaOH溶液反应 D、砷化镓电池能将光能转化为电能18. 下列转化不可能通过一步反应直接完成的是( )A、Al→Al2O3 B、Al2O3→Al(OH)3 C、Al(OH)3→AlO D、Al3+→Al(OH)319. 地壳中含量最丰富的元素是( )A、O B、Fe C、H D、Al20. 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )选项
实验
现象
结论
A
相同温度下,用 试纸测 溶液和 溶液的
测 溶液试纸显蓝色;测 溶液的试纸显深蓝色
相同温度下
B
取 和 完全反应后固体,溶于足量稀硫酸,滴加 溶液
溶液不变红
反应后固体中可能含有
C
将湿润的淀粉- 试纸放入含有红棕色气体的集气瓶中
试纸变蓝
该气体为 ,具有氧化性
D
将少量 加水溶解后,滴加稀硫酸酸化,再滴加 溶液
溶液呈血红色
已变质
A、A B、B C、C D、D二、多选题
-
21. 下列实验、实验现象和相应结论都正确的是( )
实验
现象
结论
A
向1mL FeCl3溶液中滴加1mLKI溶液,再加入1mLCCl4 , 振荡后静置。
溶液分层,上层溶液显紫色。
氧化性:Fe3+>I2
B
将两块表面积相等的Mg条和Al条放入同浓度同体积的NaOH溶液中。
Al条产生气泡的速度快。
金属性:Al>Mg
C
向烧杯中加入一定体积蒸馏水,加热至沸腾时,向其中逐滴滴加饱和FeCl3溶液。
得到红褐色透明液体。
制得了氢氧化铁胶体。
D
向盛有10 mL溴水的分液漏斗中加入10mL苯,振荡、静置。
溶液分为两层,上层为橙色。
溴在苯中的溶解能力大于水中。
A、A B、B C、C D、D三、非选择题
-
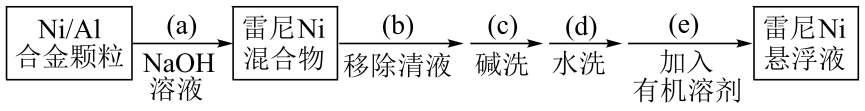
22. 金属对有强吸附作用,被广泛用于硝基或羰基等不饱和基团的催化氢化反应,将块状转化成多孔型雷尼后,其催化活性显著提高。
已知:①雷尼暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;
②邻硝基苯胺在极性有机溶剂中更有利于反应的进行。
某实验小组制备雷尼并探究其催化氢化性能的实验如下:
步骤1:雷尼的制备
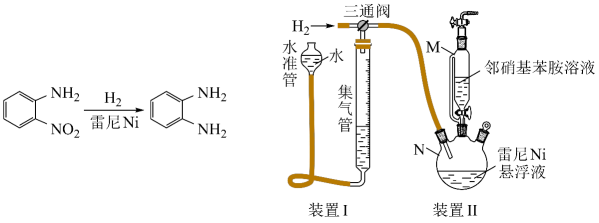
步骤2:邻硝基苯胺的催化氢化反应
反应的原理和实验装置图如下(夹持装置和搅拌装置略)。装置Ⅰ用于储存和监测反应过程。
回答下列问题:
(1)、操作(a)中,反应的离子方程式是;(2)、操作(d)中,判断雷尼被水洗净的方法是;(3)、操作(e)中,下列溶剂中最有利于步骤2中氢化反应的是____;A、丙酮 B、四氯化碳 C、乙醇 D、正己烷(4)、向集气管中充入时,三通阀的孔路位置如下图所示:发生氢化反应时,集气管向装置Ⅱ供气,此时孔路位置需调节为; (5)、仪器M的名称是;(6)、反应前应向装置Ⅱ中通入一段时间,目的是;(7)、如果将三颈瓶N中的导气管口插入液面以下,可能导致的后果是;(8)、判断氢化反应完全的现象是。23. 粉煤灰是火电厂的大宗固废。以某电厂的粉煤灰为原料(主要含和等)提铝的工艺流程如下:
(5)、仪器M的名称是;(6)、反应前应向装置Ⅱ中通入一段时间,目的是;(7)、如果将三颈瓶N中的导气管口插入液面以下,可能导致的后果是;(8)、判断氢化反应完全的现象是。23. 粉煤灰是火电厂的大宗固废。以某电厂的粉煤灰为原料(主要含和等)提铝的工艺流程如下:
回答下列问题:
(1)、“浸出”时适当升温的主要目的是 , 发生反应的离子方程式为。(2)、“浸渣”的主要成分除残余外,还有。实验测得,粉煤灰(的质量分数为)经浸出、干燥后得到“浸渣”(的质量分数为),的浸出率为。(3)、“沉铝”时,体系中三种物质的溶解度曲线如下图所示,加入沉铝的目的是 , “沉铝”的最佳方案为。 (4)、“焙烧”时,主要反应的化学方程式为。(5)、“水浸”后得到的“滤液2”可返回工序循环使用。24. 化学是一门实用性很强的科学,请根据题意填空:(1)、铝制餐具不宜长时间存放酸性、碱性食物,但常温下铝制容器可以盛装(填“浓硫酸”或“浓盐酸”)。(2)、我国5G通信技术处于世界领先地位,高速通信离不开光导纤维。用于制造光导纤维的基本原料是(填“SiO2”或“Na2SiO3”)。(3)、在汽车排气管上安装催化转化装置,可使尾气中的NO和CO反应转化为无污染的物质。请完成一定条件该反应的化学方程式:2CO+2NO2CO2 +。25. 一种从废弃催化剂(主要含、及、等)中回收钛、钒的工艺流程如下图所示:
(4)、“焙烧”时,主要反应的化学方程式为。(5)、“水浸”后得到的“滤液2”可返回工序循环使用。24. 化学是一门实用性很强的科学,请根据题意填空:(1)、铝制餐具不宜长时间存放酸性、碱性食物,但常温下铝制容器可以盛装(填“浓硫酸”或“浓盐酸”)。(2)、我国5G通信技术处于世界领先地位,高速通信离不开光导纤维。用于制造光导纤维的基本原料是(填“SiO2”或“Na2SiO3”)。(3)、在汽车排气管上安装催化转化装置,可使尾气中的NO和CO反应转化为无污染的物质。请完成一定条件该反应的化学方程式:2CO+2NO2CO2 +。25. 一种从废弃催化剂(主要含、及、等)中回收钛、钒的工艺流程如下图所示:
回答下列问题:
(1)、操作①的名称是 , 废弃催化剂碱浸前需要粉碎的目的是。(2)、已知的化学性质与氧化铝相似,则“碱浸”过程中发生反应的离子方程式为。(3)、沉淀的主要成分是、(填化学式),“调节”时,硫酸用量不能过多,否则可能造成的结果是。(4)、在焙烧时,气体产物经过与(填化学式)反应后,可以在生产流程中循环利用。(5)、工业上另一种提钒的方法为草酸法,利用在酸性条件下与二元弱酸反应,得到含有的浸取液,则该反应的离子方程式为。(6)、整个流程钛元素的损耗率为 , 若取1吨废弃催化剂,理论上最多能得到的质量为吨。(保留1位有效数字)26. 瑞尼镍是一种多孔活性金属镍,某兴趣小组用瑞尼镍作催化剂制取氢化肉桂酸:
已知:①金属镍(Ni)常温难以被氧气氧化;
②瑞尼镍孔隙会吸附大量氢气而活化,活化的瑞尼镍接触空气易自燃。
实验步骤如下:
I.制取瑞尼镍:在烧杯中加入浓NaOH溶液,在冰水浴中分批加入铝镍合金(1:1),不断搅拌,充分反应后,分离得到瑞尼镍,保存于无水乙醇中。
II.用如图装置(夹持、搅拌及加热装置省略)制取氢化肉桂酸,步骤如下:

①检查装置气密性,往三颈烧瓶中加入ag肉桂酸、一定量乙醇和I中制得的瑞尼镍。
②通过反复抽气与充气将装置内空气替换成氢气,关闭K3、K2 , 打开K1 , 充入氢气至储氢筒充满氢气,……
③搅拌并加热三颈烧瓶,充分反应后分离出氢化肉桂酸。
回答以下问题:
(1)、铝镍合金与NaOH溶液反应的化学方程式为。(2)、制取瑞尼镍的有关说法错误的是_______。A、该反应为放热反应 B、合金中铝含量过低会减少瑞尼镍的孔隙数量 C、分离得到活性瑞尼镍的方法:过滤 D、检验活性瑞尼镍的方法:取少量样品,用滤纸吸干表面的乙醇,放置于空气中,观察现象(3)、将步骤②的操作补充完整:。(4)、三颈烧瓶加热的方式为。反应过程中,保持长颈漏斗中液面始终高于储氢筒内液面较多的目的:将储氢筒内的氢气压入三颈烧瓶、。判断反应已充分进行的现象为。(5)、若参加反应的氢气体积为bmL(标准状况),则氢化肉桂酸的产率为。(用含a、b的代数式)(6)、从三颈烧瓶中分离出瑞尼镍,得到混合液。从混合液中回收乙醇的操作方法是。27. LiNiO2是目前在锂离子电池中得到较广泛应用的一种正极材料,因其价格较为昂贵,故回收再用意义十分重大。一种以共沉淀法从废旧电池中回收并制备超细LiNiO2的工业流程如下图所示:
回答下列问题:
(1)、正极材料粉碎的目的是。(2)、DMF溶液无法溶解的铝单质可以用浓NaOH溶液溶解后再回收利用,写出溶解铝反应的离子反应方程式。(3)、除C的方法可以是加入浓硝酸与过氧化氢的混合溶液,控制温度95℃,此时C与浓硝酸发生反应的化学方程式是;也可以常温加入稀硫酸与过氧化氢的混合溶液,将LiNiO2变为镍锂溶液然后通过(填分离方法除去C,与前者相比,通过比较反应产物来说明后者主要优点为.;试回答能否以盐酸代替硫酸并说明理由(回答“能”或“不能”并简要说明原因)。(4)、高温煅烧得到1mol超细LiNiO2所转移的电子数目为。28. 碱式氧化镍(NiOOH)可作镍电池的正极材料,现用某废镍原料(主要含Ni、Al、SiO2 , 少量Cr、FeS等)来制备,其工艺流程如下: 回答下列问题:(1)、“碱浸”时,发生反应的离子反应方程式① , ②。(2)、已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
回答下列问题:(1)、“碱浸”时,发生反应的离子反应方程式① , ②。(2)、已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:开始沉淀的pH
完全沉淀的pH
Ni2+
6.2
8.6
Fe2+
7.6
9.1
Fe3+
2.3
3.3
Cr3+
4.5
5.6
“调pH 1”时,主要除去的离子是 , 溶液pH范围。
(3)、在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式。(4)、在酸性溶液中CrO 可以转化成Cr2O ,用离子方程式表示该转化反应 , 已知BaCrO4的Ksp=1.2×10-10 , 要使溶液中CrO 沉淀完全(c(CrO )≤1×10-5mol·L-1),溶液中钡离子浓度至少为mol·L-1。29. 硅铝合金广泛应用于航空、交通、建筑、汽车等行业。完成下列填空:
(1)、硅原子的结构示意图为;比较硅铝的原子半径:r(Si)r(Al)(选填:“>”、“<”或“=”)。硅铝合金中的铝与氢氧化钠溶液反应的化学方程式为。(2)、氟化铝和氯化铝的熔点分别为1040 和194 ,它们熔点差异大的原因可能是。(3)、门捷列夫准确预测了铝、硅下一周期的同主族元素(当时并未被发现)的性质,并将他们分别命名为“类铝”和“类硅”。你据此推断类铝的最外层电子排布式为 , 推断的依据是。(4)、制备硅铝合金时,在高温真空炉中发生如下反应:; ;
上述反应的最终还原产物为;当有1mol C参加反应时,转移的电子数目为。
30. 以废旧磷酸亚铁锂正极材料(主要成分为LiFePO4 , 含炭黑、铝等杂质)为原料可制备LiOH溶液和FePO4。 (1)、“除铝”时反应的离子方程式为。(2)、试从沉淀溶解平衡移动的角度解释“浸取时加入H2O2、稀盐酸”可促进LiFePO4溶解的原因:。(3)、“浸取”所得滤液中,磷元素的存在形式主要是(填字母)。
(1)、“除铝”时反应的离子方程式为。(2)、试从沉淀溶解平衡移动的角度解释“浸取时加入H2O2、稀盐酸”可促进LiFePO4溶解的原因:。(3)、“浸取”所得滤液中,磷元素的存在形式主要是(填字母)。a. PO b. H3PO4 c. H2PO
(4)、“沉铁”时铁、磷的沉淀率随溶液pH的变化如图1所示。pH>2.5后磷元素的沉淀率逐渐下降,原因是。 (5)、“电解”制备LiOH的原理如图2所示,装置中使用阳离子交换膜将电解槽隔成阳极室和阴极室的目的是。(6)、LiOH和(NH4)2Fe(SO4)2、H3PO4反应得到LiFePO4、NH4HSO4。写出该反应的化学方程式:。31. Pd/Al2O3是常见的汽车尾气催化剂。一种从废Pd/Al2O3纳米催化剂(主要成分及含量:Pd 0.3%,γ-Al2O3 92.8%,其他杂质6.g%)中回收金属Pd的工艺如下:
(5)、“电解”制备LiOH的原理如图2所示,装置中使用阳离子交换膜将电解槽隔成阳极室和阴极室的目的是。(6)、LiOH和(NH4)2Fe(SO4)2、H3PO4反应得到LiFePO4、NH4HSO4。写出该反应的化学方程式:。31. Pd/Al2O3是常见的汽车尾气催化剂。一种从废Pd/Al2O3纳米催化剂(主要成分及含量:Pd 0.3%,γ-Al2O3 92.8%,其他杂质6.g%)中回收金属Pd的工艺如下:
已知:γ-Al2O3能与酸反应,α-Al2O3不与酸反应。
回答下列问题:
(1)、“预处理”时,γ-Al2O3经焙烧转化为α-Al2O3 , 该操作的主要目的是 。(2)、“酸浸”时,Pd转化为PdCl42- , 其离子方程式为 。(3)、“滤液①”和“滤液②”中都含有的主要溶质有(填化学式)。(4)、“粗Pd”溶解时,可用稀HNO3替代NaClO3 , 但缺点是。两者相比,(填化学式)的氧化效率更高(氧化效率以单位质量得到的电子数表示)。(5)、“沉淀”时,[Pd(NH3)4]2+转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为。(6)、酸性条件下,BrO3-能在负载Pd/Al2O3纳米催化剂的电极表面快速转化为Br-。①发生上述转化反应的电极应接电源的极(填“正”或“负”);
②研究表明,电流密度越大,电催化效率越高;但当电流密度过大时,该电极会发生副反应生成(填化学式)。
32. 四氧化三锰(Mn3O4)广泛应用于生产软磁材料、催化材料制备领域。一种以低品位锰矿(含MnCO3、Mn2O3、MnOOH及少量Fe2O3、Al2O3、SiO2)为原料生产Mn3O4的工艺流程如图:
已知:(NH4)2SO4 NH3↑+NH4HSO4
回答下列问题:
(1)、MnOOH中Mn的化合价为。(2)、“溶浸”中H2O2的作用是。(3)、“滤渣2”的主要成分有。(4)、“母液”溶质的主要成分是 , 循环利用该物质的方案是。(5)、氧化”时,将固体加入水中,70℃水浴加热,通空气氧化,将固体全部转化为Mn3O4。Mn(OH)2生成Mn3O4的化学方程式为。反应后溶液pH(填“增大”、“减小”或“不变”)。33. KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐( 主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题: (1)、请写出镓(与铝同主族的第四周期元素)的原子结构示意图。(2)、为尽量少引入杂质,试剂①应选用(填标号)。理由是。
(1)、请写出镓(与铝同主族的第四周期元素)的原子结构示意图。(2)、为尽量少引入杂质,试剂①应选用(填标号)。理由是。A.HCl溶液
B.H2SO4 溶液
C.氨水
D.NaOH溶液
(3)、沉淀B的化学式为;将少量明矾溶于水,溶液呈弱酸性,其原因是(用离子方程式表示)。(4)、科学研究证明NaAlO2 在水溶液中实际上是Na[Al(OH)4](四羟基合铝酸钠),易拉罐溶解过程中主要反应的化学方程式为。(5)、常温下,等pH的NaAlO2 和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=。(6)、已知室温下,Kw=10×10-14 , Al(OH)3 AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于。
-