高考二轮复习知识点:碱金属的性质
试卷更新日期:2023-07-29 类型:二轮复习
一、选择题
-
1. Li电池使用过程中会产生LiH,对电池的性能和安全性带来影响。可用D2O与LiH进行反应测定LiH含量,由产物中的n(D2)/n(HD)比例可推算n(Li)/n(LiH)。
已知:①2LiH⇌2Li+H2 △H>0
②LiH+H2O=LiOH+H2↑
下列说法错误的是( )
A、H2O、D2O的化学性质基本相同 B、Li与D2O反应的方程式是2Li+2D2O=2LiOD+D2↑ C、n(D2)/n(HD)比例小说明n(Li)/n(LiH)比例大 D、80℃下的n(D2)/n(HD)大于25℃下的n(D2)/n(HD)2. 实验室中下列做法错误的是( )A、用冷水贮存白磷 B、用浓硫酸干燥二氧化硫 C、用酒精灯直接加热蒸发皿 D、用二氧化碳灭火器扑灭金属钾的燃烧3. 我国“人造太阳”创世界新纪录、“奋斗者”号载人潜水器成功坐底、“深海一号”母船助力深潜科考、北斗卫星导航系统全面开通,均展示了我国科技发展的巨大成就。下列相关叙述错误的是A、在“人造太阳”中发生核聚变的H、H是H的同位素 B、“奋斗者”号载人潜水器球壳所使用的钛合金能承受深海高压 C、“深海一号”母船海水浸泡区的铝基牺牲阳极可保障船体不易腐蚀 D、“北斗卫星”的授时系统“星载铷钟”中铷元素的单质遇水能缓慢反应放出H24. 金属表面的电子在光线照射下逸出产生电流的现象称为光电效应。以下碱金属中最容易发生光电效应的是( )A、Na B、K C、Rb D、Cs5. 下列所示的实验方案正确,且能达到实验目的的是( )选项
实验目的
实验方案
A
比较镁、铝的金属性强弱
分别在MgCl2和AlCl3溶液中滴加氨水直至过量,观察现象
B
比较Cl2、Br2的氧化性强弱
将少量氯水滴入FeBr2溶液中,观察现象
C
证明SO2具有漂白性
将SO2通入酸性高锰酸钾溶液中,溶液褪色
D
证明电离常数Ka:HSO3->HCO3-
测得同浓度的Na2CO3溶液的pH大于Na2SO3溶液
A、A B、B C、C D、D6. 下列图示与对应的叙述相符的是( )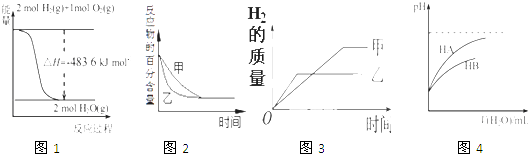 A、图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol﹣1 B、图2表示压强对可逆反应2A(g)+2 B(g)⇌3C(g)+D(s)的影响,乙的压强比甲的压强大 C、图3表示等质量的钾、钠分别与足量水反应,则甲为钠 D、图4表示常温下,稀释HA,HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH7. 化学实验中颜色变化丰富多彩。下列说法错误的是A、向固体中加入适量水后,用试纸检验,试纸变红 B、向无色的淀粉溶液中滴加适量氯水,溶液变成蓝色 C、向滴有酚酞的水中加入一块绿豆粒大的钾,溶液显红色 D、向溶液中滴加几滴溶液,溶液变成红色8. 下列说法正确的是A、有单质生成的化学反应一定是氧化还原反应 B、溶于水,在通电条件下才能发生电离 C、和由相同种类的元素组成,互为同素异形体 D、随着原子序数递增,碱金属单质的熔点、沸点依次降低9. 金属钾在空气中燃烧的产物有过氧化钾和超氧化钾(KO2),超氧化钾的电子式为
A、图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol﹣1 B、图2表示压强对可逆反应2A(g)+2 B(g)⇌3C(g)+D(s)的影响,乙的压强比甲的压强大 C、图3表示等质量的钾、钠分别与足量水反应,则甲为钠 D、图4表示常温下,稀释HA,HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH7. 化学实验中颜色变化丰富多彩。下列说法错误的是A、向固体中加入适量水后,用试纸检验,试纸变红 B、向无色的淀粉溶液中滴加适量氯水,溶液变成蓝色 C、向滴有酚酞的水中加入一块绿豆粒大的钾,溶液显红色 D、向溶液中滴加几滴溶液,溶液变成红色8. 下列说法正确的是A、有单质生成的化学反应一定是氧化还原反应 B、溶于水,在通电条件下才能发生电离 C、和由相同种类的元素组成,互为同素异形体 D、随着原子序数递增,碱金属单质的熔点、沸点依次降低9. 金属钾在空气中燃烧的产物有过氧化钾和超氧化钾(KO2),超氧化钾的电子式为 , 简写成KO2;KO2与Na2O2的性质相似,与H2O、CO2都能发生反应,与水反应的方程式为4KO2+2H2O=4KOH+3O2↑。下列有关KO2的说法,不正确的是( ) A、KO2属于离子化合物,含有离子键和共价键 B、与水反应,KO2既是氧化剂又是还原剂 C、与CO2反应,产物是K2CO3和O2 D、与水反应,若生成1molO2 , 则有2mole-发生转移10. 铯与钠位于同一主族,下列对铯的性质预测不正确的是( )A、铯能与水剧烈反应 B、少量的铯可以保存在煤油中 C、硝酸铯是共价化合物 D、铯比钾的金属性强11. 下列说法不正确的是( )A、在多电子原子中,电子的能量是不相同的,离核较近的区域内运动的电子能量较低 B、已知第117号元素的原子最外层电子数是7,则该元素位于第七周期第ⅦA族 C、在周期表中金属与非金属的分界处可以找到半导体材料 D、碱金属元素的化学性质相似,都能在加热条件下与氧气反应生成过氧化物12. 下列说法正确的是( )A、卤素单质均能与水发生:的反应 B、碱金属在空气中加热均生成 C、碱金属单质与水反应均浮在水面上 D、卤素单质与反应均生成13. 下列元素中,失电子能力最强的元素是( )A、K B、Na C、Li D、H14. 下列关于的叙述错误的是( )A、金属性最强的是 B、在自然界中均以化合态形式存在 C、它们的氧化物都只有和两种形式 D、形成的离子中氧化性最强的是锂离子15. 中国化学会遴选了118名青年化学家作为“元素代言人”,组成“中国青年化学家元素周期表”。第37号元素铷(Rb)由清华大学张如范代言。下列说法正确的是( )A、铷位于周期表的第四周期第IA族 B、氢氧化铷属于弱碱 C、与钠的单质相比,铷的单质熔点更低 D、硝酸铷属于共价化合物16. 下列关于碱金属和卤族元素的叙述中正确的是( )A、随着核电荷数的增加,碱金属单质的密度逐渐减小 B、随着核电荷数的增加,卤素单质的熔、沸点逐渐降低 C、随着核电荷数的增加,碱金属单质与水反应越来越剧烈 D、随着核电荷数的增加,卤素单质与氢气化合越来越容易17. 下列说法中正确的是( )A、第IA族的元素都是碱金属元素 B、鉴别碳酸钠与碳酸氢钠可以选用氢氧化钙 C、向氯化铝溶液中加入过量氨水,可制得氢氧化铝 D、铝易与氧气反应生成氧化铝,说明铝片不能在空气中稳定存在18. 下列有关钾及钾的化合物叙述错误的是( )A、钾及钾的化合物灼烧时均会发出紫色的火焰 B、 受热易分解产生 C、金属钾燃烧时生成氧化钾 D、金属钾可保存在煤油中19. 下列关于碱金属的叙述中,错误的是( )A、钾元素比钠元素的金属性强 B、碱金属随着原子序数增大,与水反应越剧烈 C、碱金属的化学性质完全相同 D、碱金属的熔点随着电子层数的增加而降低20. 下列有关碱金属元素的说法中,正确的是( )A、与水反应都能生成碱和氢气 B、碱金属的单质具有强还原性,可置换出硫酸铜溶液中的铜单质 C、与氧气反应都能生成过氧化物 D、随核电荷数的增加,碱金属元素单质的熔沸点都逐渐增大21. 下列有关物质的性质与用途具有对应关系的是( )A、SO2具有氧化性,可用于漂白纸浆 B、碱金属元素发生焰色反应,可用于制造烟花 C、NH4HCO3受热易分解,可用作氮肥 D、Fe2(SO4)3易溶于水,可用作净水剂22. 下列实验中 , 不能观察到明显变化的是( )A、把Cl2通入FeCl2溶液中 B、把绿豆大的钾投入少量水中 C、把溴水滴加到淀粉KI溶液中 D、把一段打磨过的铝条放入少量冷水中23. 下列有关说法错误的是( )A、淀粉、纤维素、蛋白质属于天然高分子化合物,均可水解 B、可用二氧化碳灭火器扑灭金属钾的燃烧 C、脱氧核苷酸分子间脱水形成磷酯键后聚合成DNA单链 D、酒精、苯酚溶液、四氯化碳、己烯、甲苯五种无色液体可用溴水区分24. 借助碱金属和卤族元素性质的递变性分析下面的推断,其中正确的是( )A、已知Ca是第四周期第ⅡA族元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱 B、已知As是第四周期第ⅤA族元素,故AsH3的稳定性比NH3的稳定性强 C、已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈 D、已知Cl的核电荷数比F的核电荷数多,故Cl的原子半径比F的原子半径大25. 由于锂电池的需求急剧增长,全球陷入锂资源“争夺战”。下列有关锂的说法正确的是( )A、电解 熔盐可制取金属 B、 与 反应能生成 C、 、 及海水构成的电池中, 为电池正极 D、 的原子半径是第二周期所有主族元素中原子半径最小的26. 下列关于金属的说法正确的是( )A、钠与氧气反应时,产物是由氧气的用量决定的 B、铝箔在空气中受热可以熔化滴落 C、铜可以在加热的条件下和氧气反应,生成氧化铜 D、铁与水蒸气反应的产物是黑色的Fe2O327. 关于碱金属元素的下列叙述中,错误的是( )A、碱金属元素原子最外层都只有1个电子 B、随电子层数增加,原子半径增大,金属还原性增强 C、随核电荷数递增,氢氧化物碱性增强 D、Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大28. 钠和铯都是碱金属元素,下列关于铯及其化合物的叙述中正确的是( )A、铯的密度比水小,像钠一样浮在水面上 B、铯与水反应十分剧烈,甚至会发生爆炸 C、碳酸铯加热时易分解成二氧化碳和氧化铯 D、氢氧化铯是强碱,其碱性比氢氧化钾弱29. 下列叙述中,金属A的活泼性肯定比金属B的活泼性强的是( )A、1mol A 从酸中置换H+生成的H2比1 mol B从酸中置换H+生成的H2多 B、常温时,A能从水中置换出氢,而B不能 C、A原子的最外层电子数比B原子的最外层电子数少 D、A原子电子层数比B原子的电子层数多
, 简写成KO2;KO2与Na2O2的性质相似,与H2O、CO2都能发生反应,与水反应的方程式为4KO2+2H2O=4KOH+3O2↑。下列有关KO2的说法,不正确的是( ) A、KO2属于离子化合物,含有离子键和共价键 B、与水反应,KO2既是氧化剂又是还原剂 C、与CO2反应,产物是K2CO3和O2 D、与水反应,若生成1molO2 , 则有2mole-发生转移10. 铯与钠位于同一主族,下列对铯的性质预测不正确的是( )A、铯能与水剧烈反应 B、少量的铯可以保存在煤油中 C、硝酸铯是共价化合物 D、铯比钾的金属性强11. 下列说法不正确的是( )A、在多电子原子中,电子的能量是不相同的,离核较近的区域内运动的电子能量较低 B、已知第117号元素的原子最外层电子数是7,则该元素位于第七周期第ⅦA族 C、在周期表中金属与非金属的分界处可以找到半导体材料 D、碱金属元素的化学性质相似,都能在加热条件下与氧气反应生成过氧化物12. 下列说法正确的是( )A、卤素单质均能与水发生:的反应 B、碱金属在空气中加热均生成 C、碱金属单质与水反应均浮在水面上 D、卤素单质与反应均生成13. 下列元素中,失电子能力最强的元素是( )A、K B、Na C、Li D、H14. 下列关于的叙述错误的是( )A、金属性最强的是 B、在自然界中均以化合态形式存在 C、它们的氧化物都只有和两种形式 D、形成的离子中氧化性最强的是锂离子15. 中国化学会遴选了118名青年化学家作为“元素代言人”,组成“中国青年化学家元素周期表”。第37号元素铷(Rb)由清华大学张如范代言。下列说法正确的是( )A、铷位于周期表的第四周期第IA族 B、氢氧化铷属于弱碱 C、与钠的单质相比,铷的单质熔点更低 D、硝酸铷属于共价化合物16. 下列关于碱金属和卤族元素的叙述中正确的是( )A、随着核电荷数的增加,碱金属单质的密度逐渐减小 B、随着核电荷数的增加,卤素单质的熔、沸点逐渐降低 C、随着核电荷数的增加,碱金属单质与水反应越来越剧烈 D、随着核电荷数的增加,卤素单质与氢气化合越来越容易17. 下列说法中正确的是( )A、第IA族的元素都是碱金属元素 B、鉴别碳酸钠与碳酸氢钠可以选用氢氧化钙 C、向氯化铝溶液中加入过量氨水,可制得氢氧化铝 D、铝易与氧气反应生成氧化铝,说明铝片不能在空气中稳定存在18. 下列有关钾及钾的化合物叙述错误的是( )A、钾及钾的化合物灼烧时均会发出紫色的火焰 B、 受热易分解产生 C、金属钾燃烧时生成氧化钾 D、金属钾可保存在煤油中19. 下列关于碱金属的叙述中,错误的是( )A、钾元素比钠元素的金属性强 B、碱金属随着原子序数增大,与水反应越剧烈 C、碱金属的化学性质完全相同 D、碱金属的熔点随着电子层数的增加而降低20. 下列有关碱金属元素的说法中,正确的是( )A、与水反应都能生成碱和氢气 B、碱金属的单质具有强还原性,可置换出硫酸铜溶液中的铜单质 C、与氧气反应都能生成过氧化物 D、随核电荷数的增加,碱金属元素单质的熔沸点都逐渐增大21. 下列有关物质的性质与用途具有对应关系的是( )A、SO2具有氧化性,可用于漂白纸浆 B、碱金属元素发生焰色反应,可用于制造烟花 C、NH4HCO3受热易分解,可用作氮肥 D、Fe2(SO4)3易溶于水,可用作净水剂22. 下列实验中 , 不能观察到明显变化的是( )A、把Cl2通入FeCl2溶液中 B、把绿豆大的钾投入少量水中 C、把溴水滴加到淀粉KI溶液中 D、把一段打磨过的铝条放入少量冷水中23. 下列有关说法错误的是( )A、淀粉、纤维素、蛋白质属于天然高分子化合物,均可水解 B、可用二氧化碳灭火器扑灭金属钾的燃烧 C、脱氧核苷酸分子间脱水形成磷酯键后聚合成DNA单链 D、酒精、苯酚溶液、四氯化碳、己烯、甲苯五种无色液体可用溴水区分24. 借助碱金属和卤族元素性质的递变性分析下面的推断,其中正确的是( )A、已知Ca是第四周期第ⅡA族元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱 B、已知As是第四周期第ⅤA族元素,故AsH3的稳定性比NH3的稳定性强 C、已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈 D、已知Cl的核电荷数比F的核电荷数多,故Cl的原子半径比F的原子半径大25. 由于锂电池的需求急剧增长,全球陷入锂资源“争夺战”。下列有关锂的说法正确的是( )A、电解 熔盐可制取金属 B、 与 反应能生成 C、 、 及海水构成的电池中, 为电池正极 D、 的原子半径是第二周期所有主族元素中原子半径最小的26. 下列关于金属的说法正确的是( )A、钠与氧气反应时,产物是由氧气的用量决定的 B、铝箔在空气中受热可以熔化滴落 C、铜可以在加热的条件下和氧气反应,生成氧化铜 D、铁与水蒸气反应的产物是黑色的Fe2O327. 关于碱金属元素的下列叙述中,错误的是( )A、碱金属元素原子最外层都只有1个电子 B、随电子层数增加,原子半径增大,金属还原性增强 C、随核电荷数递增,氢氧化物碱性增强 D、Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大28. 钠和铯都是碱金属元素,下列关于铯及其化合物的叙述中正确的是( )A、铯的密度比水小,像钠一样浮在水面上 B、铯与水反应十分剧烈,甚至会发生爆炸 C、碳酸铯加热时易分解成二氧化碳和氧化铯 D、氢氧化铯是强碱,其碱性比氢氧化钾弱29. 下列叙述中,金属A的活泼性肯定比金属B的活泼性强的是( )A、1mol A 从酸中置换H+生成的H2比1 mol B从酸中置换H+生成的H2多 B、常温时,A能从水中置换出氢,而B不能 C、A原子的最外层电子数比B原子的最外层电子数少 D、A原子电子层数比B原子的电子层数多二、非选择题
-
30. 锂是最轻的活泼金属,其单质及其化合物有广泛的用途。回答下列问题:(1)、用碳酸锂和反应可制备氯化锂,工业上可由电解LiCl-KCl的熔融混合物生产金属锂,阴极上的电极反应式为。(2)、不可使用二氧化碳灭火器扑灭因金属锂引起的火灾,其原因是。(3)、硬脂酸锂是锂肥皂的主要成分,可作为学科&网高温润滑油和油脂的稠化剂。鉴别硬脂酸锂与硬脂酸钠、硬脂酸钾可采用的实验方法和现象分别是。(4)、LiPF6易溶于有机溶剂,常用作锂离子电池的电解质。LiPF6受热易分解,其热分解产物为PF3和。31. “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).请回答下列问题:(1)、钠、钾着火,下列可用来灭火的是 .A、水 B、干冰 C、细沙 D、泡沫灭火器(2)、白磷有毒能和氯酸(HClO3溶液发生反应生成一种常见的强酸和一种三元酸,氧化剂是 , 氧化产物是 , 1mol P4参加反应转移 mol电子.(3)、钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题.
①钠比锂活泼,用原子结构解释原因 .
②钠电池“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间
由钠离子导体制作的陶瓷管相隔.写出该电池的正极反应: .
 32. 目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
32. 目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
提示:①MgCl2晶体的化学式为MgCl2·6H2O。
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(1)、操作①的名称是 , 操作②的名称、、过滤。(2)、试剂a的名称是。(3)、用氯化镁电解生产金属镁的化学方程式为。33. 某同学为测定一定质量的钠与水反应产生的氢气的体积,设计了图装置进行实验。 (1)、实验开始,欲使钠与水接触反应,应如何操作?;反应开始后,试管中能观察到的现象是。(2)、已知有关物质的密度ρ(K):0.86 g·cm-3 , ρ(Na):0.97 g·cm-3 , ρ(煤油):0.8 g·cm-3。如果将钠换成相同大小的钾进行上述实验,结果钾反应完所用时间比钠反应完所用的时间(填“长”或“短”),其原因是。(3)、从实验的安全考虑,比较金属钠、钾与水反应的实验操作图A、图B,请指出图B表示哪种金属与水反应。
(1)、实验开始,欲使钠与水接触反应,应如何操作?;反应开始后,试管中能观察到的现象是。(2)、已知有关物质的密度ρ(K):0.86 g·cm-3 , ρ(Na):0.97 g·cm-3 , ρ(煤油):0.8 g·cm-3。如果将钠换成相同大小的钾进行上述实验,结果钾反应完所用时间比钠反应完所用的时间(填“长”或“短”),其原因是。(3)、从实验的安全考虑,比较金属钠、钾与水反应的实验操作图A、图B,请指出图B表示哪种金属与水反应。