高考二轮复习知识点:钠的氧化物
试卷更新日期:2023-07-29 类型:二轮复习
一、选择题
-
1. 离子化合物和与水的反应分别为;。下列说法正确的是( )A、中均有非极性共价键 B、中水发生氧化反应,中水发生还原反应 C、中阴、阳离子个数比为 , 中阴、阳离子个数比为 D、当反应和中转移的电子数相同时,产生的和的物质的量相同2. 由下列实验操作及现象能得出相应结论的是( )
实验操作
现象
结论
A
向KBr、KI混合溶液中依次加入少量氯水和CCl4 , 振荡,静置
溶液分层,下层呈紫红色
氧化性:
B
在火焰上灼烧搅拌过某无色溶液的玻璃棒
火焰出现黄色
溶液中含Na元素
C
用pH计测定pH:①NaHCO3溶液②CH3COONa溶液
pH:①>②
H2CO3酸性弱于CH3COOH
D
把水滴入盛有少量Na2O2的试管中,立即把带火星木条放在试管口
木条复燃
反应生成了O2
A、A B、B C、C D、D3. 宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写正确的是( )A、 放入水中: B、 通过灼热铁粉: C、铜丝插入热的浓硫酸中: D、 通入酸性 溶液中:4. 下列说法正确的是( )A、 在空气中加热可得固体 B、 加入到过量 溶液中可得 C、 在沸腾炉中与 反应主要生成 D、 溶液中加入少量 粉末生成 和5. 下列化学方程式中,不能正确表达反应颜色变化的是( )A、向CuSO4溶液中加入足量Zn粉,溶液蓝色消失:Zn+CuSO4=Cu+ZnSO4 B、澄清的石灰水久置后出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O C、Na2O2在空气中放置后由淡黄色变为白色:2Na2O2=2Na2O+O2↑ D、向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀:3Mg(OH)2+2FeCl3=2Fe(OH)3+3MgCl26. 将过氧化钠粉末投入到氯化亚铁溶液中,可观察到的现象是A、最终生成红褐色沉淀 B、没有气体产生 C、最终生成白色沉淀 D、最终生成血红色溶液7. 下列陈述I和陈述II均正确且存在因果关系的是选项
陈述I
陈述II
A
Al具有两性
常温下可用铝制容器盛装浓硝酸
B
Na2O2具有氧化性
Na2O2可氧化CO2产生氧气
C
纯碱溶液呈碱性
纯碱溶液可用于清洗厨房油污
D
SO2具有漂白性
SO2通入紫色石蕊溶液后溶液褪色
A、A B、B C、C D、D8. 下列用途与所述的化学知识没有关联的是选项
用途
化学知识
A
用小苏打作发泡剂烘焙面包
Na2CO3可与酸反应
B
电热水器用镁棒防止内胆腐蚀
牺牲阳极(原电池的负极反应物)保护法
C
用84消毒液对图书馆桌椅消毒
含氯消毒剂具有强氧化性
D
用Na2O2作呼吸面具中的制氧剂
Na2O2能与H2O和CO2反应
A、A B、B C、C D、D9. 下列物质性质与用途具有对应关系的是A、呈淡黄色,可用作供氧剂 B、NaCl熔点较高,可用于制取NaOH C、溶液呈碱性,可用于除油污 D、易分解,可用于治疗胃酸过多10. 下列说法中正确的是A、海水中富集元素常用作为沉淀剂 B、标准状况下,溶于水可得分子 C、78克与足量水完全反应,转移电子 D、盐酸标准液标定未知浓度溶液时,酸式滴定管水洗后未润洗会使测定结果偏低11. 下列说法错误的是( )A、与水反应可生成二种酸 B、ICl与水反应生成和 C、与反应生成氧气为或或 D、分子中的原子都处于同一平面,且能与水反应生成12. 生活因化学更美好,以下生活用途和化学原理都正确的是( )选项
生活用途
化学原理
A
电热水器内胆连接镁棒防止腐蚀
牺牲阳极的阴极保护法
B
过氧化钠用作呼吸面具或潜水艇中的供氧剂
过氧化钠具有氧化性
C
明矾可用作净水剂和消毒剂
铝离子水解生成氢氧化铝胶体
D
铁粉和生石灰常用作袋装食品的抗氧化剂
能够吸收氧气防止食品腐坏
A、A B、B C、C D、D13. 下列推理合理的是( )A、NaCl固体与浓H2SO4 加热可制HCl, 则NaI固体与浓H2SO4 加热制HI B、Na2O2 与CO2反应生成Na2CO3和O2 , 则Na2O2与SO2反应生成Na2SO3和O2 C、实验室可利用AlCl3与足量氨水反应来制备Al(OH)3 , 则也可利用CuCl2与足量氨水反应生成Cu(OH)2 D、Fe与S反应生成FeS,则Cu与S反应生成Cu2S14. 下列推断合理的是( )A、CO2与H2O反应生成H2CO3 , 则SiO2也与H2O反应生成H2SiO3 B、CO2与Na2O2反应生成O2 , 则SO2也与Na2O2反应生成O2 C、Mg在CO2中燃烧生成C单质,则Ca也在CO2中燃烧生成C单质 D、HCl气体溶于水形成的盐酸为强酸,则HF气体溶于水形成的氢氟酸也为强酸15. 下列实验操作、现象、结论均正确的是( )实验操作
现象
结论
A
将过氧化钠投入滴有酚酞试液的水中
溶液最终为红色
过氧化钠与水反应生成碱性物质
B
将包裹Na2O2固体的棉花放入盛CO2集气瓶中
棉花燃起来
Na2O2与CO2反应为放热反应
C
在酸性KMnO4溶液与足量H2C2O4溶液反应一会儿后,加入少量MnSO4固体
紫色快速褪去
加入MnSO4起催化作用
D
向植物油加入NaOH溶液,经反应,取少许于乙醇中
液体不分层
植物油已完全水解
A、A B、B C、C D、D16. 下列反应过程中水作氧化剂的是( )A、过氧化钠与水反应制取氧气 B、氮化镁和水反应制取氨气 C、铸铁淬火加工(高温下铁与水反应) D、二氧化氮溶于水得到硝酸17. Na2O2能与CO2发生反应,下列叙述错误的是( )A、有离子键、共价键的断裂与生成 B、O2既是氧化产物又是还原产物 C、反应物和生成物中都含离子晶体 D、标况下,转移2mol电子,气体体积减小22.4L18. 过氧化物在纺织业工业里有重要的作用,关于Na2O2的说法正确的是( )A、阴离子的电子数为10 B、阴阳离子个数比1:1 C、属于离子化合物 D、属于非电解质19. 下列金属化合物中最方便用于潜水艇舱内供氧的是( )A、KMnO4 B、KClO3 C、KNO3 D、Na2O220. 下列各组物质充分反应后,只能得到一种气体的是( )A、木炭和浓硫酸共热 B、足量的铜跟一定量的浓硝酸反应 C、Na2O2与足量的稀硫酸反应 D、汽油在汽车发动机中燃烧后排出的气体21. 向含有① 、② 、③ 、④ 、⑤ 等五种阴离子的溶液中加入少量Na2O2固体,上述离子浓度基本保持不变的是(忽略溶液体积的变化)( )A、①③⑤ B、① C、①② D、①②④22. 下列解释事实的方程式正确的是( )A、CO2通入过量的NaOH溶液中:CO2+OH-= B、SO2的催化氧化反应:2SO2+O2 2SO3 C、过氧化钠做呼吸面具的供氧剂:Na2O2+CO2=Na2CO3+O2 D、氯气用于自来水消毒:Cl2+H2O⇌2H++Cl-+ClO-23. 下列方程式与所给事实不相符的是( )A、向 酸性溶液中滴加 溶液,溶液褪色: B、向沸水中滴加饱和 溶液, 胶体: C、向银氨溶液中滴加乙醛,水浴加热,析出光亮银镜: D、 用作潜水艇供氧剂: ;24. 某溶液中含有HCO3-、SO32-、CO32-、Cl-等 4种阴离子。向其中加入足量的 Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化) ( )A、CO32- B、SO32- C、Cl- D、HCO3-25. 下列说法错误的是( )A、在硫酸工业的吸收塔中,采用浓硫酸吸收三氧化硫 B、Na2O2吸收CO2产生O2 , 可用作呼吸面具供氧剂 C、SO2与过量氨水反应得到 D、无水CoCl2吸水会变为蓝色,可用于判断变色硅胶是否吸水26. 在溶液中加入过量Na2O2后仍能大量共存的是( )A、NH4+、Ba2+、Cl-、NO3- B、K+、CO32-、AlO2-、SO42- C、Fe2+、Mg2+、SCN-、Cl- D、Na+、HCO3-、SO32-、I-27. 用类推法预测物质性质,结果符合事实的是( )A、Cu 与Cl2 反应生成 CuCl2 , 则与 S 反应也生成 CuS B、Na2O2 与 CO2 反应生成 Na2CO3 , 则与 SO2 反应也生成 Na2SO3 C、O2 与Na2CO3 溶液不反应,则与Na2S 溶液也不反应 D、木炭可与浓HNO3 反应,也可与浓H2SO4 反应28. 下列说法不正确的是( )A、Al2O3熔点很高,可用作高级耐火材料 B、Na2O可作呼吸面具中的供氧剂 C、镁铝合金被大量用于高铁建设 D、苯可萃取碘水中的碘单质29. 在含有Na+、Fe2+ 、Fe3+、Al3+、NH4+、Mg2+等的溶液中加入足量的Na2O2固体,再加入过量的稀盐酸,完全反应后,上述离子的离子数目几乎没有改变的有( )A、1种 B、2种 C、3种 D、4种30. 下列各组物质发生反应,有红棕色气体产生的是( )A、Na和H2O B、Na2O2和H2O C、Cu和浓HNO3 D、Ca(OH)2和NH4Cl二、非选择题
-
31. 治理氮氧化物(NOx)的污染是化学研究的重要课题之一。(1)、I.NO能被灼热的铁粉还原为N2 , 同时生成FeO,利用下列装置模拟该反应。
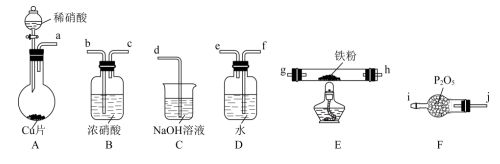
已知:①浓硝酸可将NO氧化为NO2;②NaOH溶液能与NO2反应,不与NO反应。
打开A装置分液漏斗活塞,烧瓶中观察到的实验现象有:铜片表面出现无色气泡,铜片逐渐变小、、烧瓶中溶液由无色变为蓝色。
(2)、上述装置接口的连接顺序为:a→→→→→g→h→b→c→d(按气流方向,用小写字母表示)。(3)、装置B的作用是。(4)、装置E中反应的化学方程式为。(5)、II.已知:(NOx)能与Na2O2反应;NO2和Na2O2都有较强氧化性。为探究NO2与Na2O2反应的产物,提出如下假设:假设①NO2氧化Na2O2;假设②Na2O2氧化NO2
甲同学设计如图所示实验装置:
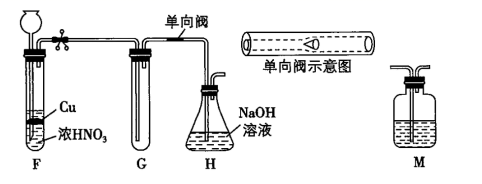
请回答下列问题:
甲乙两同学对假设分别进行了验证:
实验操作
现象
结论
甲同学
待试管G中收集满气体,向其中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管,观察现象;并将带火星的木条迅速伸进试管,观察。
红棕色气体迅速消失;木条复燃
假设①正确
乙同学
在F、G之间增加一个M洗气瓶,目的是 , 重复甲同学的实验操作。
红棕色气体迅速消失,带火星的木条未复燃
假设②正确
请做出正确判断,写出NO2和Na2O2反应的化学方程式。
(6)、图中单向阀在实现气体单向流通的同时,还有一个作用是。32. 氨气、氯化氢和水是重要的几种非金属氢化物。请回答下列问题(1)、氨气通入紫色石蕊溶液中,溶液变(填“蓝色”或“红色”)。(2)、氯化氢的水溶液与金属铁反应,生成(填“FeCl2“或“FeCl3”).(3)、水中投入过氧化钠,写出反应的化学方程式:。33. 三氯氧磷(POCl3)是重要的基础化工原料,广泛用于制药、染化。塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3 , 实验装置设计如下: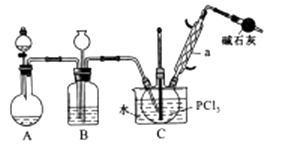
有关物质的部分性质如下表:
熔点/℃
沸点/℃
其他
PCl3
-112
75.5
遇水生成H3PO3和HCl,遇O2生成POCl3
POCl3
2
105.3
遇水生成H3PO4和HCl,能溶于PCl3
回答下列问题:
(1)、仪器a的名称是 , 装置A中发生反应的化学方程式为。(2)、B装置的作用除观察O2的流速之外。还有。(3)、C装置控制反应在60℃~65℃进行,其主要目的是。(4)、通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:I.取xg产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
II.向锥形瓶中加入0.1000mol/L的AgNO3溶液 40.00 mL,使 Cl-完全沉淀。
III.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
IV.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知:Ksp(AgCl)=3.2×10-10 , Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是(填标号),滴定终点的现象为。
a.FeCl2
b.NH4Fe(SO4)2
c.淀粉
d.甲基橙
②Cl元素的质量百分含量为(列出算式)。
③步骤III加入硝基苯的目的是 , 如无此操作,所测Cl元素含量将会(填“偏大”“偏小”或“不变”)。