高考二轮复习知识点:钠的化学性质
试卷更新日期:2023-07-29 类型:二轮复习
一、选择题
-
1. 下列说法不正确的是( )A、硅酸钠是一种难溶于水的硅酸盐 B、镁在空气中燃烧可生成氧化镁和氮化镁 C、钠与水反应生成氢氧化钠和氢气 D、常温下,铝遇浓硝酸或浓硫酸时会发生钝化2. 下列关于元素及其化合物的性质说法错误的是A、和乙醇反应可生成 B、工业上煅烧黄铁矿生产 C、工业上用氨的催化氧化制备 D、常温下铁与浓硝酸反应可制备3. 下列说法不正确的是( )A、灼烧法做“海带中碘元素的分离及检验”实验时,须将海带进行灰化 B、用纸层析法分离铁离子和铜离子时,不能将滤纸条上的试样点浸入展开剂中 C、将盛有苯酚与水形成的浊液的试管浸泡在80℃热水中一段时间,浊液变澄清 D、不能将实验室用剩的金属钠块放回原试剂瓶4. 下列方程式不能准确解释相应实验现象的是( )A、酚酞滴入醋酸钠溶液中变为浅红色:CH3COO-+H2O⇌CH3COOH+OH- B、金属钠在空气中加热生成淡黄色固体:4Na+O2=2Na2O C、铝溶于氢氧化钠溶液,有无色气体产生:2Al+2OH-+2H2O=2 +3H2↑ D、将二氧化硫通入氢硫酸中产生黄色沉淀:SO2+2H2S=3S↓+2H2O5. 下列方案设计、现象和结论都正确的是( )
目的
方案设计
现象和结论
A
探究乙醇消去反应的产物
取 乙醇,加入 浓硫酸、少量沸石,迅速升温至140℃,将产生的气体通入 溴水中
若溴水褪色,则乙醇消去反应的产物为乙烯
B
探究乙酰水杨酸样品中是否含有水杨酸
取少量样品,加入 蒸馏水和少量乙醇,振荡,再加入1-2滴 溶液
若有紫色沉淀生成,则该产品中含有水杨酸
C
探究金属钠在氧气中燃烧所得固体粉末的成分
取少量固体粉末,加入 蒸馏水
若无气体生成,则固体粉末为 ;若有气体生成,则固体粉末为
D
探究 固体样品是否变质
取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量 溶液
若有白色沉淀产生,则样品已经变质
A、A B、B C、C D、D6. 下列有关化学反应的叙述正确的是( )A、室温下,Na在空气中反应生成Na2O2 B、室温下,Al与4.0 mol﹒L-1NaOH溶液反应生成NaAlO2 C、室温下,Cu与浓HNO3反应放出NO气体 D、室温下,Fe与浓H2SO4反应生成FeSO47. 下列有关化学反应的叙述正确的是( )A、Fe在稀硝酸中发生钝化 B、MnO2和稀盐酸反应制取Cl2 C、SO2与过量氨水反应生成(NH4)2SO3 D、室温下Na与空气中O2反应制取Na2O28. 下列有关元素化合物的说法正确的是( )A、元素的非金属性越强,简单氢化物的酸性越弱 B、由金属活动性顺序可知,钙比钠与水反应更剧烈 C、碳酸氢钠和碳酸钠均可用作食品膨松剂 D、与浓硫酸和稀硫酸反应时,硫酸同时体现酸性和氧化性9. 下列说法错误的是A、硅酸钠是一种难溶于水的硅酸盐 B、镁在空气中燃烧可生成氧化镁和氮化镁 C、钠与水反应生成氢氧化钠和氢气 D、常温下,铝遇浓硝酸或浓硫酸时会发生钝化10. 下列说法正确的是( )A、空气中久置的硫化钠会产生淡黄色浑浊 B、过量的铁在氯气中燃烧生成 C、硝酸工业中用浓硝酸吸收制 D、实验室可以用铝和氢硫酸反应制硫化铝11. 化学与生活密切相关。下列说法错误的是( )A、利用合适的催化剂可减少汽车尾气中有害气体的排放 B、钠着火可用泡沫灭火器灭火 C、高纯硅可用于制作光感电池 D、疫苗一般冷藏存放,以避免蛋白质变性12. 从古至今化学与生产、生活密切相关。下列说法错误的是( )A、中华酒文化源远流长,酿酒过程中涉及水解反应、氧化反应等多种反应类型 B、我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造机钛合金结构件;高温时可用金属钠还原相应的氯化物来制取金属钛 C、新冠疫情席卷全球,目前使用的一次性医用口罩(SMS),其原料是聚丙烯,能使溴水或酸性高锰酸钾溶液褪色 D、垃圾分类很重要,充电电池和硒鼓墨盒都属于有害垃圾13. 下列说法错误的是( )A、钠着火不能用泡沫灭火器灭火 B、溶液中加少量铁屑防止被氧化 C、苯酚和甲醛通过加聚反应制得酚醛树脂 D、包装上有标记“OTC”的药物,消费者可以自行购买和使用
14. 下列用于解释事实的方程式书写不正确的是( )A、滴有酚酞的碳酸钠溶液呈红色:CO+2H2OH2CO3+2OH- B、在空气中加热金属钠生成淡黄色固体:2Na+O2Na2O2 C、氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-=AlO+2H2O D、将氯气通入氢硫酸中产生黄色沉淀:H2S+Cl2=S↓+2HCl15. 下列实验操作和现象不相符的是( )
D、包装上有标记“OTC”的药物,消费者可以自行购买和使用
14. 下列用于解释事实的方程式书写不正确的是( )A、滴有酚酞的碳酸钠溶液呈红色:CO+2H2OH2CO3+2OH- B、在空气中加热金属钠生成淡黄色固体:2Na+O2Na2O2 C、氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-=AlO+2H2O D、将氯气通入氢硫酸中产生黄色沉淀:H2S+Cl2=S↓+2HCl15. 下列实验操作和现象不相符的是( )选项
实验操作
现象
A
向溴的氯仿溶液中通入足量乙烯
溴的氯仿溶液颜色逐渐变浅,最终变为无色
B
向淀粉溶液中先加入足量稀硫酸,再加入少量新制氢氧化铜悬浊液,加热
产生砖红色沉淀
C
向盛有大量水的烧杯中加入少量钠块
钠块熔化成银白色小球
D
常温下,向AgCl浊液中加入KI浓溶液,振荡已知:[Ksp(AgCl)>Ksp(AgI)]
白色浊液变成淡黄色浊液(或沉淀)
A、A B、B C、C D、D16. 下列说法错误的是A、钠与CuO在高温下反应生成 B、可用Al与MgO发生反应制取Mg C、Na、等活泼的金属和非金属用电解法制得 D、FeO在空气里受热, 能迅速被氧化成17. 下列说法正确的是( )A、纸层析法分离Fe3+和Cu2+ , 氨熏后纸条上端为棕红色,下端为深蓝色 B、从海带中提取碘的工业生产过程步骤:灼烧、浸泡、过滤、氧化、结晶、提纯 C、培养明矾晶体时,将小晶体悬挂在90℃热饱和溶液的烧杯中央,自然冷却至室温 D、金属钾、钠和白磷暴露空气中易燃烧,均应保存在煤油中18. 下列“类推”合理的是( )A、Na与H2O反应生成NaOH和H2 , 则Fe与H2O反应生成Fe(OH)3和H2 B、CO2可与水反应生成H2CO3 , 则SiO2可与水反应生成H2SiO3 C、铁与硫加热反应生成FeS,则铜与硫加热反应生成Cu2S D、Cl2与H2O反应生成HCl和HClO,则F2与H2O反应生成HF和HFO19. 下列有关钠及其化合物的性质与用途具有对应关系的是( )A、钠单质熔点较低,可用于冶炼金属钛 B、次氯酸钠具有强氧化性,可用作环境消毒剂 C、氢氧化钠具有强碱性,可用作干燥剂 D、碳酸氢钠受热易分解,可用于泡沫灭火器20. 根据下列实验及现象不能推出相应结论的是( )实验
现象
结论
A
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
B
缓缓加热0.5mol·L-1CH3COONa溶液到60℃,并用pH传感器测定溶液的pH
溶液的pH逐渐减小
溶液中c(H+)逐渐增大,c(OH-)逐渐减小
C
温下,将50mL苯与50mLCH3COOH混合
所得混合溶液的体积为101mL
混合过程中削弱了CH3COOH分子间的氢键,且苯与CH3COOH分子间的作用弱于氢键
D
利用电导仪测定碱性条件下乙酸乙酯水解反应中电导率的变化(溶液温度不变)
随着反应进行,电导率逐渐减小
OH-的电导大于CH3COO-的电导
A、A B、B C、C D、D21. 下列由实验操作和现象推出的结论正确的是( )选项
实验操作和现象
结论
A
某SO2气体中可能存在CO2 , 将气体依次通过NaHCO3溶液、品红溶液、澄清石灰水,品红溶液不褪色,澄清石灰水变浑浊
该气体中存在CO2
B
去家用食盐少量,溶于水,加少量淀粉固体,充分搅拌,无明显变化
这是一种没有添加碘的食盐
C
取细铁丝在酒精灯上灼烧至红热,再伸入充满氯气的瓶中,剧烈反应,产生大量红褐色的烟,结束后,加水振荡,使固体充分溶解,再滴加2滴KSCN溶液,溶液未变色
Fe再Cl2中燃烧生成FeCl2
D
将钠块融化后,上面倒扣一个充满CO2的集气瓶,剧烈燃烧,产生大量白烟,瓶壁有黑色固体
钠置换产生了碳单质
A、A B、B C、C D、D22. 我国著名化学家付鹰说:“化学是实验的科学,只有实验才是最高法庭”。下列实验操作、现象和结论均正确的是( )选项
操作
现象
结论
A
向某溶液中依次摘入几滴KSCN溶液和新制氯水
溶液先无明显现象,后变红
该溶液中含Fe2+
B
将一小块金属钠放在蒸发皿里,加热
发出黄色火焰,生成淡黄色固体
金属钠在空气中加热生成过氧化钠
C
用排水法收集铜和稀硝酸加热产生的气体
集气瓶中充满红棕色气体
反应生成红棕色气体且不溶于水
D
向1mL0.1mol•L-1NaOH溶液中依次滴入2滴浓度均为0.1mol•L-1的MgCl2溶液和FeCl3溶液
先产生白色沉淀,后生成红褐色沉淀
相同温度下:Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
A、A B、B C、C D、D23. 化学研究性学习小组设计了如下装置制备少量氯化钠。无法达到实验目的的是( ) A、用装置甲制取氯气 B、用装置乙净化、干燥氯气 C、用装置丙制备氯化钠 D、用装置丁吸收尾气24. 下列有关化学反应的叙述正确的是( )A、Fe在稀硝酸中发生钝化 B、MnO2和稀盐酸反应制取Cl2 C、NO与空气混合溶于水能生成HNO3 D、室温下Na与空气中O2反应制取Na2O225. 某小组同学探究金属钠与不同盐溶液的反应,进行了如下实验。下列说法错误的是( )
A、用装置甲制取氯气 B、用装置乙净化、干燥氯气 C、用装置丙制备氯化钠 D、用装置丁吸收尾气24. 下列有关化学反应的叙述正确的是( )A、Fe在稀硝酸中发生钝化 B、MnO2和稀盐酸反应制取Cl2 C、NO与空气混合溶于水能生成HNO3 D、室温下Na与空气中O2反应制取Na2O225. 某小组同学探究金属钠与不同盐溶液的反应,进行了如下实验。下列说法错误的是( )查阅资料:溶液中离子的浓度越大,离子所带的电荷数目越多,溶液的离子强度越大。
实验
序号
盐溶液
现象
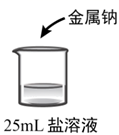
①
溶液
与钠与水的反应类似,钠熔化成一个闪亮的小球,四处游动,速度较快,没有火花出现
②
2.0mol/LKCl溶液
反应比①剧烈,没有火花出现
③
溶液
反应比②剧烈,没有火花出现
④
溶液
反应瞬间即有黄色火花出现,并立即发生剧烈燃烧
A、由①②可知,随着KCl溶液浓度的增加,钠与KCl溶液的反应速率明显加快 B、实验③比②反应更加剧烈,一定是因为钠与碳酸根离子发生氧化还原反应 C、实验④中出现燃烧现象,是因为钠与水、与硝酸根离子发生了氧化还原反应,导致反应放出大量的热,达到了钠的着火点 D、推测若采用 溶液进行上述实验,也会出现钠的燃烧现象26. 下列有关化学反应的叙述正确的是( )A、CuSO4稀溶液与Na反应析出Cu B、Fe与水蒸气在高温下反应生成Fe2O3 C、SO2的水溶液与溴蒸气反应富集溴 D、饱和食盐水与通入的NH3、CO2反应析出Na2CO3固体27. 下列说法错误的是( )A、工业上,在高温熔融、隔绝空气的条件下,利用钠单质和钛、钽等金属的氧化物发生置换反应,来制备钛、钽等稀有金属材料 B、铁的化合物应用十分广泛,氯化铁、硫酸亚铁是优良的净水剂 C、铜丝在氯气中燃烧,产生大量棕色的烟,实验结束后在集气瓶中加入少量水,盖上玻片后充分振荡,棕色消失,得到绿色溶液,再加水稀释,最终得到蓝色溶液 D、工业上锌可用湿法冶炼——电解 ZnSO4 溶液制备 Zn28. 由下列实验及现象不能推出相应结论的是( )实验
现象
结论
A.
向2mL0.1mol/LFeCl3的溶液中加足量铁粉,振荡,加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液颜色不变
还原性:Fe>Fe2+
B.
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C.
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D.
将SO2通入酸性KMnO4溶液
紫色溶液褪色
SO2具有还原性
A、A B、B C、C D、D29. 下列各组物质相互混合反应后,最终有白色沉淀生成的是( )①金属钠投入到FeCl2溶液中 ②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中 ④向饱和Na2CO3溶液中通入过量CO2 .
A、①②③④ B、①④ C、③④ D、②③30. 下列说法错误的是( )A、铁、锰、铬以及它们的合金称为黑色金属材料 B、用铬酸作氧化剂可以使铝表面的氧化膜产生美丽的颜色 C、可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素 D、钠与水反应、镁与沸水反应、红热的铁与高温水蒸气反应均生成碱和氢气二、非选择题
-
31. 某小组探究影响金属与水反应剧烈程度的因素。(1)、分别将等质量的 Na块和 Mg 条(打磨光亮)投入水中,记录现象如下:

补全 Na 与水反应的实验现象:。
(2)、探究 Mg 与水反应缓慢的原因。资料:Mg 水反应时,Mg 表面覆盖了致密的 Mg(OH)2 导致反应缓慢;NH4+ 和 HCO3-可以加快 Mg 与水反应。
同学们为了验证 NH4+ 和 HCO3-对 Mg 与水反应的促进作用,用与水反应后的 Mg条与 4 种盐溶液进行对比实验,结果如下
实验序号
a
b
c
d
盐溶液(均为 0.1 mol/L)
NH4Cl
NaHCO3
NaCl
NH4HCO3
溶液起始 pH
5.1
8.3
7.0
7.8
30min 时产生气体体积(mL)
1.5
0.7
<0.1
1.4
气体的主要成分
H2
30min 时镁条表面情况
大量固体附着(固体可溶于盐酸)
① 根据 Mg(OH)2 的溶解平衡可解释 NH4+ 和 HCO3- 的作用。Mg(OH)2 的溶解平衡表达式是。
② 经检验,a中还生成少量其他气体,可进一步证明 NH4促进 Mg与水反应。检验该气体的方法是。
③ 上表中能够说明 HCO3-对 Mg 与水反应起促进作用的证据是。
④ b、d 所得固体中还检验出碱式碳酸镁[用 Mg2(OH)2CO3 表示],写出生成该固体的离子方程式。
综合实验 a~d 可以得到的结论是: NH4+ 和 HCO3-都能与 Mg(OH)2 作用加快 Mg与水反应,(补充两点)。
(3)、实验表明:与水反应的剧烈程度 K>Na>Ca>Mg。结合上述实验说明影响金属与水 反应剧烈程度的因素有。32. 化学兴趣小组同学想用金属钠和空气制备纯度较高的Na2O2(N2不与金属钠应),可利用的装置如下。回答下列问题: (1)、装置Ⅳ中盛放的药品是 , 若没有该装置可能导致生成的Na2O2中含有碳酸钠,其反应方程式为。(2)、若规定气体的气流方向从左到右,各仪器接口的标号字母(a、b……)顺序:
(1)、装置Ⅳ中盛放的药品是 , 若没有该装置可能导致生成的Na2O2中含有碳酸钠,其反应方程式为。(2)、若规定气体的气流方向从左到右,各仪器接口的标号字母(a、b……)顺序:空气进入h,接 , 接 , 接 , d
(3)、装置Ⅱ的作用是。(4)、某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。①使酚酞溶液变红是因为 , 红色褪去的可能原因是。
②加入MnO2反应的化学方程式为。
33. 钠、铝,铁是中学化学中常见的三种重要金属。请回答下列问题;(1)、实验室中少量钠通常保存在(填“煤油”或“四氯化碳”)。(2)、铁的一种氯化物俗称“铁红”,用做红色颜料,铁红的化学式是(填“FeO”、”Fe2O3”或“Fe3O4”)(3)、Al(OH)3能游溶于盐酸或氢氧化钠溶液,请写出Al(OH)3与氢氧化钠溶液反应的离子方程式:。