高考二轮复习知识点:合理利用金属资源
试卷更新日期:2023-07-29 类型:二轮复习
一、选择题
-
1. 中国历史文化悠久,流传下许多精美文物。下列文物主要由金属材料制成的是
 A、商周青铜器 B、唐代丝绸 C、宋代陶瓷 D、清代玉器2. 我国在很多领域取得了举世瞩目的成就,下列工程使用的部分材料如表所示,其中属于金属材料的是( )
A、商周青铜器 B、唐代丝绸 C、宋代陶瓷 D、清代玉器2. 我国在很多领域取得了举世瞩目的成就,下列工程使用的部分材料如表所示,其中属于金属材料的是( )A
B
C
D




天问一号探测器超大型天线反射面舱室密封材料
完成万米深潜的“奋斗者号”潜水器中的固体浮力材料
大国重器C919大型客机机身蒙皮
我国在月球表面首次实现“独立展示”的国旗
硅橡胶
高强空心玻璃微球
第三代铝锂合金
国产复合纤维
A、A B、B C、C D、D3. 化学与生活息息相关,下列说法错误的是( )A、“煤改气”“燃煤脱硫”等有利于改善环境 B、二氧化氯泡腾片遇水产生ClO2用于杀菌消毒 C、“嫦娥五号”使用的氧化铝陶瓷属于金属材料 D、“凡铁分生熟……既炒则熟”指的是氧化除碳4. 2020年4月20日,习近平总书记来到秦岭,关注山清水秀。下列做法正确的是( )A、集中深埋废旧电池 B、远海排放工业污水 C、减少冶炼含硫矿物 D、推广使用一次性木筷5. 载人飞船返回舱所需要的下列组件中,由金属材料制成的是 A、降落伞:高强度芳纶纤维 B、烧蚀层:多孔结构酚醛树脂 C、隔热层:玻璃钢 D、舱侧壁:铝合金6. 劳动创造美好生活。下列劳动项目与所述的化学知识没有关联的是( )
A、降落伞:高强度芳纶纤维 B、烧蚀层:多孔结构酚醛树脂 C、隔热层:玻璃钢 D、舱侧壁:铝合金6. 劳动创造美好生活。下列劳动项目与所述的化学知识没有关联的是( )选项
劳动项目
化学知识
A
工厂参观:自来水厂用氯气来杀菌、消毒
氯气为黄绿色气体
B
实验活动:用硝酸清洗银镜反应后的试管
硝酸具有较强的氧化性
C
农业活动:用熟石灰改良酸性土壤
是一种碱
D
社区服务:回收铝制易拉罐
再利用废旧金属,节约资源
A、A B、B C、C D、D7. 下列物品所涉及的合金材料属于新型合金的是( )A
B
C
D




用生铁铸造的下水井盖
用不锈钢制造的地铁列车车体
用硬铝制造的飞机外壳
用储氢合金装配的以H2为燃料的汽车
A、A B、B C、C D、D8. 2024年的奥运会将在巴黎举行,沙滩排球比赛场地将设在埃菲尔铁塔前的战神广场,埃菲尔铁塔为钢铁结构,使用了250万个铆钉和近两万块铁片,以下说法不正确的是( ) A、连接铁片的铆钉应该用铜质的 B、为了减缓钢铁生锈,工人们在铁塔表面涂上一层特制的油漆 C、巴黎的气候比较潮湿,比干燥的环境更易引起钢铁的生锈 D、可以在铁塔上镶嵌锌片,减慢钢铁的腐蚀速率9. 下列有关金属材料说法不正确的是( )A、合金的硬度比其成分金属大,是因为纯金属内加入其他元素原子后原子层之间的相对滑动变得困难 B、铝制餐具耐腐蚀性较好,可以用来蒸煮或长时间存放酸性或碱性食物 C、生铁和钢是含碳量不同的两种铁碳合金,生铁的含碳量比钢高 D、实用储氢合金能够吸收大量氢气后形成金属氢化物,稍稍加热又容易分解,释放氢气10. 我国自主研发的新一代动车组在京沪高铁上跑出过486.1公里的世界列车最高时速,这得益于全路铺设的优质无缝平滑的超长钢轨。下列有关说法不正确的是( )A、制造钢轨的材料是钢,钢是用量最大的合金 B、在空气中将金属钛、铝混合后熔化可制得铝合金,强度、硬度比铝大 C、在我国使用最早上合金是铜合金 D、不锈钢的合金元素主要是铬和镍11. 2021年12月14日,西安江村大墓被确定为汉文帝霸陵,已发掘的8座外藏坑出土陶俑、铜印、铜车马器及铁器、陶器等1500余件,下列有关说法错误的是( )A、“陶俑”“陶器”均是以黏土为原料经过高温烧制而成的陶制品 B、“铜印”“铜车马器”表面上覆盖的铜绿主要成分是碱式碳酸铜 C、铁是组成“铁器”的元素之一,是当前社会应用量最大的金属元素 D、墓葬中“铁器”与“铜器”接触摆放时,“铜器”比“铁器”腐蚀速率较快12. 下列有关垃圾分类处理的说法正确的是( )A、废弃的聚乙烯塑料属于白色垃圾,能使溴水褪色 B、可回收的易拉罐中含金属铝,可通过电解氯化铝的方法制取金属铝 C、废旧电池中含有镍、镉等重金属离子,不能填埋处理 D、含丝、毛的废旧衣物焚烧处理时只生成CO2和H2O13. 随着人们生活质量的不断提高,对废电池必须进行集中处理的问题被提到议事日程,其首要原因( )A、利用电池外壳的金属材料 B、不使电池中渗漏的电解液腐蚀其他物品 C、回收其中的石墨电池 D、防止电池中汞、镉和铅等重金属离子对土地和水源的污染14. 金属材料的开发一直是材料科学的研究热点,一些新的金属材料相继被开发出来并应用于工农业生产和高科技领域。例如,铀(U)用作核电厂反应堆的核燃料,镅(Am)在烟雾探测器中用作烟雾监测材料;特点是被誉为“21世纪的金属”——钛(Ti),应用前景更为广阔。钛(titanium)是一种活泼金属,但因其表面容易形成致密的氧化物保护膜使它不易跟其他物质反应,而具有一定的抗腐蚀能力。除此之外,它还具有熔点高、硬度大、可塑性强、密度小等优点。根据以上背景资料及所学知识,你认为下列说法中错误的是( )A、钛不属于稀土金属 B、钛是很好的航天航空材料 C、钛在空气中不与其他物质反应 D、钛有较好的抗腐蚀能力,是很好的防腐材料15. 在垃圾分类处理和利用的标志中,下图属于( )
A、连接铁片的铆钉应该用铜质的 B、为了减缓钢铁生锈,工人们在铁塔表面涂上一层特制的油漆 C、巴黎的气候比较潮湿,比干燥的环境更易引起钢铁的生锈 D、可以在铁塔上镶嵌锌片,减慢钢铁的腐蚀速率9. 下列有关金属材料说法不正确的是( )A、合金的硬度比其成分金属大,是因为纯金属内加入其他元素原子后原子层之间的相对滑动变得困难 B、铝制餐具耐腐蚀性较好,可以用来蒸煮或长时间存放酸性或碱性食物 C、生铁和钢是含碳量不同的两种铁碳合金,生铁的含碳量比钢高 D、实用储氢合金能够吸收大量氢气后形成金属氢化物,稍稍加热又容易分解,释放氢气10. 我国自主研发的新一代动车组在京沪高铁上跑出过486.1公里的世界列车最高时速,这得益于全路铺设的优质无缝平滑的超长钢轨。下列有关说法不正确的是( )A、制造钢轨的材料是钢,钢是用量最大的合金 B、在空气中将金属钛、铝混合后熔化可制得铝合金,强度、硬度比铝大 C、在我国使用最早上合金是铜合金 D、不锈钢的合金元素主要是铬和镍11. 2021年12月14日,西安江村大墓被确定为汉文帝霸陵,已发掘的8座外藏坑出土陶俑、铜印、铜车马器及铁器、陶器等1500余件,下列有关说法错误的是( )A、“陶俑”“陶器”均是以黏土为原料经过高温烧制而成的陶制品 B、“铜印”“铜车马器”表面上覆盖的铜绿主要成分是碱式碳酸铜 C、铁是组成“铁器”的元素之一,是当前社会应用量最大的金属元素 D、墓葬中“铁器”与“铜器”接触摆放时,“铜器”比“铁器”腐蚀速率较快12. 下列有关垃圾分类处理的说法正确的是( )A、废弃的聚乙烯塑料属于白色垃圾,能使溴水褪色 B、可回收的易拉罐中含金属铝,可通过电解氯化铝的方法制取金属铝 C、废旧电池中含有镍、镉等重金属离子,不能填埋处理 D、含丝、毛的废旧衣物焚烧处理时只生成CO2和H2O13. 随着人们生活质量的不断提高,对废电池必须进行集中处理的问题被提到议事日程,其首要原因( )A、利用电池外壳的金属材料 B、不使电池中渗漏的电解液腐蚀其他物品 C、回收其中的石墨电池 D、防止电池中汞、镉和铅等重金属离子对土地和水源的污染14. 金属材料的开发一直是材料科学的研究热点,一些新的金属材料相继被开发出来并应用于工农业生产和高科技领域。例如,铀(U)用作核电厂反应堆的核燃料,镅(Am)在烟雾探测器中用作烟雾监测材料;特点是被誉为“21世纪的金属”——钛(Ti),应用前景更为广阔。钛(titanium)是一种活泼金属,但因其表面容易形成致密的氧化物保护膜使它不易跟其他物质反应,而具有一定的抗腐蚀能力。除此之外,它还具有熔点高、硬度大、可塑性强、密度小等优点。根据以上背景资料及所学知识,你认为下列说法中错误的是( )A、钛不属于稀土金属 B、钛是很好的航天航空材料 C、钛在空气中不与其他物质反应 D、钛有较好的抗腐蚀能力,是很好的防腐材料15. 在垃圾分类处理和利用的标志中,下图属于( ) A、厨余垃圾标志 B、危险废物标志 C、可回收物标志 D、其他垃圾标志16. 下列说法错误的是A、自然界中存在游离态的金属单质 B、金属活动性不同,冶炼方法也有所不同 C、地球上金属矿物资源是取之不尽的,因此,应加大开采金属矿物的速度,以满足经济发展的需要 D、废旧金属的回收利用,有利于环境保护
A、厨余垃圾标志 B、危险废物标志 C、可回收物标志 D、其他垃圾标志16. 下列说法错误的是A、自然界中存在游离态的金属单质 B、金属活动性不同,冶炼方法也有所不同 C、地球上金属矿物资源是取之不尽的,因此,应加大开采金属矿物的速度,以满足经济发展的需要 D、废旧金属的回收利用,有利于环境保护二、非选择题
-
17.
某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS.某同学用15.0g该废催化剂为原料,回收其中的锌和铜.采用的实验方案如下:

回答下列问题:
(1)、在下列装置中,第一次浸出必须用 , 第二次浸出应选用 . (填标号)
 (2)、第二次浸出时,向盛有滤液1的反应器中加入稀硫酸,后滴入过氧化氢溶液.若顺序相反,会造成 . 滤渣2的主要成分是 .(3)、浓缩硫酸锌、硫酸铜溶液使用的器皿名称是 .(4)、某同学在实验完成之后,得到1.5gCuSO4﹒5H2O,则铜的回收率为 .18. 根据题意填空:(1)、Ⅰ污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀.下列物质不能作为沉淀剂的是
(2)、第二次浸出时,向盛有滤液1的反应器中加入稀硫酸,后滴入过氧化氢溶液.若顺序相反,会造成 . 滤渣2的主要成分是 .(3)、浓缩硫酸锌、硫酸铜溶液使用的器皿名称是 .(4)、某同学在实验完成之后,得到1.5gCuSO4﹒5H2O,则铜的回收率为 .18. 根据题意填空:(1)、Ⅰ污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀.下列物质不能作为沉淀剂的是A.氨水 B.硫化氢气体
C.硫酸钠溶液 D.纯碱溶液
Ⅱ合成氨的流程示意图如下:

回答下列问题:
工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 , ;
(2)、设备A中含有电加热器、触煤和热交换器,设备A的名称 , 其中发生的化学反应方程式为;(3)、设备B的名称 , 其中m和n是两个通水口,入水口是(填“m”或“n”).不宜从相反方向通水的原因;(4)、设备C的作用;(5)、在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)⇌CO2 (g)+H2 (g)
已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 .
19. 三氧化二铬可用作搪瓷、陶瓷、人造革、建筑材料的着色剂。由高碳铬铁合金(含Cr、Fe及C)制备三氧化二铬的工艺流程如下:
已知:Cr(OH)3是两性氢氧化物,草酸亚铁为微溶物。
回答下列问题:
(1)、步骤Ⅰ浸取时,为提高浸取速率,除将高碳铬铁合金制成粉末外,还可采取的措施是(写一点);浸取铬时反应的离子方程式为。(2)、步骤Ⅱ滤渣返回再次浸取的目的是。(3)、步骤Ⅲ除铁时,溶液的pH对铁的去除率影响如图所示:
pH小于2.3时,铁去除率低,其原因是。
(4)、步骤Ⅳ能说明沉淀已洗涤干净的操作是。(5)、步骤Ⅴ沉铬时,生成Cr(OH)3的化学方程式为;沉铬时,溶液pH与铬的回收率关系如图所示,当pH>8.5时,pH越大,铬的回收率越低,其可能原因是。 20. 某化工厂的含镍催化剂主要含有镍、铝、铁单质及它们的氧化物,还有部分不溶于酸和碱的杂质。为了从含镍催化剂中回收镍,设计了如下的工艺流程:
20. 某化工厂的含镍催化剂主要含有镍、铝、铁单质及它们的氧化物,还有部分不溶于酸和碱的杂质。为了从含镍催化剂中回收镍,设计了如下的工艺流程:
部分阳离子完全沉淀时溶液的pH如下:
沉淀物
Al(OH)3
Fe(OH)3
Fe(OH)2
Ni(OH)2
pH
5.2
3.2
9.7
9.2
回答如下问题:
(1)、碱浸的目的是为了除去(2)、某学习小组在实验室中模拟上述流程,简述洗涤滤渣①的操作(3)、加入H2O2并保温一段时间过程中,保温的温度不宜过高的原因为 , 加入H2O2发生反应的离子方程式为。加入H2O2保温后调pH,下列范围合理的是(填选项序号)。A.1.8~3.2
B.2.0~3.0
C.3.3~5.2
D.9.2~9.7
(4)、滤渣③的主要成分为 , 滤液③调pH为2~3的目的为(5)、为测定产品中NiSO4·7H2O纯度,某同学将一定量的样品溶于水,再向其中加入足量的BaCl2溶液,过滤、洗涤沉淀并干燥,称量质量。通过计算发现产品中NiSO4·7H2O的质量分数大于100%,其可能的原因为21. TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
资料:TiCl4及所含杂质氯化物的性质
化合物
SiCl4
TiCl4
AlCl3
FeCl3
MgCl2
沸点/℃
58
136
181(升华)
316
1412
熔点/℃
−69
−25
193
304
714
在TiCl4中的溶解性
互溶
——
微溶
难溶
(1)、氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:。
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH0(填“>”“<”或“=”),判断依据:。
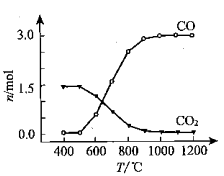
③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有。
(2)、精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下: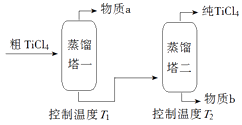
物质a是 , T2应控制在。
22. 对某含铜矿石【主要成分xCuCO3•yCu(OH)2•zCuSiO3 , 含少量SiO3 , FeCO3】进行处理的流程如下:
已知:ⅰ.试剂价格:漂液(含25.2%NaClO)450元/吨,双氧水(含30%H2O2)2400元/吨.
ⅱ.溶液中离子浓度小于等于1.0×10﹣5mol•L﹣1时,认为该离子沉淀完全.
ⅲ.25℃时,金属离子生成氢氧化物时,开始沉淀和沉淀完全的pH如表所示,
物质
开始沉淀
沉淀完全
Fe(OH)2
7.6
9.6
Fe(OH)3
2.7
3.7
Cu(OH)2
4.0
6.5
请回答:
(1)、含铜矿石粉碎的目的为 , 滤渣Ⅰ灼烧所得固体的用途为(任写一种).(2)、操作Ⅰ所用的玻璃仪器为 .(3)、试剂1的名称为 , 选择该试剂的理由为 , 所发生反应的离子方程式为 .(4)、加入试剂2,需调节溶液的pH的合理范围为 , 试剂2可以选择下列物质中的(填选项字母).A.Cu B.CuO C.Cu(OH)2 D.Fe
(5)、操作3包括蒸发浓缩、、、洗涤、干燥、洗涤的方法为 .(6)、25℃时,Cu(OH)2 的溶度积常数K溶[Cu(OH)2]= .23. 某工业矿渣中主要含有Cu2O,还有少部分Al2O3、Fe2O3、SiO2 , 从该矿渣中提取铜的操作流程如下:(已知:Cu2O+2H+═Cu+Cu2++H2O) (1)、固体混合物B与氢氧化钠溶液反应的化学方程式为 . 该反应物的一种重要用途为 .(2)、滤液A中铁元素的存在形式只能为Fe2+ , 理由是 . 涉及的离子方程式为(不必书写Cu2O与盐酸的反应)、 . 检验滤液A中Fe2+的试剂为 .(3)、若将滤液C中的铝元素以沉淀形式析出,可选用的最佳试剂为(填序号).
(1)、固体混合物B与氢氧化钠溶液反应的化学方程式为 . 该反应物的一种重要用途为 .(2)、滤液A中铁元素的存在形式只能为Fe2+ , 理由是 . 涉及的离子方程式为(不必书写Cu2O与盐酸的反应)、 . 检验滤液A中Fe2+的试剂为 .(3)、若将滤液C中的铝元素以沉淀形式析出,可选用的最佳试剂为(填序号).A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
金属E与固体F某一成分发生的反应可用于焊接钢轨,该反应的化学方程为 .
24. 利用废铅蓄电池的铅泥(PbO、Pb及PbSO4等)可制备精细无机化工产品﹣3PbO•PbSO4•H2O (三盐),主要制备流程如下: (1)、步骤①PbSO4转化为难溶PbCO3的离子方程式为 .(2)、滤液1和滤液3经脱色、蒸发、结晶可得到的副产品为(写化学式).(3)、步骤③酸溶时,其中的铅与硝酸生成Pb(NO3)2及NO的离子方程式为;滤液2中溶质主要成分为 (写化学式).(4)、步骤⑥合成三盐的化学方程式为 .(5)、步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是 .25. 利用工业炼铅产生的锌灰(主要成分为ZnO、PbO、FeO、MnO2、CuO)可回收制备ZnCl2 , 工艺流程如下:
(1)、步骤①PbSO4转化为难溶PbCO3的离子方程式为 .(2)、滤液1和滤液3经脱色、蒸发、结晶可得到的副产品为(写化学式).(3)、步骤③酸溶时,其中的铅与硝酸生成Pb(NO3)2及NO的离子方程式为;滤液2中溶质主要成分为 (写化学式).(4)、步骤⑥合成三盐的化学方程式为 .(5)、步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是 .25. 利用工业炼铅产生的锌灰(主要成分为ZnO、PbO、FeO、MnO2、CuO)可回收制备ZnCl2 , 工艺流程如下:
回答下列问题
(1)、“浸取”实验中,反应体系的温度、反应时间对锰脱除效果的影响如下表,则适合的温度和反应时间分别是、。表1 温度对锰脱除效果的影响
温度/℃
ρ(Mn2+)/mg·L-1
除锰率/%
10
0.325
87.9
30
0.341
89.5
50
0.424
84.3
70
0.646
76.1
表2 反应时间对锰脱除效果的影响
时间/h
ρ(Mn2+)/mg·L-1
除锰率/%
1.0
0.995
63.1
1.5
0.794
70.6
2.0
0.328
87.9
2.5
0.325
87.9
(2)、“滤渣1”的主要成分是。(3)、H2O2溶液的作用是 , 已知“滤渣2”的主要成分是Fe(OH)3 , 则氧化锌的作用是。“置换”实验中发生的反应的离子方程式有Zn+Pb2+=Ph+Zn2+、。(4)、由锌灰制取金属锌可采用碱溶解,然后电解浸取液,已知:ZnO溶于NaOH溶液中生成[Zn(OH)4]2- , 则阴极的电极反应为。(5)、ZnCl2晶体溶解于饱和Na2CO3溶液中,得到6.46g的碱式碳酸锌[Znx(CO3)y(OH)z , 为了测定其组成,充分加热分解,产生的气体依次通入浓硫酸和碱石灰,质量分别增重了0.72g和0.88g,则该碱式碳酸锌的化学式为。26. 地球上的金属矿物资源是有限的,应合理开发利用。(1)、金属冶炼的实质是金属离子被(填“氧化”或“还原”)生成金属单质。(2)、铜在自然界存在于多种矿石中,如:矿石名称
黄铜矿
辉铜矿
孔雀石
主要成分
CuFeS2
Cu2S
Cu2(OH)2 CO3
请回答下列问题:
① 上表所列铜化合物中,推断铜的质量百分含量最高的是。
② CuFeS2其中 Cu 为+1 价、Fe 为+3 价,高温焙烧时发生的反应是CuFeS2 + O2 SO2 +FeS +Cu,焙烧过程中被还原的元素有。
③ 工业上以黄铜矿为原料,采用火法熔炼工艺生产铜,火法炼铜的反应为:Cu2S+O2 2Cu+SO2 , 该反应中氧化剂是。
④ Cu2(OH)2 CO3 与稀硫酸反应的离子方程式为。
27. 信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70%Cu、25%Al、4%Fe 及少量 Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
(1)、第①步 Cu与酸反应的离子方程式为 , 得到滤渣 1的主要成分为。(2)、第②步加 H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为 Fe3+ , 用 H2O2做氧化剂的优点是。(3)、滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3 , 在生产中如何分离两种沉淀,写出反应的离子方程式。(4)、第③步蒸发所需玻璃仪器为。28. 和硅同一主族的锗也是重要的半导体材料,锗应用于航空航天测控、光纤通讯等领域。一种提纯二氧化锗粗品(主要含GeO2、As2O3)的工艺如下:
已知:①“碱浸”过程中的反应为:GeO2+2NaOH=Na2GeO3+H2O、As2O3+2NaOH=2NaAsO2+H2O
② GeCl4的熔点为-49.5℃,AsCl3与GeCl4的沸点分别为130.2℃、84℃。
(1)、砷的原子序数为33,砷在元素周期表中的位置为第周期第族。(2)、“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4 , 其反应的离子方程式为: 。(3)、传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是。(4)、“蒸馏”过程中的反应的化学方程式为:。(5)、“水解”操作时保持较低温度有利于提高产率,其最可能的原因是(答一条即可)。(6)、若1吨二氧化锗粗品(含杂质30%)经提纯得0.745吨的较纯二氧化锗产品,则杂质脱除率为。(7)、和砷同一主族的锑也可以用于半导体中。一种突破传统电池设计理念的镁—锑液态金属二次电池工作原理如图所示:
该电池由于密度的不同,在重力作用下分为三层,工作时中间层熔融盐的组成不变。充电时,Cl-向(填“上”或“下”)移动;放电时,正极的电极反应式为。
29. 某同学设计下面流程来探究含铝、铁、铜合金废料的再利用。按要求完成下列问题: (1)、试剂X为 , 试剂Y为 。(2)、反应②的离子反应方程式为。(3)、检验滤液C中是否含有Fe3+的操作为。(4)、操作III的名称为 , 该操作所用的玻璃仪器为。(5)、实验室保存FeSO4溶液时常加入铁粉,加入铁粉的作用是。30. 钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等.某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2 , 其部分工艺流程如下:
(1)、试剂X为 , 试剂Y为 。(2)、反应②的离子反应方程式为。(3)、检验滤液C中是否含有Fe3+的操作为。(4)、操作III的名称为 , 该操作所用的玻璃仪器为。(5)、实验室保存FeSO4溶液时常加入铁粉,加入铁粉的作用是。30. 钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等.某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2 , 其部分工艺流程如下: (1)、酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为 .(2)、酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是、 .(3)、该厂结合本厂实际,选用的X为(填化学式);中和Ⅰ使溶液中(填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略).(4)、上述流程中洗涤的目的是 .
(1)、酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为 .(2)、酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是、 .(3)、该厂结合本厂实际,选用的X为(填化学式);中和Ⅰ使溶液中(填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略).(4)、上述流程中洗涤的目的是 .