高考二轮复习知识点:金属冶炼的一般原理
试卷更新日期:2023-07-29 类型:二轮复习
一、选择题
-
1. 下列有关物质的工业制备反应错误的是A、合成氨:N2+3H22NH3 B、制HCl:H2+Cl22HCl C、制粗硅:SiO2+2CSi+2CO D、冶炼镁:2MgO(熔融)2Mg+O2↑2. 下列说法正确的是( )A、工业上通过电解六水合氯化镁制取金属镁 B、接触法制硫酸时,煅烧黄铁矿以得到三氧化硫 C、浓硝酸与铁在常温下不反应,所以可用铁质容器贮运浓硝酸 D、“洁厕灵”(主要成分为盐酸)和“84消毒液”(主要成分为次氯酸钠)不能混用3. 下列说法错误的是( )A、高压钠灯可用于道路照明 B、 可用来制造光导纤维 C、工业上可采用高温冶炼黄铜矿的方法获得粗铜 D、 不溶于水,可用作医疗上检查肠胃的钡餐4. 下列说法错误的是A、电解熔融氯化镁可制取金属镁 B、电解饱和食盐水可制取氯气 C、纯铁比生铁易生锈 D、硫黄或硫铁矿可用于接触法制硫酸5. 下列元素的单质,工业上不需要用电解法制取的是A、镁 B、铝 C、溴 D、氯6. 《天工开物》中关于炼锌的记载:“凡倭铅(炼锌)古书本无之,乃近世所立名色。其质用炉甘石(主要成分是)熬炼而成。……每炉甘石十斤,装载入一泥罐内,封裹泥固以渐砑牙,勿使见火折裂。然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团,冷定毁罐取出。每十耗去其二,即倭铅也。”下列有关叙述错误的是A、我国古代积累了炼锌的生产技术 B、用该方法可以炼铝和铜等 C、炼锌过程中,煤作燃料和还原剂 D、“逐层用煤炭”可增大接触面积7. 下列金属冶炼的反应原理,不恰当的是。A、2NaCl(熔融) B、 C、 D、8. 类推的思维方式在化学研究中发挥着重要作用。下列有关类推的结论正确的是A、能与溶液反应,则也可以 B、工业上用电解熔融的方法冶炼 , 故也可用电解熔融的方法冶炼 C、S与反应生成 , 故与反应也生成 D、和化学式相似,故与的物理性质也相似9. 化学与生产、生活、科技及环境等密切相关。下列说法正确的是A、侯氏制碱法应在饱和食盐水中先通二氧化碳再通氨气 B、大气中PM2.5比表面积大,吸附能力强,能吸附许多有毒有害物质 C、工业上用电解熔融氯化钠和熔融氧化镁的方法,来制备金属钠和镁 D、食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质10. 下列说法正确的是( )A、工业上制硝酸的三个主要设备为接触室、热交换器、吸收塔 B、工业上以二氧化硅为原料制备高纯硅,还需要用到焦炭、氢气、氯气等原料 C、工业上铁的冶炼加入石灰石,主要是为了吸收二氧化硫,同时得到副产物石膏 D、工业上制取镁、铝的最后一个步骤均为电解熔融氧化物11. 工业上以黑钨矿为原料利用纯碱烧结水浸法冶炼金属钨的流程如图(已知:黑钨矿的主要成分为FeWO4、MnWO4 , 同时还含有少量SiO2)。则下列说法错误的是( )

已知:①4FeWO4+O2+4Na2CO32Fe2O3+4Na2WO4+4CO2
②2MnWO4+O2+2Na2CO32MnO2+2Na2WO4+2CO2
A、烧结物粉粹成粉后,可以加快其水浸的溶解速率 B、可以采用铝热反应将WO3还原成单质W C、滤渣2成分为Fe(OH)3 D、从本题流程可以得出,同浓度的硅酸根离子比钨酸根离子结合质子能力强12. 中华诗词中蕴含着丰富的化学知识。下列关于诗词的分析错误的是( )A、“ 蜡烛有心还惜别,替人垂泪到天明”,句中蜡烛变化过程只涉及物理变化 B、“梨花院落溶溶月, 柳絮池塘淡淡风”,句中柳絮的主要成分属于糖类 C、“遍身罗绮者,不是养蚕人”,句中的罗绮不可用沸水浸泡 D、“炉火照天地,红星乱紫烟”,句中情境描述了金属的冶炼过程13. 化学与生活、社会发展息息相关。下列说法错误的是( )A、稻草秸秆和甘蔗渣中富含纤维素,可以用来制造纸张 B、将海水中的镁转化为氯化镁。再电解熔融氯化镁可制得金属镁 C、芯片制造中“光刻技术”是利用光敏树脂在曝光条件下成像,该过程发生化学变化 D、《新修本草》中有关于“青矾”性质的描述为:“本来绿色,新出扁未见风者,正如琉璃。……烧之赤色”这里的赤色是析出了单质Cu14. 下列说法错误的是( )A、原子光谱可用于鉴定氢元素 B、电解法可用于冶炼铝等活泼金属 C、分馏法可用于提高石油中乙烯的产量 D、焰色试验可用于区分NaCl和KCl15. 短周期主族元素X、Y、Z、M的原子序数依次增大,且M的原子半径在短周期主族元素中最大;2022年春节期间王亚平在太空绘制奥运“五环”时使用了试剂M2YZ3和Y2X4Z2(结构式如图),它们能使甲基橙溶液分别变为黄色、红色。下列说法正确的是( ) A、简单离子半径:M>Z B、简单氢化物的稳定性:Z>Y C、工业上采用热还原法制备M的单质 D、X、Y形成的化合物一定不能使酸性KMnO4溶液褪色16. 下列说法不正确的是( )A、“可燃冰”是天然气(甲烷等)的水合物,是一种不可再生的能源 B、利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 C、工业上常用电解熔融氯化钠来制取金属钠 D、自来水厂常用明矾、臭氧、二氧化氯等作为水处理剂,其作用都是杀菌消毒
A、简单离子半径:M>Z B、简单氢化物的稳定性:Z>Y C、工业上采用热还原法制备M的单质 D、X、Y形成的化合物一定不能使酸性KMnO4溶液褪色16. 下列说法不正确的是( )A、“可燃冰”是天然气(甲烷等)的水合物,是一种不可再生的能源 B、利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 C、工业上常用电解熔融氯化钠来制取金属钠 D、自来水厂常用明矾、臭氧、二氧化氯等作为水处理剂,其作用都是杀菌消毒二、非选择题
-
17. 钛( )及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为 ,含少量V、 和 的氧化物杂质)为原料,制备金属钛的工艺流程如下:

已知“降温收尘”后,粗 中含有的几种物质的沸点:
物质
沸点/
136
127
57
180
回答下列问题:
(1)、已知 , 的值只决定于反应体系的始态和终态,忽略 、 随温度的变化。若 ,则该反应可以自发进行。根据下图判断: 时,下列反应不能自发进行的是______________。 A、 B、 C、 D、(2)、 与C、 在 的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
A、 B、 C、 D、(2)、 与C、 在 的沸腾炉中充分反应后,混合气体中各组分的分压如下表:物质
分压/
①该温度下, 与C、 反应的总化学方程式为;
②随着温度升高,尾气中 的含量升高,原因是。
(3)、“除钒”过程中的化学方程式为;“除硅、铝”过程中,分离 中含 、 杂质的方法是。(4)、“除钒”和“除硅、铝”的顺序(填“能”或“不能”)交换,理由是。(5)、下列金属冶炼方法与本工艺流程中加入 冶炼 的方法相似的是______________。A、高炉炼铁 B、电解熔融氯化钠制钠 C、铝热反应制锰 D、氧化汞分解制汞18. 钒的用途十分广泛,有金属“维生素”之称。以含钒石煤(主要成分是、 , 含有、及、、等化合物杂质)制备单质钒的工艺流程图如下所示:
已知:①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子
开始沉淀pH
1.9
7.0
3.0
8.1
完全沉淀pH
3.2
9.0
4.7
10.1
②、、远大于。
③一般认为平衡常数反应较完全。
回答下列问题:
(1)、为了提高“焙烧”效率,可采用的措施有、。(2)、“焙烧”时,、都转化为 , 写出转化为的化学反应方程式。(3)、“水浸”加入调节溶液的pH为8.5,可完全除去的金属离子有 , 及部分的。“水浸”加入不能使完全转化,原因是。(4)、“离子交换”可表示为(为强碱性阴离子交换树脂,为在水溶液中的实际存在形式),则“洗脱”过程“淋洗液”最好选用。(5)、下列金属冶炼方法与本工艺流程中加入钙冶炼V的方法相似的是____。A、高炉炼铁 B、电解熔融NaCl制钠 C、利用铝热反应制锰 D、氧化汞分解制汞19. 某废镍催化剂的主要成分是合金,还含有少量Cr、Fe及不溶于酸碱的有机物。采用如下工艺流程回收其中的镍,制备镍的氧化物()。
回答下列问题:
(1)、“碱浸”时发生的主要反应离子方程式为。(2)、“溶解”后的溶液中,所含金属离子有、、、、。(3)、在空气中煅烧 , 其热重曲线如图1所示,300~400 ℃时转化为 , 反应的化学方程式为;400~450℃生成的固体产物的化学式为。 (4)、工业上可用电解法制取。用NaOH溶液调节溶液pH至7.5,加入适量硫酸钠后采用惰性电极进行电解。电解过程中产生的有80%在弱碱性条件下生成 , 再把二价镍氧化为三价镍。写出氧化生成的离子方程式 , a mol二价镍全部转化为三价镍时,外电路中通过的电子的物质的量为mol(假设电解时阳极只考虑放电)。(5)、金属镍的配合物的中心原子的价电子数与配体提供的成键电子总数之和为18,则n=;CO与结构相似,CO分子内键与键个数之比为。(6)、NiO的晶胞结构如图2所示,其中离子坐标参数A为(0,0,0),C为(1, , ),则B的离子坐标参数为。
(4)、工业上可用电解法制取。用NaOH溶液调节溶液pH至7.5,加入适量硫酸钠后采用惰性电极进行电解。电解过程中产生的有80%在弱碱性条件下生成 , 再把二价镍氧化为三价镍。写出氧化生成的离子方程式 , a mol二价镍全部转化为三价镍时,外电路中通过的电子的物质的量为mol(假设电解时阳极只考虑放电)。(5)、金属镍的配合物的中心原子的价电子数与配体提供的成键电子总数之和为18,则n=;CO与结构相似,CO分子内键与键个数之比为。(6)、NiO的晶胞结构如图2所示,其中离子坐标参数A为(0,0,0),C为(1, , ),则B的离子坐标参数为。 (7)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用表示,与之相反的用表示,称为电子的自旋磁量子数。对于基态铁原子,其自旋磁量子数的代数和为。20. 一种以铝矿(主要成分为 、 和 等)为原料生产金属铝的工艺流程如下:
(7)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用表示,与之相反的用表示,称为电子的自旋磁量子数。对于基态铁原子,其自旋磁量子数的代数和为。20. 一种以铝矿(主要成分为 、 和 等)为原料生产金属铝的工艺流程如下: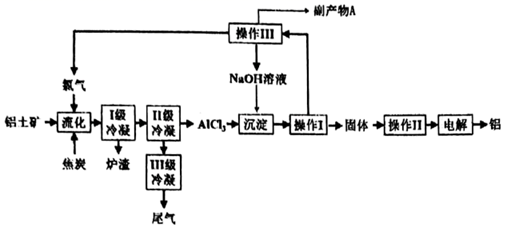
已知几种氯化物在常压时的熔、沸点:
物质
SiCl4
AlCl3
NaCl
KCl
CaCl2
沸点/℃
58
180
1465
—
1935
熔点/℃
-69
—
801
771
775
回答下列问题:
(1)、CaAl2Si2O8用氧化物形式可表示为 .(2)、“流化”阶段温度保持在900℃以上,使铝土矿中物质全部转化为氯化物。①“流化过程中NaAlSi3O8发生的化学反应方程式为 .
②Ⅱ级冷凝的温度不能高于℃
(3)、“操作Ⅱ”的名称是 , “操作Ⅲ”的名称是。(4)、副产物A为;(5)、尾气含有剧毒的COCl2 , 它能被强碱溶液能吸收,其反应的离子方程式为。21. 镁元素在自然界分布广泛,是人体的必需元素之一。工业上可用硅热法(Pidgeon法)冶炼镁,以煅白(CaO·MgO,M = 96 g/mol)为原料与硅铁(含硅75%)混合置于密闭还原炉,1200℃下发生反应:2(CaO·MgO)(s) + Si(s)⇌Ca2SiO4 (l)+2Mg(g);完成下列填空:(1)、已知还原性Mg > Si,上述反应仍能发生的原因是。(2)、由图推测上述反应正向为(填“吸热”或“放热”)反应。 (3)、若还原炉体积不变,能证明上述反应达到平衡的是(选填序号)。
(3)、若还原炉体积不变,能证明上述反应达到平衡的是(选填序号)。a.平衡常数到达最大值
b.反应物不再转化为生成物
c.炉内Ca2SiO4与CaO·MgO的质量比保持不变
d.单位时间内,n(CaO·MgO)消耗 :n(Ca2SiO4)生成 = 2:1
(4)、平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将(填“升高”“降低”或“不变”)。(5)、若还原炉容积为400 m3 , 原料中煅白质量为9600 kg,5小时后,测得煅白的转化率为50%,计算这段时间内Mg的生成速率 mol/(L·h)。(6)、工业上也可用电解法来制备镁。相关化合物的熔点如表所示:MgCl2
MgO
熔点/℃
712
2850
①镁原子核外有种能量不同的电子,它们的运动状态有种。
②MgCl2的电子式为;
③判断工业上应选择MgCl2还是MgO作为电解原料并说明理由
22. 山西南部中条山地区采矿炼铜历史悠久。黄铜矿[主要成分是 ,含少量氯磷灰石 等]为原料的火法炼铜主要流程如下:
已知:氯磷灰石高温下易被氧化为 。某化学兴趣小组以黄铜矿为原料进行如下实验探究。请根据题意回答相关问题:
(1)、燃烧碘量法测定黄铜矿中硫元素的含量。将 矿样与足量 混合,以氮气为载气,在1250℃左右高温炉中加热,将产生的 气体用含淀粉及碘化钾的稀硫酸溶液吸收,同时连续用 的 标准溶液缓慢滴定。装置如图所示( 的 价化合物比 价稳定)。
①酸性高锰酸钾溶液的作用是。
②滴定过程中涉及反应有: 、(写离子方程式),终点现象为。
③滴定至终点时,消耗标准液体积 ,矿样中硫元素的质量百分含量为(结果保留两位有效数字),若 不通过 ,则测定结果会(填“偏高”、“偏低”、“不影响”)。
(2)、利用如下装置制取粗铜。
实验开始时的操作依次为(填写序号)。
①检查装置的气密性 ②通入 气体 ③收集 并检验其纯度 ④组装仪器 ⑤点燃酒精灯 ⑥加装药品
(3)、由熔渣制得绿矾 的流程如下(已知 难溶于水)。步骤①溶解熔渣选用的试剂最好是 , 步骤②加入 的目的是将 还原(硫元素被氧化为 ),发生反应的离子方程式为 , 步骤③的系列操作为、(用乙醇)洗涤、干燥。
23. 肺炎重症患者肺部功能严重受损时,需通过气管切开术指了。手术力的材料主要是钛合金。金属钛熔点高、强度高且质地轻。工业上以钛铁矿(主要成分为FeTiO3)为原料冶炼金属钛的流程如下:
已知:室温下钛不与X2(X表示Cl、Br、I)、O2、H2O反应,也不与强酸、强碱甚至王水反应。但高温下易与氧气、氮气、碳和氢气反应。
回答下列问题。
(1)、“溶煮”过程中加硫酸时生成Ti(SO4)2 , 该过程的离子方程式为。(2)、“溶煮”过程中同时加入物质A,其目的是防止Fe2+被氧化,物质A是。(3)、已知在不同温度时硫酸亚铁在钛液中的溶解度如下表(数据以含铁量来折算)。则“操作a”为。温度/℃
30
20
14
10
5
1
-6
溶解度/(g∙L-1)
88
70
48
43
35
25
14
(4)、“过滤1”后加热滤液,使其中的Ti4+生成偏钛酸(H2TiO3)沉淀。常温下H2TiO3的沉淀溶解平衡为H2TiO3(s) TiO2++2OH- , 其溶度积常数Ksp=1.0×10-29 , 则“过滤2”所得溶液的pH约为(已知 ≈2.7, ≈1.35,lg2.7≈0.43)(5)、煅烧偏钛酸得到TiO2 , TiO2与氯气和过量焦炭共热生成TiCl4 , 写出“共热”过程中的化学方程式:。(6)、“高温”过程需要在Ar气氛中进行的理由是;利用上述方法制得的钛中可能会含有少量金属杂质 , 可用除去。24. 银及其化合物在制造钱币、电子工业、医药等方面具有广泛用途。(1)、Ⅰ.银的冶炼及性质热分解法是金属冶炼方法之一。以Ag2O为原料冶炼银的化学方程式为。
(2)、电解精炼银的工作原理如图所示,(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为。 (3)、Ⅱ.银的化合物的性质
(3)、Ⅱ.银的化合物的性质在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式__。
(4)、在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物。称取34g AgNO3固体,充分光照使其完全分解,测得反应后生成O2的体积(折合成标准状况)为2.24L,反应过程中转移电子的物质的量为。(5)、纳米硫化(Ag2S)应用广泛。Ag2S溶于浓HNO3后,产生淡黄色固体及无色气体,该气体遇空气迅速变为红棕色。写出反应的化学方程式。25. 黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源。(1)、Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如图-1所示:

① a反应中每生成1molFeSO4转移电子的物质的量为mol。
② d反应的离子方程式为。
(2)、用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如图-2
①冶炼过程中,正极周围溶液的pH(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为。
(3)、煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如图-3。相关反应
反应热
平衡常数K
FeS2(s) + H2(g) FeS(s) + H2S(g)
ΔH1
K1
1/2 FeS2(s) + H2(g) 1/2Fe(s)+H2S(g)
ΔH2
K2
FeS(s) + H2(g) Fe(s)+H2S(g)
ΔH3
K3

①上述反应中,ΔH10(选填:“>”或“<”)。
②提高硫的脱除率可采取的措施有(举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为。
26. 铍是原子能、火箭、导弹、航空、宇宙航行以及冶金工业中不可缺少的一种新兴材料。以某地的含氟铍矿(主要成分为BeO、CaF2、Al2O3、Fe2O3、SiO2及少量的硫酸盐)为原料,生产工业氧化铍的一种工艺流程如图:
已知:①25℃,Ksp(CaCO3)=8.7×10-9;Ksp(CaSO4)=2.5×10-5;
②Be(OH)2与Al(OH)3性质相似。
回答下列问题:
(1)、“熔炼”的温度为1600℃,其中约20%的Al2O3反应生成烟气(主要成分为AlF3),该反应的化学方程式为。(2)、浸渣的主要成分为CaSO4、。(3)、加入氨水中和酸浸液,若将pH调至8~9,“沉铍”时产生的沉淀物主要有:、、。(4)、“沉铍”后将滤渣加入足量氢氧化钠溶液提高pH进行“除铁”,铍元素参与反应的离子方程式为 , 然后加适量水稀释进行“水解”,目的是。(5)、若为高氟铍矿,需在“沉铍”前进行“除氟”。工业上“除氟”是加入10%的氨水,并控制一定的条件,使氟与铝铁形成共沉淀物而除去。根据如图实验数据,选择的实验条件为pH= , 水浴加热温度T=℃。 (6)、氧化铍粗产品含有一定量的硫酸盐会影响铍的后续冶炼,可用碳酸盐脱除,发生反应:CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)。通过计算反应的K值说明用碳酸钠脱硫酸根反应的程度大小:。27. 工业上以钒钛磁铁矿为原料,在炼铁的同时还可以制备钒的最高价氧化物V2O5 , 其主要流程如下:
(6)、氧化铍粗产品含有一定量的硫酸盐会影响铍的后续冶炼,可用碳酸盐脱除,发生反应:CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)。通过计算反应的K值说明用碳酸钠脱硫酸根反应的程度大小:。27. 工业上以钒钛磁铁矿为原料,在炼铁的同时还可以制备钒的最高价氧化物V2O5 , 其主要流程如下:
已知:①VO3-+2H+ VO2++H2O
②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
(1)、高炉炼铁应用的冶炼方法是_______(填标号)A、热分解法 B、热还原法 C、电解法(2)、钒渣中的V2O3在焙烧时转化为Ca(VO3)2 , 写出该反应的化学方程式。(3)、Ca(VO3)2难溶于水但能溶于稀硫酸,试用平衡移动原理分析其原因 , 浸出液中含钒物质的化学式为。(4)、沉钒过程有气体生成,其反应的离子方程式为。(5)、过滤后用乙醇代替水来洗涤沉淀的原因是。(6)、煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。加热到200℃时,得到的固体物质化学式为 , 300~350℃放出的气态物质化学式为。 28. 本题为《化学反应原理》(选修4)选做题,每空2分,共20分。(1)、氢气是一种新型的绿色能源,又是一种重要的化工原料。
28. 本题为《化学反应原理》(选修4)选做题,每空2分,共20分。(1)、氢气是一种新型的绿色能源,又是一种重要的化工原料。①氢气燃烧热值高。实验测得,在常温常压下,1molH2完全燃烧生成液态水,放出285.8kJ热量。则表示H2燃烧热的热化学方程式是(填字母代号)。
A.H2(g)+ O2(g)=H2O(g) △H=+285.8kJ·mol-1
B.H2(g)+ O2(g)=H2O(1) △H=-285.8kJ·mol-1
C.H2(g)+ O2(g)=H2O(1) △H=+285.8kJ·mol-1
D.H2+ O2=H2O △H=-285.8kJ·mol-1
②氢氧燃料电池能量转化率高,具有广阔的发展前景。氢氧燃料电池中,发生还原反应的物质是(填“氢气”或“氧气”。
③氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1
反应达到平衡后,升高温度则反应速率(填“增大”或“减小”);平衡将向 (填“正反应方向”或“逆反应方向”)移动。
(2)、锌银电池能量大、电压平衡,广泛用于电子手表、照相机、计算器和其他微型电子仪器。电解质溶液是KOH溶液,电池总反应为Zn+Ag2O=ZnO+2Ag。请回答下列问题:①该电池的负极材料是;电池工作时,阳离子向 (填“正极”或“负极”)移动。
②电极材料锌可由闪锌矿在空气中般烧成氧化锌,然后用碳还原氧化锌来制取,该反应的化学方程式为ZnO+C Zn+CO↑,此法属 (填字母代号)。
A.电解法B.热还原法C.热分解法
(3)、常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:①混合溶液的pH=8的原因:(用离子方程式表示)。
②混合溶液中由水电离出的c(H+)(填“>“<”或“=’)0.1mol·L-1NaOH溶液中由水电离出的c(H+)。
③现有NaA与HA混合溶液,若pH=7,则溶液中c(Na+)c(A-)(填“>”“<”或“=”)。
29. 铝(熔点660℃)是一种应用广泛的金属,镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业上以铝土矿(含有Al2O3、Ga2O3、SiO2等物质)为原料提取Al2O3(熔点2045℃),并将Al2O3和冰晶石(Na3AlF6 , 六氟合铝酸钠)混合熔融后电解制得。回答下列问题: (1)、冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,写出铝与CrO3在高温下反应的化学方程式 。(2)、操作I得到滤渣的主要成分有 。(3)、将0.1 mol/L AlCl3溶液和10% NH4F溶液等体积混合,充分反应后滴加氨水,无沉淀析出。则AlCl3与NH4F反应的化学方程式为 ;该实验所用试管及盛装NH4F溶液的试剂瓶均为塑料材质,原因是 。(4)、饮用水中的NO3-对人类健康会产生危害。为了降低饮用水中的NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2 , 该反应的离子方程式为 ,此方法的缺点是处理后的水中生成了AlO2- , 仍然可能对人类健康产生危害,还需对该饮用水进行一系列后续处理。已知:25℃时,Ksp[Al(OH)3]=1.3×10-33 , Al(OH)3 AlO2-+H++H2O K=1.0×10-13。25℃时,若欲使上述处理的水中AlO2-浓度降低到1.0×10-6 mol/L,则应调节至pH= , 此时水中 =。(5)、工业上常用碳棒作电极电解熔融氧化铝的方法冶炼铝(如图所示)。
(1)、冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,写出铝与CrO3在高温下反应的化学方程式 。(2)、操作I得到滤渣的主要成分有 。(3)、将0.1 mol/L AlCl3溶液和10% NH4F溶液等体积混合,充分反应后滴加氨水,无沉淀析出。则AlCl3与NH4F反应的化学方程式为 ;该实验所用试管及盛装NH4F溶液的试剂瓶均为塑料材质,原因是 。(4)、饮用水中的NO3-对人类健康会产生危害。为了降低饮用水中的NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2 , 该反应的离子方程式为 ,此方法的缺点是处理后的水中生成了AlO2- , 仍然可能对人类健康产生危害,还需对该饮用水进行一系列后续处理。已知:25℃时,Ksp[Al(OH)3]=1.3×10-33 , Al(OH)3 AlO2-+H++H2O K=1.0×10-13。25℃时,若欲使上述处理的水中AlO2-浓度降低到1.0×10-6 mol/L,则应调节至pH= , 此时水中 =。(5)、工业上常用碳棒作电极电解熔融氧化铝的方法冶炼铝(如图所示)。
①阴极电极反应式为 。
②工业生产中,阳极材料要定期补充,其原因是:。
(6)、下列有关推理不合理的是 。a.工业上可以用热还原法来制取Ga
b.酸性:Al(OH)3>Ga(OH)3
c.由最外层电子数相同可知,镓与铝的化学性质相似
d.可用GaCl3溶液、氨水和盐酸设计实验证明Ga(OH)3的两性
30. 利用工业炼铅产生的锌灰(主要成分为ZnO、PbO、FeO、MnO2、CuO)可回收制备ZnCl2 , 工艺流程如下:
回答下列问题
(1)、“浸取”实验中,反应体系的温度、反应时间对锰脱除效果的影响如下表,则适合的温度和反应时间分别是、。表1 温度对锰脱除效果的影响
温度/℃
ρ(Mn2+)/mg·L-1
除锰率/%
10
0.325
87.9
30
0.341
89.5
50
0.424
84.3
70
0.646
76.1
表2 反应时间对锰脱除效果的影响
时间/h
ρ(Mn2+)/mg·L-1
除锰率/%
1.0
0.995
63.1
1.5
0.794
70.6
2.0
0.328
87.9
2.5
0.325
87.9
(2)、“滤渣1”的主要成分是。(3)、H2O2溶液的作用是 , 已知“滤渣2”的主要成分是Fe(OH)3 , 则氧化锌的作用是。“置换”实验中发生的反应的离子方程式有Zn+Pb2+=Ph+Zn2+、。(4)、由锌灰制取金属锌可采用碱溶解,然后电解浸取液,已知:ZnO溶于NaOH溶液中生成[Zn(OH)4]2- , 则阴极的电极反应为。(5)、ZnCl2晶体溶解于饱和Na2CO3溶液中,得到6.46g的碱式碳酸锌[Znx(CO3)y(OH)z , 为了测定其组成,充分加热分解,产生的气体依次通入浓硫酸和碱石灰,质量分别增重了0.72g和0.88g,则该碱式碳酸锌的化学式为。31. 自然界中,金属元素大多以化合态存在,通过金属冶炼得到金属单质.工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但生产钾是用金属钠和熔化的KCl在一定的条件下反应制取:KCl+Na⇌NaCl+K+Q (Q<0)有关数据如表:
熔点℃
沸点℃
密度 (g/cm3)
Na
97.8
882.9
0.97
K
63.7
774
0.86
NaCl
801
1413
2.165
KCl
770
1500
1.984
(1)、请结合平衡移动理论分析,为什么能用该反应制备金属钾. .(2)、在常压下金属钾转为气态从反应混合物中分离的最低温度约为℃,而反应的最高温度应低于℃.(3)、在制取金属钾的过程中,为了提高原料的转化率可采取的措施有 . (任写两点)(4)、相比于电解熔融氯化钾,此方法的优点有(5)、常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为k=32. 工业上可以采用热还原法制备金属镁(镁沸点为1107℃,熔点是648.8℃)。(1)、将碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]和焦炭按一定比例混合,放入真空管式炉中先升温至500℃保持一段时间,然后升温至1450℃反应制得镁。
①用碳还原法制备金属镁需要在真空中而不在空气中进行,其原因是。
②焦炭与碱式碳酸镁的物质的量的比值不同对镁的还原率有较大影响,结果如图。当比值大于15∶1时,还原率下降的原因可能是。
③碱式碳酸镁分解如图所示,写出在1450℃反应制得镁的化学反应方程式。

 (2)、工业上可以采用MgCl2溶液和Na2CO3溶液混合制备碱式碳酸镁,写出反应离子方程式。反应采用68℃,温度不宜高于68℃的原因是。(3)、
(2)、工业上可以采用MgCl2溶液和Na2CO3溶液混合制备碱式碳酸镁,写出反应离子方程式。反应采用68℃,温度不宜高于68℃的原因是。(3)、工业采用电解MgCl2溶液产生Mg(OH)2 , 如图。然后用Mg(OH)2悬浊液吸收烟气中的二氧化碳,减少二氧化碳的排放同时产生碱式碳酸镁。该电池的阴极电极反应式为。电解时还得到副产物为。
 33. 铜及其化合物在生产、生活中有广泛的应用.(1)、铜可采用如下方法制备:
33. 铜及其化合物在生产、生活中有广泛的应用.(1)、铜可采用如下方法制备:火法炼铜:Cu2S+O2 2Cu+SO2
湿法炼铜:CuSO4+Fe═FeSO4+Cu
上述两种方法中,铜元素均被(填“氧化”或“还原”)成铜单质.
(2)、印刷电路板上使用的铜需要回收利用.方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2•2H2O,实验室模拟回收过程如下:

①证明步骤Ⅰ所加FeCl3溶液过量的方法是 .
②步骤2中所加的氧化剂最适宜的是 .
A.HNO3B.H2O2C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是 . (写出一种即可)
④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是(用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2•2H2O.
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)═CuSO4(aq)+2H2O(l)△H1=﹣320kJ/mol
又知:2H2O(l)═2H2O(l)+O2(g)△H2=﹣196kJ/mol
H2(g)+ O2(g)═H2O(l)△H3=﹣286kJ/mol
则反应Cu(s)+H2SO4(aq)═CuSO4(aq)+H2(g)的△H= .
(3)、欲实现反应Cu+H2SO2═CuSO4+H2 , 在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)