高考二轮复习知识点:硫化氢
试卷更新日期:2023-07-28 类型:二轮复习
一、选择题
-
1. 下列试剂不能用来鉴别和的是A、溶液 B、亚硫酸 C、溴水 D、氢硫酸2. 氨、氮、硫的化合物应用广泛。ClO2(分子空间填充模型为
 )。NaClO等含氯消毒剂可用于杀菌消毒。人工固氮可将N2转化为NH3 , 再进一步制备肼(N2H4)、硝酸、铵盐等化合物,肼和偏二甲肼(C2H8N2)常用作火箭燃料,肼的燃烧热为622.08 kJ·mol-1 , H2S可除去废水中Hg2+等重金属禹子,H2S 水溶液在空气中会缓慢氧化生成S而变诨浊。下列物质的性质与用途具有对应关系的是 A、H2S具有还原性,可除去废水中的Hg2+ B、HNO3具有强氧化性,可用于制NH4NO3 C、NH4Cl溶液呈酸性,可用于去除铁锈 D、NaClO 溶液呈碱性,可用于杀菌消毒3. 在“价—类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。如图中的字母分别代表硫及其常见化合物,相关推断不合理的是( )
)。NaClO等含氯消毒剂可用于杀菌消毒。人工固氮可将N2转化为NH3 , 再进一步制备肼(N2H4)、硝酸、铵盐等化合物,肼和偏二甲肼(C2H8N2)常用作火箭燃料,肼的燃烧热为622.08 kJ·mol-1 , H2S可除去废水中Hg2+等重金属禹子,H2S 水溶液在空气中会缓慢氧化生成S而变诨浊。下列物质的性质与用途具有对应关系的是 A、H2S具有还原性,可除去废水中的Hg2+ B、HNO3具有强氧化性,可用于制NH4NO3 C、NH4Cl溶液呈酸性,可用于去除铁锈 D、NaClO 溶液呈碱性,可用于杀菌消毒3. 在“价—类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。如图中的字母分别代表硫及其常见化合物,相关推断不合理的是( ) A、b既具有氧化性又具有还原性 B、硫酸型酸雨的形成过程涉及b到c的转化 C、a溶液与b溶液反应过程中有淡黄色沉淀生成 D、d在加热下与强碱溶液反应生成e和f,且n(e):n(f)=1:24. 常温下,利用下列试剂能制备对应气体的是( )
A、b既具有氧化性又具有还原性 B、硫酸型酸雨的形成过程涉及b到c的转化 C、a溶液与b溶液反应过程中有淡黄色沉淀生成 D、d在加热下与强碱溶液反应生成e和f,且n(e):n(f)=1:24. 常温下,利用下列试剂能制备对应气体的是( )选项
试剂
制备的气体
A
氯酸钾、浓盐酸
Cl2
B
铜、浓硫酸
SO2
C
浓硫酸、硫化亚铁
H2S
D
稀硝酸、锌
H2
A、A B、B C、C D、D5. 下列物质鉴别的方法错误的是( )A
B
C
D
物质
H2S、SO2
FeS、CuS
CH4、C2H2
Na2CO3、Na2SO4
鉴别方法
通入溴水
加入水
燃烧
加入AlCl3溶液
A、A B、B C、C D、D6. 下列物质不能用于吸收H2S的是( )A、NaOH溶液 B、FeSO4溶液 C、CuCl2溶液 D、酸性KMnO4溶液7. 天然气是应用广泛的燃料,但含有少量的H2S气体。在酸性溶液中利用硫杆菌可实现天然气的脱硫,其原理如图所示,下列说法正确的是( ) A、过程甲中的离子方程式为: B、FeSO4为该脱硫过程的催化剂 C、过程乙中每4molFe2+参加反应,需消耗22.4L的O2 D、脱硫过程中O2间接氧化H2S8. 喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是( )
A、过程甲中的离子方程式为: B、FeSO4为该脱硫过程的催化剂 C、过程乙中每4molFe2+参加反应,需消耗22.4L的O2 D、脱硫过程中O2间接氧化H2S8. 喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是( )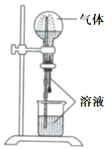
气体
溶液
A.
H2S
稀盐酸
B.
HCl
稀氨水
C.
NO
稀H2SO4
D.
CO2
饱和NaHCO3溶液
A、A B、B C、C D、D9. 下列物质不和NaOH溶液反应的是( )A、NaHCO3 B、Fe(OH)3 C、Al2O3 D、H2S10. 不能和铁反应的是( )A、H2S溶液 B、NaOH溶液 C、Fe2(SO4)3溶液 D、Cl211. 下列反应不能生成黄色固体的是( )A、氯气通入碘化钾溶液中 B、金属钠在空气中燃烧 C、碘水滴入硝酸银溶液中 D、硫化氢气体通入亚硫酸中12. 硫化氢气体不具有( )A、毒性 B、可燃性 C、还原性 D、漂白性13. 天然气是一种重要的化工原料和燃料,常含有少量H2S。一种在酸性介质中进行天然气脱硫的原理示意图如图所示。下列说法正确的是( ) A、脱硫过程中Fe2(SO4)3溶液的pH逐渐减小 B、CH4是天然气脱硫过程的催化剂 C、脱硫过程需不断补充FeSO4 D、整个脱硫过程中参加反应的n(H2S):n(O2)=2:114. 2016年8月10日《生物谷》载文称,“毒性气体”CO,NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )
A、脱硫过程中Fe2(SO4)3溶液的pH逐渐减小 B、CH4是天然气脱硫过程的催化剂 C、脱硫过程需不断补充FeSO4 D、整个脱硫过程中参加反应的n(H2S):n(O2)=2:114. 2016年8月10日《生物谷》载文称,“毒性气体”CO,NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( ) A、都是电解质 B、都易溶于水 C、都能与碱溶液反应 D、都属于共价化合物15. 部分含硫物质的分类与相应化合价关系如图所示。下列推断正确的是( )
A、都是电解质 B、都易溶于水 C、都能与碱溶液反应 D、都属于共价化合物15. 部分含硫物质的分类与相应化合价关系如图所示。下列推断正确的是( ) A、a可与氧气反应直接生成d B、b与c反应可以得到a C、c因其漂白性可以使酸性溶液褪色 D、e、f均为二元强酸16. 元素的价类二维图是学习元素及其化合物的重要模型和工具。下图为硫元素的价类二维图,其中的箭头表示部分物质间的转化关系。下列说法正确的是( )
A、a可与氧气反应直接生成d B、b与c反应可以得到a C、c因其漂白性可以使酸性溶液褪色 D、e、f均为二元强酸16. 元素的价类二维图是学习元素及其化合物的重要模型和工具。下图为硫元素的价类二维图,其中的箭头表示部分物质间的转化关系。下列说法正确的是( ) A、附着有X的试管常用酒精清洗 B、Y使溴水褪色体现了其漂白性 C、加热条件下,Z的浓溶液与铜反应能实现转化② D、Y与气体混合能实现转化①17. 硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是( )
A、附着有X的试管常用酒精清洗 B、Y使溴水褪色体现了其漂白性 C、加热条件下,Z的浓溶液与铜反应能实现转化② D、Y与气体混合能实现转化①17. 硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是( ) A、在图示的转化中,化合价不变的元素有铜、氯、氢 B、在图示的转化中,FeCl2、CuCl2未参与化学反应 C、图示转化的总反应是2H2S+O22S+2H2O D、当回收得到1mol硫单质时,转移电子的物质的量为2mol18. 常温下,下列实验能发生化学反应,却始终无明显现象的是( )A、向FeSO4溶液中通入NO2 B、向浓硫酸溶液中加入铜片 C、向NaHCO3溶液中通入NH3 D、向H2S溶液中通入SO219. 下列关于硫的化合物说法正确的是( )A、 能使品红、溴水等物质褪色,体现了漂白性 B、常温下浓硫酸可以用铝罐贮存,说明常温下铝与浓硫酸不反应 C、浓硫酸能干燥 、 等气体,体现了浓硫酸的吸水性 D、硫化氢水溶液有还原性,暴露在空气中往往会产生浑浊的现象20. 硫化氢的转化是资源利用和环境保护的重要研究课题。将和空气的混合气体通入、和的混合溶液中回收 , 其转化如下图所示(不溶于水)。下列说法中,错误的是( )
A、在图示的转化中,化合价不变的元素有铜、氯、氢 B、在图示的转化中,FeCl2、CuCl2未参与化学反应 C、图示转化的总反应是2H2S+O22S+2H2O D、当回收得到1mol硫单质时,转移电子的物质的量为2mol18. 常温下,下列实验能发生化学反应,却始终无明显现象的是( )A、向FeSO4溶液中通入NO2 B、向浓硫酸溶液中加入铜片 C、向NaHCO3溶液中通入NH3 D、向H2S溶液中通入SO219. 下列关于硫的化合物说法正确的是( )A、 能使品红、溴水等物质褪色,体现了漂白性 B、常温下浓硫酸可以用铝罐贮存,说明常温下铝与浓硫酸不反应 C、浓硫酸能干燥 、 等气体,体现了浓硫酸的吸水性 D、硫化氢水溶液有还原性,暴露在空气中往往会产生浑浊的现象20. 硫化氢的转化是资源利用和环境保护的重要研究课题。将和空气的混合气体通入、和的混合溶液中回收 , 其转化如下图所示(不溶于水)。下列说法中,错误的是( ) A、过程①中,生成的反应为 B、过程②中,作氧化剂 C、过程③中,各元素化合价均未改变 D、回收S的总反应为21. 将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法错误的是( )
A、过程①中,生成的反应为 B、过程②中,作氧化剂 C、过程③中,各元素化合价均未改变 D、回收S的总反应为21. 将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法错误的是( ) A、过程①发生非氧化还原反应 B、过程②中,发生反应为S2-+Fe3+=S+Fe2+ C、过程③中,氧气是氧化剂 D、整个转化过程中Fe3+可以循环使用22. 室温下,向100mL饱和的H2S溶液中通入SO2气体(气体体积换算成标准状况),发生反应:2H2S+SO2=3S↓+2H2O,测得溶液pH与通入SO2的关系如图所示。下列有关说法错误的是( )
A、过程①发生非氧化还原反应 B、过程②中,发生反应为S2-+Fe3+=S+Fe2+ C、过程③中,氧气是氧化剂 D、整个转化过程中Fe3+可以循环使用22. 室温下,向100mL饱和的H2S溶液中通入SO2气体(气体体积换算成标准状况),发生反应:2H2S+SO2=3S↓+2H2O,测得溶液pH与通入SO2的关系如图所示。下列有关说法错误的是( ) A、a点水的电离程度最大 B、该温度下H2S的Ka1≈10-7.2 C、曲线y代表继续通入SO2气体后溶液pH的变化 D、a点之后,随SO2气体的通入, 的值始终减小23. H2S是一种大气污染物。干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。下列说法错误的是( )
A、a点水的电离程度最大 B、该温度下H2S的Ka1≈10-7.2 C、曲线y代表继续通入SO2气体后溶液pH的变化 D、a点之后,随SO2气体的通入, 的值始终减小23. H2S是一种大气污染物。干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。下列说法错误的是( ) A、单质硫为淡黄色固体 B、脱硫反应为3H2S+Fe2O3·H2O=Fe2S3·H2O+3H2O C、再生过程中,硫元素被还原 D、脱硫过程中,增大反应物的接触面积可提高脱硫效率24. 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
A、单质硫为淡黄色固体 B、脱硫反应为3H2S+Fe2O3·H2O=Fe2S3·H2O+3H2O C、再生过程中,硫元素被还原 D、脱硫过程中,增大反应物的接触面积可提高脱硫效率24. 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
选项
X
Y
Z
R
A
Al
AlCl3
Al(OH)3
NaAlO2
B
Na
Na2O
Na2O2
NaOH
C
H2S
S
SO2
SO3
D
N2
NH3
NO
NO2
A、A B、B C、C D、D25. 下列各组物质中,物质之间不可能实现如图所示变化的是( )
X
Y
Z
A
H2S
S
SO2
B
NH3
NO
NO2
C
Fe
FeCl2
FeCl3
D
Mg
C
CO
A、A B、B C、C D、D二、非选择题
-
26. 硫化氢(H2S)是一种有害气体,可用多种方法进行脱除。(1)、含H2S的酸性溶液对钢管壁的危害如图1所示,钢管壁内部的缺陷处会积聚H2 , 产生的压力对管壁造成危害。缺陷处产生H2的微观过程可描述为
 (2)、一种转化H2S的燃料电池工作原理如图2所示。该电池工作时,负极的电极反应式为。
(2)、一种转化H2S的燃料电池工作原理如图2所示。该电池工作时,负极的电极反应式为。 (3)、一种脱除H2S回收硫磺工艺的两个阶段主要反应分别如下:
(3)、一种脱除H2S回收硫磺工艺的两个阶段主要反应分别如下:第一阶段:
第二阶段:
该工艺需控制第一阶段与第二阶段参加反应的H2S的物质的量之比n1(H2S):n2(H2S)约为1:2。若n1(H2S):n2(H2S)过大,会导致。
(4)、Fe2(SO4)3溶液脱除空气中H2S并再生的原理如图3所示。
①Fe2(SO4)3溶液脱除空气中H2S的总反应化学方程式为。
②将一定体积含H2S的空气匀速通入Fe2(SO4)3溶液中,反应相同时间,初始Fe3+浓度ρ(Fe3+)及其pH与H2S脱除率的关系如图4所示。当ρ(Fe3+)>10g·L-1 , H2S脱除率下降的原因是。
 27. 根据所学知识完成下面题目:(1)、H2S分子中H﹣S键的键角为92°,说明H2S分子是(选填“极性”“非极性”)分子.可用FeS与稀硫酸制取 H2S气体,而CuS不溶于稀硫酸,请据此比较FeS、H2S、CuS这三种物质电离或溶解出S2﹣的能力 . 实验室制取并收集H2S气体,除FeS和稀硫酸外,还必需的试剂是 .(2)、在NaOH和NaClO混合溶液中,多硫化钠(Na2SX)会被氧化为Na2SO4 , 此时1molNa2SX失去的电子数为 mol;若Na2SX与NaClO反应的物质的量之比为1:10,则x= .(3)、往Na2S和Na2S2O3混合溶液中加入稀硫酸,指出反应现象 .(4)、已知25℃:H2S Ki1=9.1×10﹣8 Ki2=1.1×10﹣12;H2SO3 Ki1=1.5×10﹣2 Ki2=1.0×10﹣7将amolSO2通入含bmolNa2S的溶液中完全反应,若没有硫化氢气体产生,则a:b的值为 .28. 某元素的价类二维图如图所示。常温常压下,A是一种具有臭鸡蛋气味的气体,组成单质X的元素为地壳中的含量最高的元素,Y是一种常见的无色无味的液体,Z为碱且其焰色试验为黄色。
27. 根据所学知识完成下面题目:(1)、H2S分子中H﹣S键的键角为92°,说明H2S分子是(选填“极性”“非极性”)分子.可用FeS与稀硫酸制取 H2S气体,而CuS不溶于稀硫酸,请据此比较FeS、H2S、CuS这三种物质电离或溶解出S2﹣的能力 . 实验室制取并收集H2S气体,除FeS和稀硫酸外,还必需的试剂是 .(2)、在NaOH和NaClO混合溶液中,多硫化钠(Na2SX)会被氧化为Na2SO4 , 此时1molNa2SX失去的电子数为 mol;若Na2SX与NaClO反应的物质的量之比为1:10,则x= .(3)、往Na2S和Na2S2O3混合溶液中加入稀硫酸,指出反应现象 .(4)、已知25℃:H2S Ki1=9.1×10﹣8 Ki2=1.1×10﹣12;H2SO3 Ki1=1.5×10﹣2 Ki2=1.0×10﹣7将amolSO2通入含bmolNa2S的溶液中完全反应,若没有硫化氢气体产生,则a:b的值为 .28. 某元素的价类二维图如图所示。常温常压下,A是一种具有臭鸡蛋气味的气体,组成单质X的元素为地壳中的含量最高的元素,Y是一种常见的无色无味的液体,Z为碱且其焰色试验为黄色。
按要求回答下列问题∶
(1)、写出下列物质的化学式∶D;E 。(2)、用电子式表示A的形成过程∶。(3)、将C通入A的水溶液中,可观察到的现象为。(4)、G转化为F的化学方程式为。29.(1)、将下列现象中硫酸表现出来的性质填写在空格内:敞口放置的浓硫酸,溶液质量增加;浓硫酸与蔗糖放出大量热,并出现黑色固体;(2)、将一瓶二氧化硫和一瓶硫化氢气体瓶口对接进行混合,瓶壁上能观察到有和生成,其化学反应方程式为: , 此反应中SO2作剂, 1 mol 二氧化硫和硫化氢完全反应时,有mol电子发生转移。(3)、当雨水的pH时,我们称之为“酸雨”。某环保小组测定某次雨水中硫酸的物质的量浓度为5×10-6 mol/L,这次雨酸雨(选填“属于”或“不属于”)。常温下若把0.1mol/L的盐酸溶液稀释100倍,此时的溶液的pH=。(4)、将一充满氨气的大试管倒立在水槽中,可以看到现象 , 说明 , 若在此溶液中滴入酚酞试液,溶液呈色,其电离方程式。30. 阅读下列信息:Ⅰ.表中①~⑥为短周期元素主要化合价及最简单氢化物沸点的数据:
元素性质
元素编号
①
②
③
④
⑤
⑥
氢化物沸点(℃)
-33.4
100
19.54
-87.7
-60.7
-84.9
主要化合价
+5
-3
-2
-1
+5
-3
+6
-2
+7
-1
A,B,C均为上表中的元素;
Ⅱ.A与B可形成化合物A
B、AB2 , AB2与水反应生成强酸甲;
Ⅲ.C与B可形成化合物CB2、CB3 , CB3与水反应生成强酸乙。
请回答:
(1)、表中两种同族元素的氢化物所含电子数相同,这两种氢化物之间能发生氧化还原反应生成一种单质和一种化合物,写出该反应的化学方程式。(2)、测定元素③的氢化物的相对分子质量时常常偏大,原因是。为了尽可能减小偏差,通常选择温度压强条件(选填“高”、“低”)。(3)、甲、乙分别与元素①的氢化物反应生成丙、丁、戊三种盐。0.1 mol/L的甲、乙、丙、丁、戊五种溶液,pH由小到大排列的顺序是(填写化学式)。(4)、一种断路器的气体绝缘介质是③、⑤两种元素的原子形成的正八面体分子,⑤原子位于中心,其分子式为 , 该分子属于(选填“极性”、“非极性”)分子,该气体不能燃烧,原因是(指出两种元素的化合价并做简单分析)。