高考二轮复习知识点:硫酸盐
试卷更新日期:2023-07-28 类型:二轮复习
一、选择题
-
1. 下列说法错误的是( )A、高压钠灯可用于道路照明 B、 可用来制造光导纤维 C、工业上可采用高温冶炼黄铜矿的方法获得粗铜 D、 不溶于水,可用作医疗上检查肠胃的钡餐2. 北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列有关叙述错误的是( )A、胆矾的化学式为CuSO4 B、胆矾可作为湿法冶铜的原料 C、“熬之则成胆矾”是浓缩结晶过程 D、“熬胆矾铁釜,久之亦化为铜”是发生了置换反应3. “矾”是一类金属硫酸盐的结晶水合物,在生活和生产中有着重要应用,下列有关“矾”的说法正确的是( )A、蓝矾(CuSO4·5H2O)是一种纯净物,可用于检验酒精中是否含有水 B、明矾[KAl(SO4)2·12H2O]常用于净水,其水溶液显中性 C、铁铵矾[NH4 Fe(SO4)2·12H2O]是一种媒染剂,其中Fe的化合价为+3价 D、皓矾(ZnSO4·7H2O)常用作医学收敛剂,铁单质与其溶液反应能置换出Zn4. 下列与化学有关的文献,理解错误的是( )A、《咏石灰》(明·于谦)中“烈火焚烧若等闲,要留清白在人间”,其中“清白”是指氢氧化钙 B、《咏煤炭》(明·于谦)中“凿开混沌得乌金,不辞辛苦出山林”,其中“乌金”的主要成分是煤炭 C、《天工开物》中有“至于矾现五色之形,硫为群石之将,皆变化于烈火”,其中的矾一般指时是金属硫酸盐 D、《天工开物》中有如下描述:“世间丝、麻、裘、褐皆具素质”,文中的“裘”主要成分是蛋白质5. 医疗上用作 X 射线透视肠胃的内服药“钡餐”的物质是( )A、BaCO3 B、Ba(OH)2 C、BaCl2 D、BaSO46. 在“价—类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。如图中的字母分别代表硫及其常见化合物,相关推断不合理的是( )
 A、b既具有氧化性又具有还原性 B、硫酸型酸雨的形成过程涉及b到c的转化 C、a溶液与b溶液反应过程中有淡黄色沉淀生成 D、d在加热下与强碱溶液反应生成e和f,且n(e):n(f)=1:27. 自古以来,化学与人类生产、生活密切相关,下列有关说法错误的是( )A、唐代诗人刘禹锡的《浪淘沙》中“美人首饰侯王印,尽是沙中浪底来”不涉及氧化还原反应 B、《天工开物》中“至于矾现五金色之形硫为群石之将,皆变化于烈火”,其中矾指的是金属硫酸盐 C、燃煤中加入 可以减少酸雨的形成及温室气体的排放 D、中国华为自主研发的 芯片巴龙5000的主要材料是硅8. 10℃时,分别向4支小试管中滴加8滴1mol/LCuSO4溶液,再分别向其中滴加2mol/LNaOH溶液,边滴加边振荡,实验数据及现象如下表:
A、b既具有氧化性又具有还原性 B、硫酸型酸雨的形成过程涉及b到c的转化 C、a溶液与b溶液反应过程中有淡黄色沉淀生成 D、d在加热下与强碱溶液反应生成e和f,且n(e):n(f)=1:27. 自古以来,化学与人类生产、生活密切相关,下列有关说法错误的是( )A、唐代诗人刘禹锡的《浪淘沙》中“美人首饰侯王印,尽是沙中浪底来”不涉及氧化还原反应 B、《天工开物》中“至于矾现五金色之形硫为群石之将,皆变化于烈火”,其中矾指的是金属硫酸盐 C、燃煤中加入 可以减少酸雨的形成及温室气体的排放 D、中国华为自主研发的 芯片巴龙5000的主要材料是硅8. 10℃时,分别向4支小试管中滴加8滴1mol/LCuSO4溶液,再分别向其中滴加2mol/LNaOH溶液,边滴加边振荡,实验数据及现象如下表:试管编号
1
2
3
4
滴加NaOH溶液的量
2滴
6滴
12滴
16滴
立即观察沉淀的颜色
浅绿色
浅绿色
蓝色
蓝色
酒精灯加热浊液后沉淀的颜色
浅绿色
浅绿色
黑色
黑色
取浅绿色沉淀用蒸馏水反复洗涤,加入稀盐酸完全溶解,再加入适量BaCl2溶液,产生大量白色沉淀。取蓝色沉淀重复上述实验,无白色沉淀。经检验,试管3、4中黑色沉淀中含有CuO。
下列说法错误的是( )
A、由实验现象可知浅绿色沉淀中可能含有碱式硫酸铜 B、CuSO4溶液与NaOH溶液反应时,其相对量不同可以得到不同的产物 C、试管3、4中的固体在加热过程中发生了反应:Cu(OH)2 CuO+H2O D、取浅绿色沉淀再滴加适量NaOH溶液后加热仍不会变黑9. 硫酸盐(含SO 、HSO )气溶胶是PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下。下列说法错误的是( ) A、该过程中有H2O参与反应 B、硫酸盐气溶胶呈酸性 C、NO2是生成硫酸盐的催化剂 D、该过程中有氧氢键断裂10. 某同学想用实验证明硫酸铜溶液的蓝色与SO42-无关。下列实验无意义的是( )A、观察明矾溶液为无色 B、取样,加水稀释,溶液蓝色变浅 C、取样,滴加过量硝酸钡溶液,溶液仍为蓝色 D、取样,滴加过量氢氧化钠溶液,溶液变成无色11. 下列根据实验操作和现象所得出的结论正确的是( )
A、该过程中有H2O参与反应 B、硫酸盐气溶胶呈酸性 C、NO2是生成硫酸盐的催化剂 D、该过程中有氧氢键断裂10. 某同学想用实验证明硫酸铜溶液的蓝色与SO42-无关。下列实验无意义的是( )A、观察明矾溶液为无色 B、取样,加水稀释,溶液蓝色变浅 C、取样,滴加过量硝酸钡溶液,溶液仍为蓝色 D、取样,滴加过量氢氧化钠溶液,溶液变成无色11. 下列根据实验操作和现象所得出的结论正确的是( )选项
实验操作
实验现象
结论
A
蘸有浓氨水的玻璃棒靠近溶液X
有白烟产生
溶液X一定是浓盐酸
B
用玻璃棒蘸取溶液Y进行焰色反应实验
火焰呈黄色
溶液Y中一定含Na+
C
向Fe(NO3)2溶液中滴加硫酸酸化的H2O2溶液
溶液变黄
氧化性:H2O2>Fe3+
D
用煮沸过的蒸馏水将Na2SO3固体样品溶解,加稀盐酸酸化,再加入氯化钡溶液
有白色沉淀产生
Na2SO3样品中含有SO42-
A、A B、B C、C D、D12. 下列物质的名称与其化学式不对应的是( )A、臭氧:O3 B、生石膏:CaSO4•2H2O C、苯甲酸: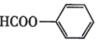 D、3,3- 二 甲基己烷:
D、3,3- 二 甲基己烷: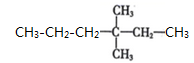 13. 某化学兴趣小组称取纯净的Na2SO3 ·7H20 a克,隔绝空气加强热至恒重,经过分析与计算,得到的固体质量与全部转化为亚硫酸钠固体的计算值一致,但固体在水中溶解后测的pH值比理论计算值(相同浓度Na2SO3溶液的pH)大很多。下列说法错误的是( )A、连续两次称量强热前后固体的质量,如质量差小于0.1g,即可判断固体已经恒重 B、产生上述矛盾的可能解释:4Na2SO3 3Na2SO4 + Na2S C、固体产物中加入稀盐酸可能有淡黄色沉淀产生 D、加入BaCl2溶液,出现白色沉淀,则能确定产物中有Na2SO414. 下列有关物质用途的说法,错误的是( )A、二氧化硫常用于漂白纸浆 B、漂粉精可用于游泳池水消毒 C、碳酸钡可用来治疗胃酸过多 D、氧化铁常用于红色油漆和涂料15. 中国丝绸有五千年的历史和文化。古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐, 能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮这种“碱剂”可能是( )
13. 某化学兴趣小组称取纯净的Na2SO3 ·7H20 a克,隔绝空气加强热至恒重,经过分析与计算,得到的固体质量与全部转化为亚硫酸钠固体的计算值一致,但固体在水中溶解后测的pH值比理论计算值(相同浓度Na2SO3溶液的pH)大很多。下列说法错误的是( )A、连续两次称量强热前后固体的质量,如质量差小于0.1g,即可判断固体已经恒重 B、产生上述矛盾的可能解释:4Na2SO3 3Na2SO4 + Na2S C、固体产物中加入稀盐酸可能有淡黄色沉淀产生 D、加入BaCl2溶液,出现白色沉淀,则能确定产物中有Na2SO414. 下列有关物质用途的说法,错误的是( )A、二氧化硫常用于漂白纸浆 B、漂粉精可用于游泳池水消毒 C、碳酸钡可用来治疗胃酸过多 D、氧化铁常用于红色油漆和涂料15. 中国丝绸有五千年的历史和文化。古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐, 能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮这种“碱剂”可能是( )
A、草木灰 B、火碱 C、食盐 D、胆矾16. 下列说法错误的是( )A、硫酸钡可用作白色颜料,并可用作医疗上检查肠胃的钡餐 B、钠钾合金在常温下是液体,可用于快中子反应堆作热交换剂 C、工业上可用氨水消除燃煤烟气中的二氧化硫 D、镁是优质的耐高温材料,被大量用于制造火箭、导弹和飞机的部件等17. 《天工开物》中记载“凡火药,硫为纯阳,硝为纯阴”,其中“硫”指的是( )A、硫酸 B、硫磺 C、硫酸钠 D、硫化钠18. 下列实验操作规范且能达到目的的是( )A
B
C
D




验证的存在
氨气的收集
氯气的净化
分离和
A、A B、B C、C D、D19. 如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列说法正确的是( ) A、蓝色石蕊试纸先变红后褪色 B、品红试纸、蘸有KMnO4溶液的滤纸均褪色都能证明SO2的漂白性 C、湿润的淀粉KI试纸未变蓝说明SO2的氧化性强于I2 D、NaOH溶液可用于除去实验中多余的SO220. 胆矾(CuSO4•5H2O)高温时发生反应:2CuSO4•5H2O
A、蓝色石蕊试纸先变红后褪色 B、品红试纸、蘸有KMnO4溶液的滤纸均褪色都能证明SO2的漂白性 C、湿润的淀粉KI试纸未变蓝说明SO2的氧化性强于I2 D、NaOH溶液可用于除去实验中多余的SO220. 胆矾(CuSO4•5H2O)高温时发生反应:2CuSO4•5H2O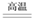 2CuO + 2SO2↑+ O2↑+ 10H2O。下列装置能达到实验目的的是( ) A、
2CuO + 2SO2↑+ O2↑+ 10H2O。下列装置能达到实验目的的是( ) A、 可用于胆矾分解
B、
可用于胆矾分解
B、 可用于检验产物是否含H2O
C、
可用于检验产物是否含H2O
C、 可用于收集SO2
D、
可用于收集SO2
D、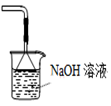 可用于吸收胆矾分解的SO2
21. 化学与生产、生活密切相关,下列说法正确的是( )A、全球首段光伏高速公路亮相济南,光伏发电所用电池板主要材料是二氧化硅 B、《物理小识》记载“青矾(绿矾)厂气熏人,衣服当之易烂,栽木不茂”,青矾厂气是CO和CO2 C、平昌冬奥会“北京8分钟” 主创团队用石墨烯制作发热服饰,说明石墨烯是能导热的金属材料 D、《本草纲目》描述“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”其中的碱是K2CO322. 唐代中药学著作《新修本草》中,有关于“青矾”的记录为“本来绿色,新出窟未见风者,正如琉璃,……,烧之赤色”。据此推测,“青矾”的主要成分为()A、CuSO4·5H2O B、FeSO4·7H2O C、KAl(SO4)2·12H2O D、ZnSO4·7H2O23. 下列陈述Ⅰ、Ⅱ符合题意并且有因果关系的是( )
可用于吸收胆矾分解的SO2
21. 化学与生产、生活密切相关,下列说法正确的是( )A、全球首段光伏高速公路亮相济南,光伏发电所用电池板主要材料是二氧化硅 B、《物理小识》记载“青矾(绿矾)厂气熏人,衣服当之易烂,栽木不茂”,青矾厂气是CO和CO2 C、平昌冬奥会“北京8分钟” 主创团队用石墨烯制作发热服饰,说明石墨烯是能导热的金属材料 D、《本草纲目》描述“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”其中的碱是K2CO322. 唐代中药学著作《新修本草》中,有关于“青矾”的记录为“本来绿色,新出窟未见风者,正如琉璃,……,烧之赤色”。据此推测,“青矾”的主要成分为()A、CuSO4·5H2O B、FeSO4·7H2O C、KAl(SO4)2·12H2O D、ZnSO4·7H2O23. 下列陈述Ⅰ、Ⅱ符合题意并且有因果关系的是( )选项
陈述Ⅰ
陈述Ⅱ
A
Fe3+具有氧化性
用KSCN溶液可以鉴别Fe3+
B
浓硫酸具有脱水性和强氧化性
浓硫酸滴到湿润的蔗糖中,蔗糖变成黑色海绵状
C
SiO2有导电性
SiO2可用于制备光导纤维
D
饱和BaSO4溶液中加入饱和Na2CO3溶液有白色沉淀
Ksp(BaSO4)<Ksp(BaCO3)
A、A B、B C、C D、D二、非选择题
-
24. 硫代硫酸钠(Na2S2O3),又名大苏打、海波,它是无色透明的单斜晶体,熔点48℃。硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应原理为AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。(1)、Ⅰ.为了从废定影液中提取 AgNO3 , 设计如下实验流程。
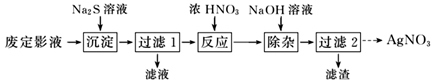
“沉淀”步骤中生成 Ag2S 沉淀,检验沉淀完全的操作是。
(2)、“反应”步骤中会生成淡黄色固体,该反应的化学方程式为。(3)、“过滤 2”的溶液获取 AgNO3晶体的操作是蒸发浓缩、冷却结晶、、、干燥。(4)、Ⅱ.下图是实验室模拟工业制备 Na2S2O3 的装置图。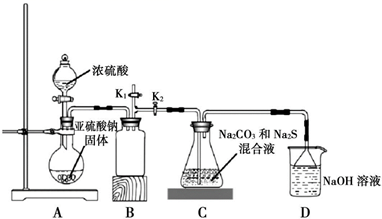
依据图示回答下列问题:
装置 A 中盛放亚硫酸钠固体的玻璃仪器名称是 , 装置 B 的作用是。
(5)、分液漏斗中如直接用 98%的浓硫酸,烧瓶中固体易产生“结块”现象,使反应速率变慢。产生“结块”现象的原因是。(6)、设置 K1导管的目的是为了防止拆除装置时造成空气污染。请简述操作方法。(7)、硫代硫酸钠还可用于除去鞣制皮革时过量的重铬酸盐,将其还原成 Cr3+ , 理论上处理1mol Cr2O72-需要 Na2S2O3的质量为。25. 二氧化硫直接排放会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3 , 其流程如图1。
已知:H2SO3、HSO3−、SO32−在水溶液中的物质的量分数随pH的分布如图2,Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
 (1)、Na2CO3溶液显碱性,用离子方程式解释其原因:。(2)、吸收烟气
(1)、Na2CO3溶液显碱性,用离子方程式解释其原因:。(2)、吸收烟气①为提高NaHSO3的产率,应控制吸收塔中的pH为。
②已知下列反应:
SO2(g)+2OH−(aq)=SO32−(aq)+H2O(l)ΔH1=−164.3kJ·mol−1
CO2(g)+2OH−(aq)=CO32−(aq)+H2O(l)ΔH2=−109.4kJ·mol−1
2HSO3−(aq)=SO32−(aq)+SO2(g)+H2O(l)ΔH3=+34.0kJ·mol−1
吸收塔中Na2CO3溶液吸收SO2生成HSO3−的热化学方程式是。
③吸收塔中的温度不宜过高,可能的原因是(写出1种即可)。
(3)、制备无水Na2SO3①中和塔中反应的离子方程式为。
②从中和塔得到的Na2SO3溶液中要获得无水Na2SO3固体,需控制温度 , 同时还要 , 以防止Na2SO3氧化。
26. 以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。实验
试剂
现象
滴管
试管

2 mL
0.2 mol·L−1 Na2SO3溶液
饱和Ag2SO4溶液
Ⅰ.产生白色沉淀
0.2 mol·L−1 CuSO4溶液
Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀
0.1 mol·L−1 Al2(SO4) 3溶液
Ⅲ.开始无明显变化,继续滴加产生白色沉淀
(1)、经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:。(2)、经检验,现象Ⅱ的棕黄色沉淀中不含SO42− , 含有Cu+、Cu2+和SO32−。已知:Cu+ Cu +Cu2+ , Cu2+ CuI↓(白色) +I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是。
②通过下列实验证实,沉淀中含有Cu2+和SO32−。

a.白色沉淀A是BaSO4 , 试剂1是。
b.证实沉淀中含有Cu2+和SO32−的理由是。
(3)、已知:Al2(SO4) 3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42− , 该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。①推测沉淀中含有亚硫酸根和。
②对于沉淀中亚硫酸根的存在形式提出两种假设:
i.被Al(OH) 3所吸附;
ii.存在于铝的碱式盐中。
对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。

步骤二:(按上图形式呈现) 。
(4)、根据实验,亚硫酸盐的性质有。盐溶液间反应的多样性与有关。27. 某小组同学设计实验实现几种价态硫元素的转化。任务I:从以下试剂中选择合适的试剂实现→的转化。
试剂清单:①浓H2SO4②稀H2SO4③酸性KMnO4溶液④品红⑤Cu
(1)、写出实现转化的化学方程式。(2)、设计实验证明实现了该转化(写出操作和现象)。任务II:实现硫元素在不同价态之间的转化。
溶液SO2Na2SO3溶液Na2SO4溶液
(3)、欲制备Na2S2O3 , 从氧化还原角度分析,合理的是____(填字母)。A、Na2S+S B、Na2SO3+S C、Na2SO3+Na2SO4 D、SO2+Na2SO4(4)、转化Ⅱ中加入的物质可以是。(填物质类别)(5)、转化Ⅲ可以通入氧气来实现,写出相应离子方程式。28. 现有一份MgSO4和(NH4)2SO4的混合溶液,向该溶液中加入一定浓度的Ba(OH)2溶液,产生的沉淀质量(m)与加入Ba(OH) 2溶液的体积(V)关系如图。 (1)、Ba(OH)2溶液的物质的量浓度为mol•L-1。(2)、该混合溶液MgSO4和(NH 4)2SO4物质的量之比为。29. 亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下:
(1)、Ba(OH)2溶液的物质的量浓度为mol•L-1。(2)、该混合溶液MgSO4和(NH 4)2SO4物质的量之比为。29. 亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下: (1)、SO2对环境的危害主要是形成。(2)、用Na2CO3溶液能吸收SO2的原因是。(3)、查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中发生如下反应:
(1)、SO2对环境的危害主要是形成。(2)、用Na2CO3溶液能吸收SO2的原因是。(3)、查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中发生如下反应:①2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3
②2NaHCO3+ SO2+H2O=2CO2↑+Na2SO3
③Na2SO3+ SO2+H2O=2NaHSO3
溶液中有关组分的质量分数变化如图是所示,图中的线2表示的组分为(填化学式)。
 (4)、实验时,“反应II”中加入NaOH溶液的目的是(用化学方程式表示)。(5)、获得的Na2SO3产品久置后质量变重,主要原因是。30. 物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
(4)、实验时,“反应II”中加入NaOH溶液的目的是(用化学方程式表示)。(5)、获得的Na2SO3产品久置后质量变重,主要原因是。30. 物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题: (1)、Y的化学式为 , 检验Y所用的试剂是。(2)、W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为。(3)、欲制备Na2S2O3 , 从氧化还原角度分析,合理的是(填序号)。
(1)、Y的化学式为 , 检验Y所用的试剂是。(2)、W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为。(3)、欲制备Na2S2O3 , 从氧化还原角度分析,合理的是(填序号)。a.Na2S + S b.Na2SO3 + S c.Na2SO3 + Na2SO4 d.SO2 + Na2SO4
(4)、将X与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为。