高考二轮复习知识点:硫酸根离子的检验
试卷更新日期:2023-07-28 类型:二轮复习
一、选择题
-
1. 下列鉴别或检验不能达到实验目的的是A、用石灰水鉴别Na2CO3与NaHCO3 B、用KSCN溶液检验FeSO4是否变质 C、用盐酸酸化的BaCl2溶液检验Na2SO3是否被氧化 D、加热条件下用银氨溶液检验乙醇中是否混有乙醛2. 化学是以实验为基础的科学。下列实验设计能达到实验目的的是( )
选项
实验目的
实验设计
A
除去乙酸乙酯中的乙酸
加入饱和Na2CO3溶液,振荡后分液
B
检验Na2SO3固体是否变质
取少量固体溶于水,加入硝酸酸化的Ba(NO3)2溶液,观察现象
C
证明HClO的酸性比H2CO3的弱
用pH计测定NaClO溶液和Na2CO3溶液的pH,比较两溶液pH的大小
D
配制100mL一定浓度的NaOH溶液
准确称取NaOH固体,放入100mL的容量瓶中,加水溶解,振荡摇匀,定容
A、A B、B C、C D、D3. 下列实验操作、现象与预期实验目的或所得实验结论一致的是( )选项
实验操作
现象
结论
A
向某溶液中加入稀盐酸酸化,再加入BaCl2溶液
酸化后溶液中无现象,再加溶液后观察到有白色沉淀生成
该溶液中存在SO离子
B
向苯酚浊液中加入Na2CO3溶液
溶液变澄清
酸性:苯酚>碳酸
C
用洁净的铂丝蘸取某溶液进行焰色反应
焰色呈黄色
该溶液为钠盐溶液
D
向FeCl2溶液中滴加KSCN溶液
溶液变红
FeCl2已完全变质
A、A B、B C、C D、D4. 燃煤烟气中含有 和 等物质,用如图装置测定 含量。已知异丙醇溶液可选择性吸收 并转化为 ,也可溶解少量 ,实验中应尽快除去 。
下列说法错误的是( )
A、用空气吹出异丙醇溶液中溶解的 B、通过测定 的质量检测 含量 C、该过程中涉及到反应: D、 冰浴可减少异丙醇的挥发5. 短周期主族元素W、X、Y、Z的原子序数依次增大。A是元素Y的单质。常温下,A遇甲的浓溶液发生钝化。丙、丁、戊是由这些元素组成的二元化合物,丁和戊的组成元素相同,且丙是无色气体,上述物质的转化关系如图所示。下列说法正确的是( ) A、简单氢化物的沸点:X>Z B、简单离子半径大小:X<Y C、丁分子和戊分子的空间结构相同 D、Y的简单离子与Z的简单离子在水溶液中可大量共存6. 某实验小组探究SO2与AgNO3溶液的反应,实验记录如下:
A、简单氢化物的沸点:X>Z B、简单离子半径大小:X<Y C、丁分子和戊分子的空间结构相同 D、Y的简单离子与Z的简单离子在水溶液中可大量共存6. 某实验小组探究SO2与AgNO3溶液的反应,实验记录如下:序号
Ⅰ
Ⅱ
Ⅲ
实验
步骤



实验现象
得到无色溶液a和白色沉淀b
产生无色气体,遇空气变为红棕色
产生白色沉淀
下列说法正确的是( )
A、透过测Ⅰ中无色溶液a的pH可以判断SO2是否被氧化 B、实验Ⅱ说明白色沉淀b具有还原性 C、实验Ⅲ说明溶液a中一定有 生成 D、实验Ⅰ、Ⅱ、Ⅲ说明SO2与AgNO3溶液反应既有Ag2SO4生成,又有Ag2SO3生成7. 下列根据实验操作和现象所得出的结论正确的是( )选项
实验操作和现象
结论
A
向纤维素中加入适量硫酸溶液,微热一段时间后,滴加新制的氢氧化铜悬浊液,加热煮沸,未发现砖红色沉淀生成
纤维素没有水解或者已经水解但水解后的产物中没有葡萄糖
B
1-溴丙烷与NaOH的乙醇溶液共热,有气体生成,该气体可使酸性高锰酸钾溶液褪色
该气体是丙烯
C
粗盐提纯时,将2mol·L-1NaOH、饱和BaCl2和0.5mol·L-1Na2CO3溶液依次加入后,一次过滤,滤液用HCl调至pH<3,取少许该溶液滴加饱和BaCl2溶液,发现有明显的白色沉淀生成
说明“一次过滤”后没有完全除尽 ,该白色沉淀是BaSO4
D
向苯酚钠溶液中通入CO2 , 溶液变浑浊
碳酸溶液的pH比苯酚小
A、A B、B C、C D、D8. 下列实验方案中,能实现实验目的的是( )实验目的
实验方案
A
检验露置的Na2SO3是否变质
用盐酸酸化的BaCl2溶液
B
缩短容量瓶干燥的时间
将洗净的容量瓶放在烘箱中烘干
C
测定Na2CO3(含NaCl)样品纯度
取一定质量的样品与足量盐酸反应,用碱石灰吸收产生的气体
D
验证氧化性强弱:Ag+>Fe2+
向FeCl2和KSCN的混合溶液中滴入酸化的AgNO3溶液
A、A B、B C、C D、D9. 下列实验操作、现象及得出的结论均正确的是( )选项
实验操作
实验现象
实验结论
A
向某溶液中先加入氯化钡溶液,再滴入盐酸
先产生白色沉淀,后白色沉淀不消失
该溶液中一定含有SO
B
将充满NO2的密闭玻璃球浸泡在热水中
红棕色变深
反应2NO2(g) N2O4(g) △H<0
C
在0.1mol·L-1K2S溶液中滴加少量等浓度的ZnSO4溶液,再加入少量等浓度的CuSO4溶液
先产生白色沉淀,后产生黑色沉淀
Ksp(ZnS)>Ksp(CuS)
D
室温下,用pH试纸分别测定浓度均为0.1mol·L-1的Na2SO3和NaHSO3两种溶液的pH
pH:Na2SO3>NaHSO3
HSO 结合H+能力比SO 的强
A、A B、B C、C D、D10. 室温下,进行下列实验,根据实验操作和现象所得的结论正确的是( )选项
实验操作和现象
结论
A
向NaOH固体中加入少量稀盐酸,测得溶液温度高于室温
盐酸与氢氧化钠的反应为放热反应
B
向Na2SO3溶液中,加入BaCl2溶液,产生白色沉淀,过滤洗涤后,向所得沉淀中加入足量稀硝酸,沉淀不溶解
原Na2SO3溶液已变质
C
向pH=3的醋酸溶液中,加入醋酸铵溶液,溶液pH增大
醋酸铵溶液呈碱性
D
向含有少量CuCl2的MgCl2溶液中,滴加几滴氨水,产生蓝色沉淀
Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
A、A B、B C、C D、D11. 下列实验操作、现象与结论对应关系正确的是( )选项
实验操作
实验现象
结论
A
向盛有稀 溶液的试管中加入 的 溶液
试管口出现红棕色气体
溶液中的 被 还原为
B
向某钠盐X溶液中加入盐酸,将产生的气体通入 酸化的 溶液中
有白色沉淀产生
反应生成的气体可能为
C
向滴加酚酞的氨水中加蒸馏水稀释
溶液红色变浅
溶液中所有离子的浓度均减小
D
用铂丝蘸取某溶液在酒精灯火焰上灼烧
直接观察,火焰呈黄色
溶液中的金属阳离子只有
A、A B、B C、C D、D12. 向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中 变化的曲线如图所示。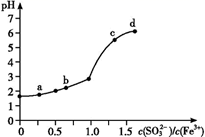
实验发现:
ⅰ.a 点溶液澄清透明,向其中滴加 NaOH 溶液后,立即产生灰白色沉淀,滴入 KSCN 溶液显红色;
ⅱ.c 点和 d 点溶液中产生红褐色沉淀,无气体逸出;取其上层清液滴加NaOH溶液后无明显现象,滴加 KSCN 溶液显红色。
下列分析合理的是( )
A、检验a点溶液中反应生成的阴离子所需试剂为:稀硝酸和BaCl2溶液 B、c点和d点出现上述现象的主要原因是Fe3+和 发生双水解反应 C、b点较a点溶液pH升高的主要原因:2Fe3++ +H2O = 2Fe2++ +2H+ D、向d点上层清液中滴加 NaOH溶液无明显现象,证明溶液中无Fe3+13. 某溶液含有Ba2+、Fe2+、Cl-、NO3-等离子,向其中加入足量的稀硫酸后,溶液中离子的物质的量几乎不变的是( )A、Ba2+ B、Fe2+ C、Cl- D、NO3-14. 对溶液中下列离子进行检验,正确的操作是( )A、NH4+:取样,加入氢氧化钠溶液,即产生使湿润红色石蕊试纸变蓝的气体 B、SO42-:取样,加入足量的盐酸无现象,再滴入氯化钡溶液有白色沉淀产生 C、Fe2+:取样,滴入硫氰化钾溶液无现象,再加入过量的氯水,溶液呈血红色 D、Cl-:取样,滴入硝酸银溶液产生白色沉淀,再加入过量的硫酸沉淀不消失15. 下列实验方案中,能达到实验目的的是( ) A、A B、B C、C D、D16. 下列有关实验的操作正确的是( )A、容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 B、检验某溶液是否含有SO 时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 C、为观察Mg条在CO2气体中的燃烧,在一个底部铺有少量玻璃棉的集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部 D、用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH值17. 将下列气体通入溶有足量的SO2的BaCl2溶液中,没有沉淀产生的是( )A、NH3 B、H2S C、Cl2 D、HCl18. 向的溶液中加入一定量的溶液,下列分析错误的是A、若未完全沉淀,则溶液中有大量 B、若恰好完全沉淀,则溶液中有大量 C、若沉淀达到最大值,则溶液呈酸性 D、无论加入多少溶液,一定存在19. 下列“实验结论”与“实验操作及现象”相符的一组是
A、A B、B C、C D、D16. 下列有关实验的操作正确的是( )A、容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 B、检验某溶液是否含有SO 时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 C、为观察Mg条在CO2气体中的燃烧,在一个底部铺有少量玻璃棉的集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部 D、用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH值17. 将下列气体通入溶有足量的SO2的BaCl2溶液中,没有沉淀产生的是( )A、NH3 B、H2S C、Cl2 D、HCl18. 向的溶液中加入一定量的溶液,下列分析错误的是A、若未完全沉淀,则溶液中有大量 B、若恰好完全沉淀,则溶液中有大量 C、若沉淀达到最大值,则溶液呈酸性 D、无论加入多少溶液,一定存在19. 下列“实验结论”与“实验操作及现象”相符的一组是选项
实验操作及现象
实验结论
A
将通入酸性溶液,溶液紫色很快褪去
具有漂白性
B
向某溶液中加入溶液,生成的白色沉淀迅速变为灰绿色,最终变为红褐色
溶液一定含有
C
向某溶液中滴加溶液,产生白色沉淀
溶液中一定含有
D
将某气体通入澄清石灰水,澄清石灰水变浑浊
该气体一定是
A、A B、B C、C D、D20. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
实验结论
A
向某溶液中加入溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体
该溶液中一定含有
B
向某白色粉末中滴加稀盐酸,产生能使澄清石灰水变浑浊的气体
该粉末一定是碳酸盐
C
向某无色溶液滴加盐酸酸化的溶液,产生白色沉淀
该溶液中一定含
D
用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色
该溶液中一定不含
A、A B、B C、C D、D二、多选题
-
21. 下列关于离子检验的说法正确的是( )A、取少量溶液加入溶液产生白色沉淀,则证明该溶液中一定含 B、取少量溶液加入足量稀盐酸,产生能使澄清石灰水变浑浊的气体,则证明该溶液中一定含有或 C、先加入足量稀盐酸无明显现象,再加入溶液,产生白色沉淀,证明该溶液中含有 D、用洁净的铂丝蘸取少许溶液,于酒精灯上灼烧,火焰的颜色为黄色,证明该溶液一定含
三、非选择题
-
22. 胆矾( )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:(1)、制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有(填标号)。
A.烧杯 B.容量瓶 C.蒸发皿 D.移液管
(2)、将 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为 , 与直接用废铜和浓硫酸反应相比,该方法的优点是。(3)、待 完全反应后停止加热,边搅拌边加入适量 ,冷却后用 调 为3.5~4,再煮沸 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、、乙醇洗涤、 , 得到胆矾。其中,控制溶液 为3.5~4的目的是 , 煮沸 的作用是。(4)、结晶水测定:称量干燥坩埚的质量为 ,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 。根据实验数据,胆矾分子中结晶水的个数为(写表达式)。(5)、下列操作中,会导致结晶水数目测定值偏高的是(填标号)。①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少胆矾迸溅出来
23. 化学小组实验探究 与 溶液的反应。(1)、实验一:用如下装置(夹持、加热仪器略)制备 ,将足量 通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。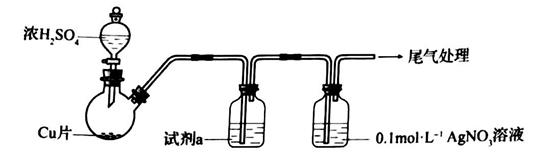
①浓 与Cu反应的化学方程式是
②试剂a是。
(2)、对体系中有关物质性质分析得出:沉淀B可能为 、 或二者混合物。(资料: 微溶于水; 难溶于水)
实验二:验证B的成分

①写出 溶于氨水的离子方程式:。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是 ,进而推断B中含有 。向滤液E中加入一种试剂,可进一步证实B中含有 。所用试剂及现象是。
(3)、根据沉淀F的存在,推测 的产生有两个途径:途径1:实验一中, 在 溶液中被氧化生成 ,随沉淀B进入D。
途径2:实验二中, 被氧化为 进入D。
实验三:探究 的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有;取上层清液继续滴加 溶液,未出现白色沉淀,可判断B中不含 。做出判断的理由:。
②实验三的结论:。
(4)、实验一中 与 溶液反应的离子方程式是。(5)、根据物质性质分析, 与 溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和SO42-生成。根据上述实验所得结论:。
24. 化合物X由三种元素组成,某学习小组按如下流程进行实验:
其中,溶液C含有一种摩尔质量为的含氧弱酸,其物质的量为。
(1)、X的组成元素是 , X的化学式是。(2)、写出溶液A与足量稀硫酸反应的化学方程式。(3)、写出生成紫黑色固体D的离子方程式。(4)、请设计实验检验溶液C中的一种阴离子。25. 实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收Cu并制备纳米ZnO的部分实验过程如图所示: (1)、在“溶解”步骤中,提高铜帽溶解速率的措施(例举两种)。(2)、有同学提出溶解步骤中可在酸性条件下不断鼓入并加热,这种情况下,铜发生溶解的离子方程式为。(3)、“过滤”步骤中使用的玻璃仪器有。(4)、生成的沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是。(5)、在封闭的高温电炉中焙烧,焙烧后的ZnO粉末用去离子水洗净,再用乙醇洗涤3次,减压过滤,干燥,得到纯净的纳米级ZnO。用乙醇洗涤的目的是。(6)、有同学提出用纯碱代替溶液,在实际生产中得到的是一种碱式碳酸锌[],取该样品6.82g,充分灼烧后测得残留物质量为4.86g,将所得气体通入足量澄清石灰水中,得到2.00g沉淀,则此碱式碳酸锌的化学式是。26. 某研究性学习小组查阅资料收集到如下信息:铁盐能蚀刻银而用来制作液晶显示器的银线路板。他们对蚀刻银的过程进行了探究。(1)、(实验1)制备银镜:
(1)、在“溶解”步骤中,提高铜帽溶解速率的措施(例举两种)。(2)、有同学提出溶解步骤中可在酸性条件下不断鼓入并加热,这种情况下,铜发生溶解的离子方程式为。(3)、“过滤”步骤中使用的玻璃仪器有。(4)、生成的沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是。(5)、在封闭的高温电炉中焙烧,焙烧后的ZnO粉末用去离子水洗净,再用乙醇洗涤3次,减压过滤,干燥,得到纯净的纳米级ZnO。用乙醇洗涤的目的是。(6)、有同学提出用纯碱代替溶液,在实际生产中得到的是一种碱式碳酸锌[],取该样品6.82g,充分灼烧后测得残留物质量为4.86g,将所得气体通入足量澄清石灰水中,得到2.00g沉淀,则此碱式碳酸锌的化学式是。26. 某研究性学习小组查阅资料收集到如下信息:铁盐能蚀刻银而用来制作液晶显示器的银线路板。他们对蚀刻银的过程进行了探究。(1)、(实验1)制备银镜:
i.配制银氨溶液,需要的试剂是。并取等量银氨溶液于多支试管中。
ii.向银氨溶液中加入等量的葡萄糖溶液,水浴加热。产生银镜,洗净,备用。(2)、(实验2)溶解银镜:分别向两支试管中加入5mLFe(NO3)3、Fe2(SO4)3溶液。
选用Fe2(SO4)3溶液的浓度为0.05mol/L,目的是保证相等。编号 a b 试剂 0.1mol/LFe(NO3)3 0.05mol/LFe2(SO4)3 现象 银镜消失较快; 溶液黄色略变浅; 产生少许白色沉淀 银镜消失较慢; 溶液黄色明显变浅; 产生较多白色沉淀 (3)、从a、b中均检出了Fe2+ , 说明Fe3+具有氧化性。a中Fe3+氧化Ag的离子方程式是。(4)、确认b中沉淀为Ag2SO4(微溶),检验Ag2SO4固体中 的方法是。(5)、推测在a中的酸性条件下 氧化了银,证据是。通过如下实验验证了推测是合理的:i.测pH:测定实验a中所用Fe(NO3)3溶液的pH=2;
ii.配制溶液:。取5mL此溶液加入有银镜的试管,现象是。
请将步骤ii补充完整。
(6)、分析a中白色沉淀的成分,提出假设。假设1:Fe(OH)2;假设2:AgNO2;假设3:…
①设计实验方案验证假设1:取少量沉淀置于空气中,未变色。假设1不成立。
②设计实验方案验证假设2(已知:亚硝酸盐能与酸化的KI溶液反应)。
实验方案
预期现象和结论
(实验结论与讨论)铁盐能蚀刻银; 能提高铁盐的蚀刻能力。推测硝酸铁溶液如果保持足够的酸性,可以避免产生沉淀。
27. 高纯砷(As)常用于制造砷化镓、砷化锗等半导体材料。工业上用含砷废料(主要成分为 ,含少量 )为原料制取高纯砷的工艺流程(硫化—还原法)如下图所示:
已知:砷酸(H3AsO4)在酸性条件下有强氧化性,能被 、氢碘酸等还原为亚砷酸(H3AsO3),H3AsO3在加热蒸发过程中会失水生成 。 时 的值为 。
回答下列问题:
(1)、半导体材料 中 元素的化合价为 , “氧化(加压)”时 发生反应的化学方程式为。(2)、用 溶液调溶液的 时, 的最小值为 (当溶液中某离子浓度为 时,可认为该离子沉淀完全)。(3)、“还原”过程发生反应的离子方程式为。(4)、过程中,检验 还原砷酸后所得溶液中是否仍存在砷酸。需进行的实验操作是:取 还原砷酸后的溶液于试管中,(请补充完整)。(5)、工业上用硫化-还原法制取砷的优点是。28. 镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下: (1)、镁在元素周期表中的位置是。反应①②③中属于氧化还原反应的有。(2)、为了使转化为;试剂①可以选用 , 确定海水中的已全部转化为的方法是。(3)、若要检验溶液A中含有的 , 使用的试剂是。(4)、无水在熔融状态下,通电后会产生Mg和 , 该反应的化学方程式为。(5)、海水中本来就有氯化镁,从海水中制取时,却要经历“”的转化。该转化过程的目的是。29. 以黄铁矿(主要成分)为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如图所示。
(1)、镁在元素周期表中的位置是。反应①②③中属于氧化还原反应的有。(2)、为了使转化为;试剂①可以选用 , 确定海水中的已全部转化为的方法是。(3)、若要检验溶液A中含有的 , 使用的试剂是。(4)、无水在熔融状态下,通电后会产生Mg和 , 该反应的化学方程式为。(5)、海水中本来就有氯化镁,从海水中制取时,却要经历“”的转化。该转化过程的目的是。29. 以黄铁矿(主要成分)为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如图所示。 (1)、煅烧时黄铁矿要粉碎,其目的是。(2)、煅烧时主要发生的反应为 , 中铁元素的化合价为。(3)、“氧化”时,反应的化学方程式为。(4)、工业上,吸收时宜选用的试剂X为(填“水”或“浓硫酸”)。(5)、因为在保存过程中易被氧化,导致商品中存在。欲检验已变质的实验方法为。(6)、可用于葡萄酒的抗氧化剂。用碘标准液可测定葡萄酒中的残留量,请配平该反应的方程式:。(7)、环保部门为了测定某硫酸厂周围空气中的含量进行了如下实验。取标准状况下空气(含、、、),缓慢通过足量碘水。在所得溶液中加入稍过量的溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为。则空气样品中的体积分数为。30. “以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的SO2 , 得到亚硫酸钠(Na2SO3)粗品。其流程如下:
(1)、煅烧时黄铁矿要粉碎,其目的是。(2)、煅烧时主要发生的反应为 , 中铁元素的化合价为。(3)、“氧化”时,反应的化学方程式为。(4)、工业上,吸收时宜选用的试剂X为(填“水”或“浓硫酸”)。(5)、因为在保存过程中易被氧化,导致商品中存在。欲检验已变质的实验方法为。(6)、可用于葡萄酒的抗氧化剂。用碘标准液可测定葡萄酒中的残留量,请配平该反应的方程式:。(7)、环保部门为了测定某硫酸厂周围空气中的含量进行了如下实验。取标准状况下空气(含、、、),缓慢通过足量碘水。在所得溶液中加入稍过量的溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为。则空气样品中的体积分数为。30. “以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的SO2 , 得到亚硫酸钠(Na2SO3)粗品。其流程如下: (1)、为加快工业废碱渣中Na2CO3的溶解,可采取的措施是(写出一种即可)。(2)、过程①进行的操作是。(3)、上述流程中,加入NaOH后,发生反应的化学方程式为。(4)、亚硫酸钠粗品中含有少量Na2SO4 , 原因是。(5)、设计实验证明亚硫酸钠粗品含有少量Na2SO4的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解, , 出现白色沉淀,则证明含有Na2SO4。
(1)、为加快工业废碱渣中Na2CO3的溶解,可采取的措施是(写出一种即可)。(2)、过程①进行的操作是。(3)、上述流程中,加入NaOH后,发生反应的化学方程式为。(4)、亚硫酸钠粗品中含有少量Na2SO4 , 原因是。(5)、设计实验证明亚硫酸钠粗品含有少量Na2SO4的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解, , 出现白色沉淀,则证明含有Na2SO4。
-