高考二轮复习知识点:二氧化硫的漂白作用
试卷更新日期:2023-07-28 类型:二轮复习
一、选择题
-
1. 下列有关物质的性质与用途具有对应关系的是( )A、NH4HCO3受热易分解,可用作化肥 B、稀硫酸具有酸性,可用于除去铁锈 C、SO2具有氧化性,可用于纸浆漂白 D、Al2O3具有两性,可用于电解冶炼铝2. 化学与生活密切相关,下列说法正确的是A、苯甲酸钠可作为食品防腐剂是由于其具有酸性 B、豆浆能产生丁达尔效应是由于胶体粒子对光线的散射 C、SO2可用于丝织品漂白是由于其能氧化丝织品中有色成分 D、维生素C可用作水果罐头的抗氧化剂是由于其难以被氧化3. 物质的性质决定用途,下列两者对应关系错误的是A、能使某些色素褪色,可用作漂白剂 B、金属钠导热性好,可用作传热介质 C、溶液呈碱性,可用作消毒剂 D、呈红色,可用作颜料4. 若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是( )
 A、 与浓硫酸反应,只体现 的酸性 B、a处变红,说明 是酸性氧化物 C、b或c处褪色,均说明 具有漂白性 D、试管底部出现白色固体,说明反应中无 生成5. 碳酸盐约占海水盐分的0.34%,一种海水脱硫的新工艺如图所示。下列说法错误的是
A、 与浓硫酸反应,只体现 的酸性 B、a处变红,说明 是酸性氧化物 C、b或c处褪色,均说明 具有漂白性 D、试管底部出现白色固体,说明反应中无 生成5. 碳酸盐约占海水盐分的0.34%,一种海水脱硫的新工艺如图所示。下列说法错误的是 A、排入大气易引起酸雨 B、海水吸收二氧化硫时可能有逸出 C、处理后的海水增大 D、海水脱硫工艺简单,投资及运行费用低6. 下列物质应用和对应性质匹配的是( )
A、排入大气易引起酸雨 B、海水吸收二氧化硫时可能有逸出 C、处理后的海水增大 D、海水脱硫工艺简单,投资及运行费用低6. 下列物质应用和对应性质匹配的是( )选项
应用
性质
A
大型舰船的底部常镶嵌锌块,防止船底腐蚀
锌比铁活泼性强
B
用焦炭和二氧化硅在电炉中制备粗硅
非金属性:C>Si
C
可用于漂白织物等
具有氧化性
D
聚合硫酸铁用作净水剂
聚合硫酸铁易溶于水
A、A B、B C、C D、D7. 下列叙述错误的是( )A、纯碱可用于去除餐具的油污 B、碘酒可用于皮肤外用消毒 C、干冰可用作致冷剂 D、利用二氧化硫的还原性造纸时可漂白纸浆8. 向下列溶液中通入SO2气体,溶液不会褪色的是( )A、品红 B、溴水 C、红色石蕊溶液 D、酸性高锰酸钾9. 下列实验过程中药品颜色变浅的是( )A、光照CH4和Cl2的混合气体 B、加热经SO2漂白的品红溶液 C、加热含酚酞的CH3COONa溶液 D、加热密闭烧瓶内NO2、N2O4的混合气体10. 化合物M(NH4CuSO3)为难溶于水的白色固体,取少量M进行如下实验,下列推断正确的是( ) A、化合物M中Cu的化合价为+2价 B、红色固体(A)为氧化铜 C、G为含极性共价键的极性分子 D、加热H无明显现象11. 检验碳粉与浓硫酸反应产生气体的装置和所加药品如下,下列叙述错误的是( )
A、化合物M中Cu的化合价为+2价 B、红色固体(A)为氧化铜 C、G为含极性共价键的极性分子 D、加热H无明显现象11. 检验碳粉与浓硫酸反应产生气体的装置和所加药品如下,下列叙述错误的是( ) A、a中品红溶液褪色,说明混合气体中有SO2 B、b中KMnO4溶液的作用是除去SO2 C、b中发生反应的离子方程式为: D、c中品红溶液不褪色,d中Ca(OH)2溶液变浑浊,说明混合物中存在CO212. 化学在生产、生活中有着广泛的应用,下列对应关系不正确的是( )
A、a中品红溶液褪色,说明混合气体中有SO2 B、b中KMnO4溶液的作用是除去SO2 C、b中发生反应的离子方程式为: D、c中品红溶液不褪色,d中Ca(OH)2溶液变浑浊,说明混合物中存在CO212. 化学在生产、生活中有着广泛的应用,下列对应关系不正确的是( )选项
化学性质
实际应用
A
乙烯能与KMnO4溶液反应
用浸泡过KMnO4溶液的硅土保存水果
B
SO2具有还原性
用SO2漂白纸浆和草帽
C
FeCl3具有氧化性
用FeCl3溶液刻蚀铜制印刷电路板
D
长链烷烃裂解可得短链烷烃和烯烃
用重油裂解制备有机化工原料
A、A B、B C、C D、D13. 下列说法正确的是( )A、因为具有漂白性,所以它能使酸性高锰酸钾溶液褪色 B、气体通入溶液能产生白色沉淀 C、热稳定性: D、硫和氯气分别与铁反应后,铁元素的价态相同14. “物质的性质决定其用途”。下列有关物质的性质与用途不对应的是( )A、受热易分解,可用作化肥 B、稀硫酸具有酸性,可用于除去铁锈 C、具有漂白性,可用于纸浆漂白 D、明矾溶于水形成胶体,可用于自来水厂净水15. 下列说法错误的是( )A、 均可通过化合反应生成 B、用惰性电极分别电解 溶液,均为电解水 C、将 气体分别通入紫色石蕊试液中,均出现溶液先变红后褪色 D、将铁片和铝片置于冷的浓硝酸中均发生钝化16. 下列实验操作、现象与结论都正确的是( )选项
操作
现象
结论
A
往FeCl3溶液中加入少量铜粉
铜粉溶解
氧化性:Cu2+>Fe3+
B
向AgCl浊液中加入少量0.1mol/LKI溶液
白色沉淀颜色变黄
Ksp(AgCl)>Ksp(AgI)
C
向某溶液中滴加几滴新制氯水,再滴加少量KSCN溶液
溶液变红色
某溶液中含有Fe2+
D
将稀H2SO4滴加到饱和Na2SO3溶液中,将产生的气体通入KMnO4溶液
紫色溶液褪去
产生的气体具有漂白性
A、A B、B C、C D、D17. 将SO2通入不同溶液中探究SO2的性质,对实验现象的预测及分析不合理的是( )选项
溶液
预测的现象
分析
A
FeCl3溶液
溶液由棕黄色变浅绿色
SO2有还原性
B
品红溶液
溶液红色褪去
SO2有漂白性
C
酸性KMnO4溶液
溶液紫色褪去
SO2有氧化性
D
Na2SiO3溶液
产生白色胶状沉淀
SO2水溶液的酸性比H2SiO3强
A、A B、B C、C D、D18. 化学小组用如图装置探究铜与浓硫酸的反应,过程中观察到,试管内壁有淡黄色固体,液面上方铜丝变黑,溶液中有白色(灰白色)固体生成。将铜丝抽至脱离溶液,继续加热,保持沸腾状态,淡黄色固体消失。将变黑的铜丝置于稀硫酸中,黑色物质不溶解。下列说法错误的是( ) A、实验过程中观察到石蕊溶液变红后不褪色 B、试管中白色(灰白色)固体为无水硫酸铜 C、铜丝上的黑色物质为氧化铜 D、淡黄色固体消失的原因是硫酸蒸气将固体硫氧化19. ClO2是国际上公认的安全绿色消毒剂。工业上利用甲醇还原NaClO3的方法制备ClO2的反应原理为:NaClO3+H2SO4+CH3OH→ClO2↑+HCOOH+Na3H(SO4)2↓+H2O(未配平),下列说法错误的是( )A、HCOOH为该反应的氧化产物 B、生成2.24L ClO2时,电子转移数是0.1NA C、反应中氧化剂和还原剂物质的量之比为4:1 D、ClO2和SO2均能漂白纸张,但漂白原理不同20. 下列叙述不涉及氧化还原反应的是( )A、食物腐败变质 B、对电力不足的新能源汽车充电 C、用SO2漂白纸浆 D、苯酚放置在空气中变为粉红色21. 化学与生产生活密切相关,下列叙述错误的是( )A、84消毒液具有腐蚀性,不能用于金属制品的消毒 B、浸泡高锰酸钾溶液的硅藻土保鲜水果涉及到氧化还原反应 C、聚乙烯塑料老化是因为发生加成反应 D、SO2漂白过的草编制品颜色不会保持太久22. 二氧化硫是我国工业大气主要污染物之一,但在严格遵守国家有关标准时,在食品生产中也经常使用,某学习小组设计了如图装置用于制取SO2并验证其性质。下列有关说法中正确的是( )
A、实验过程中观察到石蕊溶液变红后不褪色 B、试管中白色(灰白色)固体为无水硫酸铜 C、铜丝上的黑色物质为氧化铜 D、淡黄色固体消失的原因是硫酸蒸气将固体硫氧化19. ClO2是国际上公认的安全绿色消毒剂。工业上利用甲醇还原NaClO3的方法制备ClO2的反应原理为:NaClO3+H2SO4+CH3OH→ClO2↑+HCOOH+Na3H(SO4)2↓+H2O(未配平),下列说法错误的是( )A、HCOOH为该反应的氧化产物 B、生成2.24L ClO2时,电子转移数是0.1NA C、反应中氧化剂和还原剂物质的量之比为4:1 D、ClO2和SO2均能漂白纸张,但漂白原理不同20. 下列叙述不涉及氧化还原反应的是( )A、食物腐败变质 B、对电力不足的新能源汽车充电 C、用SO2漂白纸浆 D、苯酚放置在空气中变为粉红色21. 化学与生产生活密切相关,下列叙述错误的是( )A、84消毒液具有腐蚀性,不能用于金属制品的消毒 B、浸泡高锰酸钾溶液的硅藻土保鲜水果涉及到氧化还原反应 C、聚乙烯塑料老化是因为发生加成反应 D、SO2漂白过的草编制品颜色不会保持太久22. 二氧化硫是我国工业大气主要污染物之一,但在严格遵守国家有关标准时,在食品生产中也经常使用,某学习小组设计了如图装置用于制取SO2并验证其性质。下列有关说法中正确的是( )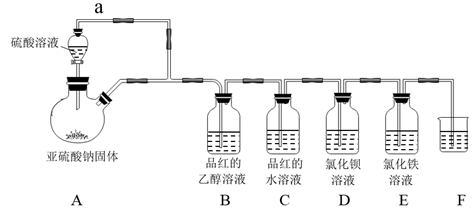 A、装置中连接管a完全多余,可以去掉 B、B装置中未见品红褪色是因为该装置不能制得SO2 C、D装置中不会出现大量白色沉淀 D、E装置中SO2过量时的离子反应方程式为:2Fe3++SO2+8OH-=2Fe(OH)2↓+SO +2H2O23. 下列实验装置、现象及结论合理的是( )
A、装置中连接管a完全多余,可以去掉 B、B装置中未见品红褪色是因为该装置不能制得SO2 C、D装置中不会出现大量白色沉淀 D、E装置中SO2过量时的离子反应方程式为:2Fe3++SO2+8OH-=2Fe(OH)2↓+SO +2H2O23. 下列实验装置、现象及结论合理的是( )序号
试剂及操作
部分现象
结论
A

滴入稀盐酸后铜片继续溶解,产生无色气体,在试管口处变为淡棕色
盐酸具有氧化性
B

有气体生成
酸性:
硼酸强于碳酸
C

加热后产生有香味物质
H2C2O4可发生酯化反应
D

试管内红色褪去
SO2具有漂白性
A、A B、B C、C D、D24. 化学与生产,生活、环境等息息相关,下列说法中错误的是( )A、“用浓酒和糟入甑,蒸令气上,用器承取滴露。”文中涉及的操作方法是蒸馏 B、用活性炭为糖浆脱色和用SO2漂白纸浆的原理不相同 C、港珠澳大桥采用的超高分子量聚乙烯纤维吊绳,是有机高分子化合物 D、“玉不琢不成器”、“百炼方能成钢”发生的均为物理变化25. 利用下列装置制取 或验证其性质,不能达到实验目的的是( )



A.制取
B.验证氧化性
C.验证还原性
D.验证漂白性
A、A B、B C、C D、D26. 按如图所示装置进行实验,逐滴加入液体x后,下列实验目的能够实现的是( )
选项
x
y
z
实验目的
A
浓氨水
生石灰
溶液
验证 能溶于碱
B
稀醋酸
小苏打
澄清石灰水
验证醋酸的酸性强于碳酸
C
水
过氧化钠
溶液
验证 具有还原性
D
70%硫酸
亚硫酸钠
紫色石蕊试液
验证二氧化硫的漂白性
A、A B、B C、C D、D27. 向溴水中加入或通入足量下列物质,最终不能得到无色溶液的是( )A、二氧化硫 B、氢氧化钠溶液 C、碘化钾溶液 D、热空气28. 下列实验操作或相关说法合理的是( )A
B
C
D



混合浓硫酸和乙醇
验证SO2的漂白性
蒸干MgCl2溶液制取无水MgCl2
充分振荡后下层为无色
A、A B、B C、C D、D二、非选择题
-
29. 某兴趣小组对化合物X开展探究实验。

其中:X是易溶于水的强酸盐,由3种元素组成;A和B均为纯净物;B可使品红水溶液褪色。请回答:
(1)、组成X的3种元素是(填元素符号),X的化学式是。(2)、将固体X加入温热的稀H2SO4中,产生气体B,该反应的离子方程式是。(3)、步骤I,发生反应的化学方程式是。(4)、步骤II,某同学未加H2O2溶液,发现也会缓慢出现白色浑浊,原因是。(5)、关于气体B使品红水溶液褪色的原因,一般认为:B不能使品红褪色,而是B与水反应的生成物使品红褪色。请设计实验证明。30. 某学习小组设计了如图装置用于制取SO2并验证其性质。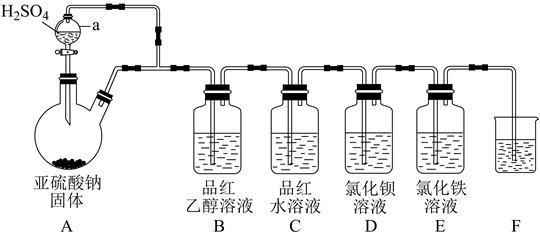 (1)、仪器a的名称为 , 实验时装置E中溶液的现象为。(2)、若装置B中溶液无明显现象,装置C中溶液红色褪去,则使品红的水溶液褪色的含硫微粒一定不是(填化学式)。(3)、该实验小组的甲、乙两位同学为了进一步探究SO2的漂白性,按如图装置继续进行实验并记录相关实验现象。
(1)、仪器a的名称为 , 实验时装置E中溶液的现象为。(2)、若装置B中溶液无明显现象,装置C中溶液红色褪去,则使品红的水溶液褪色的含硫微粒一定不是(填化学式)。(3)、该实验小组的甲、乙两位同学为了进一步探究SO2的漂白性,按如图装置继续进行实验并记录相关实验现象。
①装置中浓硫酸的作用为。
②根据表中实验现象做出合理解释。
组别
实验现象
合理解释
甲
品红溶液几乎不褪色
反应方程式为
乙
品红溶液随时间的推移变得越来越浅
原因可能是
(4)、该实验小组的学生丙预测装置D中没有白色沉淀产生,但随着反应的进行,发现装置D中产生了少量白色沉淀。为进一步探究产生沉淀的原因,分别用煮沸和未煮沸过的蒸馏水配制的Ba(NO3)2和BaCl2溶液,进行如图实验: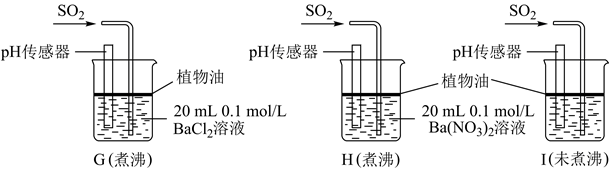 实验中G、H、I烧杯中观察到的现象如表:
实验中G、H、I烧杯中观察到的现象如表:烧杯
实验现象
G
无白色沉淀产生,pH传感器测的溶液pH=5.3
H
有白色沉淀产生
I
有白色沉淀产生,I中出现白色沉淀比H中快很多
①据G中现象推测D中产生的白色沉淀的化学式是。
②写出H中白色沉淀产生的离子方程式。
③据I中出现白色沉淀的速率比H中快很多的现象,推测其根本原因可能是。
(5)、该实验小组的学生丁用200mL0.1mol•L-1酸性KMnO4溶液测定空气中SO2含量,若气体流速为acm3•min-1 , 当tmin时酸性KMnO4溶液恰好褪色,则空气中SO2的含量为(g•cm-3)。