高考二轮复习知识点:过氧化氢
试卷更新日期:2023-07-28 类型:二轮复习
一、选择题
-
1. 下列说法正确的是( )A、 在空气中加热可得固体 B、 加入到过量 溶液中可得 C、 在沸腾炉中与 反应主要生成 D、 溶液中加入少量 粉末生成 和2. 双氧水是一种常见的氧化剂,下列对H2O2叙述正确的是( )A、H2O2的摩尔质量为34 B、H2O2中只有极性共价键 C、也具有还原性 D、H2O2的电子式为
 3. 用氢气制备双氧水的一种工艺简单、能耗低的方法,其反应原理如图所示,已知钯(Pd)常以正二价形式存在。下列有关说法正确的是
3. 用氢气制备双氧水的一种工艺简单、能耗低的方法,其反应原理如图所示,已知钯(Pd)常以正二价形式存在。下列有关说法正确的是 A、H2O2的电子式为
A、H2O2的电子式为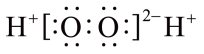 B、反应①②③均为氧化还原反应
C、反应②中有1molO2参与反应时转移电子的物质的量为2mol
D、反应过程中[PbCl2O2]2−、HCl均为该反应的催化剂
4. 双氧水()与下列溶液反应,不能体现氧化性的是( )A、酸性溶液 B、淀粉KI溶液 C、溶有的溶液 D、盐酸酸化的溶液5. H2O2被称为“最清洁的消毒剂”,国家卫生健康委办公厅印发了《消毒剂使用指南》,其中明确指定过氧化氢为新冠病毒消毒剂之一,适用于物体表面、室内空气的消毒等。一种用H制备H2O2的一种工艺简单、能耗低的方法,反应原理如图所示,下列说法正确的是( )
B、反应①②③均为氧化还原反应
C、反应②中有1molO2参与反应时转移电子的物质的量为2mol
D、反应过程中[PbCl2O2]2−、HCl均为该反应的催化剂
4. 双氧水()与下列溶液反应,不能体现氧化性的是( )A、酸性溶液 B、淀粉KI溶液 C、溶有的溶液 D、盐酸酸化的溶液5. H2O2被称为“最清洁的消毒剂”,国家卫生健康委办公厅印发了《消毒剂使用指南》,其中明确指定过氧化氢为新冠病毒消毒剂之一,适用于物体表面、室内空气的消毒等。一种用H制备H2O2的一种工艺简单、能耗低的方法,反应原理如图所示,下列说法正确的是( ) A、H2O2是一种绿色消毒剂,在消毒过程中消耗34gH2O2时反应转移1mol电子 B、该制备反应的总反应方程 C、该过程中1mol微粒含电子数为18NA的粒子有3种 D、反应过程中每一步反应Pd元素的化合价均发生了变化6. 下列“类比”推测不合理的是( )A、Na2S2与盐酸反应生成NaCl、S和H2S,则S2Cl2在盐酸中转化为HCl、S和H2S B、Na2O2具有较强的氧化性,则Na2S2也具有氧化性,但比Na2O2弱 C、H2O2易分解为H2O和O2 , 则H2S2也易分解为H2S和S D、H2O2的分子构型不是直线形,则S2Cl2也不是直线形7. 宏观辨识与微观探析是化学学科核心素养之一、下列物质性质实验对应的离子方程式书写错误的是( )A、硅酸钠溶液和盐酸反应: B、硫酸铜溶液中加少量的铁粉: C、酸性碘化钾溶液中滴加适量双氧水: D、二氧化硫与酸性高锰酸钾溶液反应:8. 过碳酸钠(2Na2CO3·3H2O2)是一种白色晶体,具有无毒,无臭,无污染等优点,常做食品、医药、卫生等部门的去污剂、清洗剂、杀毒剂,也是一种性能优异的急救供氧剂。可用碳酸钠和双氧水化合制备: ,下列说法错误的是( )A、过碳酸钠具有强氧化性 B、1mol过碳酸钠发生热分解,转移的电子数为3NA C、生产过种中若遇到酸、铁盐等都可能导致产率下降 D、将过碳酸钠溶液与亚硫酸氢钠溶液混合,发生的反应为2Na2CO3·3H2O2+3NaHSO3=2Na2CO3+3NaHSO4+3H2O9. 下列实验方案设计、现象与结论都正确的是( )
A、H2O2是一种绿色消毒剂,在消毒过程中消耗34gH2O2时反应转移1mol电子 B、该制备反应的总反应方程 C、该过程中1mol微粒含电子数为18NA的粒子有3种 D、反应过程中每一步反应Pd元素的化合价均发生了变化6. 下列“类比”推测不合理的是( )A、Na2S2与盐酸反应生成NaCl、S和H2S,则S2Cl2在盐酸中转化为HCl、S和H2S B、Na2O2具有较强的氧化性,则Na2S2也具有氧化性,但比Na2O2弱 C、H2O2易分解为H2O和O2 , 则H2S2也易分解为H2S和S D、H2O2的分子构型不是直线形,则S2Cl2也不是直线形7. 宏观辨识与微观探析是化学学科核心素养之一、下列物质性质实验对应的离子方程式书写错误的是( )A、硅酸钠溶液和盐酸反应: B、硫酸铜溶液中加少量的铁粉: C、酸性碘化钾溶液中滴加适量双氧水: D、二氧化硫与酸性高锰酸钾溶液反应:8. 过碳酸钠(2Na2CO3·3H2O2)是一种白色晶体,具有无毒,无臭,无污染等优点,常做食品、医药、卫生等部门的去污剂、清洗剂、杀毒剂,也是一种性能优异的急救供氧剂。可用碳酸钠和双氧水化合制备: ,下列说法错误的是( )A、过碳酸钠具有强氧化性 B、1mol过碳酸钠发生热分解,转移的电子数为3NA C、生产过种中若遇到酸、铁盐等都可能导致产率下降 D、将过碳酸钠溶液与亚硫酸氢钠溶液混合,发生的反应为2Na2CO3·3H2O2+3NaHSO3=2Na2CO3+3NaHSO4+3H2O9. 下列实验方案设计、现象与结论都正确的是( )实验目的
方案设计
现象和结论
A
探究Fe2+、Cu2+对H2O2溶液分解的催化效果强弱
在两支试管a、b中各加2 mL5%H2O2溶液,分别滴入0.1 mol•L-1FeCl3溶液和0.1 mol•L-1CuSO4溶液各0.5 mL
若a中产生气泡快于b中,则说明Fe3+的催化效果强于Cu2+
B
探究Fe与水蒸气高温反应后固体产物中铁元素的化合价
取少量固体产物于试管中,加足量的稀硫酸溶解,分成两份:一份滴加几滴KSCN溶液,另一份少量滴加KMnO4溶液
若前者溶液变血红色,后者溶液紫色褪去,则固体产物中铁元素有+2、+3两种价态
C
探究油脂在碱性条件下的水解
在小烧杯中加入约5 g动物脂肪、6 mL95%的乙醇,再加入6 mL 40%的氢氧化钠溶液,微热一段时间后取少量清液,加入新制氢氧化铜
若出现绛蓝色,则油脂已发生水解
D
探究Cu与硫酸的
反应
铜粉加入稀硫酸中,加热,再加入少量KNO3固体
未加KNO3固体前,无明显现象;加入KNO3固体后,产生大量气泡,则说明KNO3起催化作用
A、A B、B C、C D、D10. 根据下列实验操作和现象所得的结论正确的是( )选项
实验操作和现象
结论
A
向H2O2溶液中滴加少量KMnO4溶液,紫红色褪去
H2O2具有氧化性
B
将二氧化硫气体通入品红溶液,品红溶液褪色
二氧化硫具有漂白性
C
向蔗糖中滴入浓硫酸,固体变黑膨胀
浓硫酸具有吸水性
D
AgCl悬浊液中滴入稀KI溶液,有黄色沉淀出现
KSPAgI > KSPAgCl
A、A B、B C、C D、D11. 化学与生产、生活密切相关,下列叙述错误的是( )A、石灰石可用作燃煤的脱硫剂 B、过氧化氢溶液可用作医用消毒剂 C、碳酸钡可用作胃肠X射线透视的造影剂 D、硫化钠可用作去除废水中Pb2+的沉淀剂12. 钒元素用途广泛,如图是一种钒的化合物催化某反应的反应机理。下列叙述错误的是( ) A、H2O参与了该催化反应 B、过程①中反应的原子利用率为100% C、该催化循环过程中有氢氧键的断裂和形成 D、每次循环的净反应为H2O2+2Cl-=2HOCl+2e-13. 根据下列实验操作和现象所得出的结论错误的是( )
A、H2O参与了该催化反应 B、过程①中反应的原子利用率为100% C、该催化循环过程中有氢氧键的断裂和形成 D、每次循环的净反应为H2O2+2Cl-=2HOCl+2e-13. 根据下列实验操作和现象所得出的结论错误的是( )选项
操作
现象
结论
A
向蔗糖中加入浓硫酸
蔗糖变成疏松多孔的海绵状炭,并放出有刺激性气味的气体
浓硫酸具有脱水性和强氧化性
B
向 KCl、KI 的混合液中逐滴滴加稀 AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
C
铝片先用砂纸打磨,再加入到浓硝酸中
无明显现象
浓硝酸具有强氧化性,常温下,铝表面被浓硝酸氧化为致密的氧化铝薄膜
D
向盛有 H2O2 溶液的试管中加入几滴酸化的硫酸亚铁溶液
溶液变成棕黄色,一段时间后溶液中出现气泡,随后有红褐色沉淀生成
Fe3+催化 H2O2 分解产生 O2
A、A B、B C、C D、D14. 根据下列实验操作和实验现象所得出的结论错误的是( )实验操作
实验现象
结论
A
向蔗糖中加入浓硫酸
蔗糖变成疏松多孔的海绵状炭,并放出有刺激性气味的气体
浓硫酸具有脱水性和强氧化性
B
向盛有H2O2溶液的试管中加入几滴酸化的硫酸亚铁溶液
溶液变成棕黄色,一段时间后溶液中出现气泡,随后有红褐色沉淀生成
Fe3+催化H2O2分解产生O2
C
铝片先用砂纸打磨,常温下再加入到浓硝酸中
无明显现象
常温下,铝不跟浓硝酸反应
D
向浓度均为0.01mol·L-1的KCl、KI的混合液中逐滴滴加稀AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
A、A B、B C、C D、D15. 2020年3月10日,习近平总书记赴湖北武汉考察新冠疫情工作,给奋战在抗疫一线的战士们、武汉乃至全国人民极大的鼓舞。下列说法错误的有( )①用于消毒的酒精、“84”消毒液、双氧水、过氧乙酸(CH3COOOH)等均属于有机物
②95%的酒精比75%的酒精杀菌效果好
③“84”消毒液露置在空气中不会变质
④双氧水能使酸性高锰酸钾溶液和溴水褪色,其褪色原理均为氧化还原反应
⑤修建“火神山”医院所用的HDPE(高密度聚乙烯)膜是一种无毒、无味的高分子材料
⑥医用外科口罩和防护服所用的熔喷布是一种聚丙烯材料,聚丙烯可以使溴水褪色
⑦科研人员积极研发抗击新型冠状病毒的疫苗,疫苗一般应冷藏存放,以避免蛋白质变性
⑧N95口罩用0.3µmNaCl颗粒进行测试,阻隔率达95%以上,戴N95口罩可有效阻隔PM2.5
⑨过氧乙酸和乙酸属于同系物
A、6项 B、5项 C、4项 D、3项16. 用如图所示装置进行实验一将①滴入②中,②中实验现象和反应类型不完全正确的是( )选项
①
②
②中实验现象和反应类型
实验装置
A
苯
溴水
溴水橙色褪去,液体分层。加成反应

B
浓盐酸
浓硫酸
产生大量白雾。物理变化
C
双氧水
MnO2
产生大量气泡。分解反应
D
浓硝酸
铜粉
产生红粽色气体。氧化还原反应
A、A B、B C、C D、D17. 化学与生产、生活密切相关。下列说法错误的是( )A、利用硅材料可制成光伏发电装置 B、SO2、漂白液、双氧水的漂白原理相同 C、使用无磷洗涤剂可减少水华的发生 D、催化净化汽车尾气可降低污染18. 下列说法不正确的是( )A、双氧水可用于皮肤伤口消毒 B、水玻璃是制备硅胶和木材防火剂等的原料 C、生石灰和铁粉都是食品包装中常用的干燥剂 D、生活中可用电解饱和食盐水的方法制取消毒液19. H2O的和H2O2的含有相同的元素,H2O2的分子空间结构如图所示,下列说法正确的是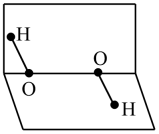 A、H2O2的是非极性分子 B、1molH2O2中含有2molσ键 C、H2O和H3O+的VSEPR模型不同 D、H2O分子之间存在氢键,因此H2O的沸点高于H2S的20. 探究H2O2溶液的性质,根据实验所得结论不正确的是( )
A、H2O2的是非极性分子 B、1molH2O2中含有2molσ键 C、H2O和H3O+的VSEPR模型不同 D、H2O分子之间存在氢键,因此H2O的沸点高于H2S的20. 探究H2O2溶液的性质,根据实验所得结论不正确的是( )实验
试剂a
现象
结论
A

溶有SO2的BaCl2溶液
产生沉淀
H2O2有氧化性
B
酸性KMnO4溶液
紫色溶液褪色
H2O2有氧化性
C
KI淀粉溶液
溶液变蓝
H2O2有氧化性
D
盐酸酸化的FeCl2溶液
溶液变黄
H2O2有氧化性
A、A B、B C、C D、D21. 金属铈(Ce是地壳中含量最高的稀土元素。关于铈的有关化合物及H2O2的转化关系如图所示,下列说法正确的是( )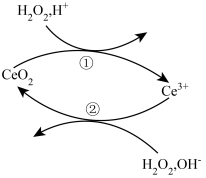 A、该反应历程的总反应为:H2O2=H2O+O2↑ B、过程①的离子方程式:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O C、过程②中,每有1molCe3+参加反应时转移的电子数为3.01×1023 D、还原性:CeO2>H2O222. 过氧乙酸(CH3COOOH)是“抗非典”的主要消毒剂,也能将新型冠状病毒杀死,可由乙酸和H2O2反应制得。下列说法错误的是( )A、过氧乙酸能杀灭病毒的主要原因是其具有强氧化性而使病毒变性 B、过氧乙酸不稳定,易分解,保存时应避光,低温保存 C、过氧乙酸属于有机物,故属于非电解质 D、制备过氧乙酸时不应在金属容器中进行且不可用于金属器械的消毒23. FeS2与酸反应时生成H2S2 , H2S2与H2O2相似,易分解。实验室用过量稀硫酸与FeS2颗粒混合,不可能生成的物质是( )A、H2S B、S C、FeS D、FeSO4
A、该反应历程的总反应为:H2O2=H2O+O2↑ B、过程①的离子方程式:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O C、过程②中,每有1molCe3+参加反应时转移的电子数为3.01×1023 D、还原性:CeO2>H2O222. 过氧乙酸(CH3COOOH)是“抗非典”的主要消毒剂,也能将新型冠状病毒杀死,可由乙酸和H2O2反应制得。下列说法错误的是( )A、过氧乙酸能杀灭病毒的主要原因是其具有强氧化性而使病毒变性 B、过氧乙酸不稳定,易分解,保存时应避光,低温保存 C、过氧乙酸属于有机物,故属于非电解质 D、制备过氧乙酸时不应在金属容器中进行且不可用于金属器械的消毒23. FeS2与酸反应时生成H2S2 , H2S2与H2O2相似,易分解。实验室用过量稀硫酸与FeS2颗粒混合,不可能生成的物质是( )A、H2S B、S C、FeS D、FeSO4二、非选择题
-
24. 过氧化氢是一种常用的绿色试剂,某学习小组针对性质进行如下实验。(1)、I.验证的还原性
查阅资料:溶液与氯水发生反应时表现还原性。
制取氯水

①仪器X的名称是 , 生成的化学方程式为 。
②饱和食盐水的作用是 。
(2)、取5mL上述新制饱和氯水于试管中,向其中加入溶液至过量,产生大量气泡该气体可使余烬复燃 , 还观察到溶液颜色发生的变化是 。(3)、Ⅱ.探究、对分解的影响选用溶液和溶液,探究、对分解的影响。记录数据如下:

实验序号
添加试剂及用量
完全分解所需时间
1
溶液
2
溶液
实验结果显示 , 可得出的结论是:填化学式更有利于分解。
(4)、甲同学查阅资料得知:能加速分解,对分解无影响。为排除干扰,该同学进行实验:向两份溶液中分别加入amL浓度均为 的 填化学式溶液和 填化学式溶液。内,发现均几乎不分解。甲同学认为:在无存在的情况下,、对催化分解无影响。25. 活性自由基HO可有效除去废水中的苯酚等有机污染物。(1)、H2O2在Fe3O4催化剂表面产生HO除去废水中的苯酚的原理如图-1所示。①酸性条件下,该催化过程中产生HO的反应的离子方程式为。
②在不同初始pH条件下,研究苯酚的去除率随时间的变化,结果表明:在反应开始时,初始pH=6的溶液中苯酚的去除率明显低于初始pH=3的溶液,但一段时间后两者接近,原因是。
(2)、掺杂了Cr3+的Fe3O4催化剂催化氧化原理如图-2所示。在Fe3O4催化剂中掺杂少量Cr3+ , 可提高催化效率,但浓度太高,反而会降低催化效率,其原因是。 (3)、光催化氧化技术也可生成HO降解有机污染物。其原理如图-3.光照时,价带失去电子产生有强氧化性的空穴。价带上生成HO的电极反应式为。图中,HO还有另外的产生途径,描述其产生过程:。26. 化合物X仅含三种元素,通过如下实验推断其组成:
(3)、光催化氧化技术也可生成HO降解有机污染物。其原理如图-3.光照时,价带失去电子产生有强氧化性的空穴。价带上生成HO的电极反应式为。图中,HO还有另外的产生途径,描述其产生过程:。26. 化合物X仅含三种元素,通过如下实验推断其组成: 已知:X、A、B、C、D均为单一物质。
已知:X、A、B、C、D均为单一物质。请回答:
(1)、组成X的元素是(填元素符号),X的化学式是。(2)、步骤Ⅰ,发生的化学方程式是。(3)、灼热黑色固体D投入乙醇中,固体变红,写出相应的化学方程式。(4)、步骤Ⅱ, 与A反应时理论消耗的物质的量之比是1∶2,但 实际消耗量却明显偏大,其原因是。请设计实验证明。27. 我国西安兵马佣二号坑出土的宝剑因含有铬而锋利无比。目前,工业用硬铬尖晶石(属于含氧酸盐,主要含MN2O4其中M代表Mg或Fe,N代表Cr或Al)制备重铬酸钠(工业流程如图),同时电解重铬酸钠溶液便可得到铬。 (1)、硬铬尖晶石中,Cr的化合价为。(2)、在步骤II中除去的离子是 , 操作X的名称为。(3)、写出步骤III中H2O2表现的性质是 , 已知步骤III所得溶液c(Cr3+)=0.010mol/L,常温下,加NaOH使c(Fe3+)和c(Al3+)均降至10-5mol/L,应控制溶液的pH为。(常温下:[Ksp[Cr(OH)3]=1.0×10-32 , Ksp[Al(OH)3]=1.0×10-35 , Ksp[Fe(OH)3]=1.0×10-38]。
(1)、硬铬尖晶石中,Cr的化合价为。(2)、在步骤II中除去的离子是 , 操作X的名称为。(3)、写出步骤III中H2O2表现的性质是 , 已知步骤III所得溶液c(Cr3+)=0.010mol/L,常温下,加NaOH使c(Fe3+)和c(Al3+)均降至10-5mol/L,应控制溶液的pH为。(常温下:[Ksp[Cr(OH)3]=1.0×10-32 , Ksp[Al(OH)3]=1.0×10-35 , Ksp[Fe(OH)3]=1.0×10-38]。A.10~11 B.>11 C.约为10 D.约为4
(4)、已知NaBiO3和Bi(OH)3都是难溶于水的固体。在步骤IV中发生化学反应的离子方程式为 , 步骤V中CO2压强越大Na2Cr2O7产率越高,其原因是。(5)、工业上用电解法制备铬,其装置示意图如图:
电解池工作时,阴极发生的电极反应式为 , 该装置的电能主要转变为能。
28.(1)、I.双氧水(主要成分H2O2)是常见的氧化剂、还原剂。如下图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式。
 (2)、H2O2可看作二元弱酸,写出它在水中第一步电离的方程式。(3)、II.A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。
(2)、H2O2可看作二元弱酸,写出它在水中第一步电离的方程式。(3)、II.A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。
若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式: 。
(4)、若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为(填代号)。a.NaHCO3 b.Na2CO3 c.Fe(OH)3 d.Na[Al(OH)4]
(5)、若A为淡黄色粉末,则A的电子式为。若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为(填代号)。a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(6)、若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式为 , E是(填化学式)。29. 过氧化氢的水溶液俗称双氧水,它的用途很广,常用于消毒、杀菌、漂白等.试回答下列问题: (1)、过氧化氢属于(极性/非极性)分子.(2)、Na2O2 , K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢溶液可取上述某种过氧化物与适量稀硫酸作用,然后经操作即可制得,则上述最适合的过氧化物是 .(3)、几乎所有古代艺术家的油画都是以铅白2PbCO3•Pb(OH)2为底色,但若空气中含H2S气体,铅白就会变黑,可以用H2O2将黑色物氧化成颜色相近的PbSO4而修复,写出铅白在空气中变黑的化学方程式: .(4)、甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入到质量分数为30%﹣70%的过氧化氢溶液中,①则该反应的化学方程式为 , ②过氧化氢比理论用量稍多,其目的是 . ③反应温度最好控制在30﹣70℃,温度不易过高,其主要原因是 .(5)、图2是硼氢化钠(NaBH4)一过氧化氢燃料电池示意图,该电池负极的电极反应方程式为 .(6)、过氧化氢与碳酸钠的加合物 Na2CO3•xH2O2比较稳定,方便储存,可用于消毒、漂白,现称取100g Na2CO3•xH2O2晶体加热,实验结果如图1所示,则该晶体的组成为 .30. 氧化剂过氧化氢在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。根据所学知识,回答下列问题:(1)、保存过氧化氢的试剂瓶上最适合贴上的一个标签是____(填标号)。A、
(1)、过氧化氢属于(极性/非极性)分子.(2)、Na2O2 , K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢溶液可取上述某种过氧化物与适量稀硫酸作用,然后经操作即可制得,则上述最适合的过氧化物是 .(3)、几乎所有古代艺术家的油画都是以铅白2PbCO3•Pb(OH)2为底色,但若空气中含H2S气体,铅白就会变黑,可以用H2O2将黑色物氧化成颜色相近的PbSO4而修复,写出铅白在空气中变黑的化学方程式: .(4)、甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入到质量分数为30%﹣70%的过氧化氢溶液中,①则该反应的化学方程式为 , ②过氧化氢比理论用量稍多,其目的是 . ③反应温度最好控制在30﹣70℃,温度不易过高,其主要原因是 .(5)、图2是硼氢化钠(NaBH4)一过氧化氢燃料电池示意图,该电池负极的电极反应方程式为 .(6)、过氧化氢与碳酸钠的加合物 Na2CO3•xH2O2比较稳定,方便储存,可用于消毒、漂白,现称取100g Na2CO3•xH2O2晶体加热,实验结果如图1所示,则该晶体的组成为 .30. 氧化剂过氧化氢在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。根据所学知识,回答下列问题:(1)、保存过氧化氢的试剂瓶上最适合贴上的一个标签是____(填标号)。A、 B、
B、 C、
C、 D、
D、 (2)、向滴加了淀粉溶液的溶液中加入 , 观察到的现象是。(3)、油画中铅白(碱式碳酸铅)与空气中的硫化氢反应生成硫化氢,可洗涤,发生反应为: , 则处理转移电子的物质的量是。(4)、向橙红色溶液中加入硫酸酸化,再加入足量 , 溶液变为蓝色 , 则上述反应中作剂(填“氧化”或“还原”),铬元素化合价(填“升高”“降低”或“不变”)。(5)、常温下,往溶液中滴加少量溶液,可发生如下两个反应:;。下列说法正确的是____(填标号)。A、的氧化性一定比强 B、在分解过程中,溶液的逐渐下降 C、在分解过程中,Fe2+和的总量保持不变 D、生产过程要严格避免混入
(2)、向滴加了淀粉溶液的溶液中加入 , 观察到的现象是。(3)、油画中铅白(碱式碳酸铅)与空气中的硫化氢反应生成硫化氢,可洗涤,发生反应为: , 则处理转移电子的物质的量是。(4)、向橙红色溶液中加入硫酸酸化,再加入足量 , 溶液变为蓝色 , 则上述反应中作剂(填“氧化”或“还原”),铬元素化合价(填“升高”“降低”或“不变”)。(5)、常温下,往溶液中滴加少量溶液,可发生如下两个反应:;。下列说法正确的是____(填标号)。A、的氧化性一定比强 B、在分解过程中,溶液的逐渐下降 C、在分解过程中,Fe2+和的总量保持不变 D、生产过程要严格避免混入