江苏省南通市2022-2023学年高一下学期化学期末质量监测试题
试卷更新日期:2023-07-28 类型:期末考试
一、单选题
-
1. 科技发展离不开材料的不断更新和优化。下列有关说法正确的是( )A、“天和”核心舱用的氮化硼()陶瓷属于合金材料 B、“天宫二号”卫星使用的高性能硅芯片中含有单质硅 C、“祝融号”火星车用于储能的正十一烷属于不饱和烃 D、“神舟”航天员的航天服所使用的合成纤维属于无机非金属材料
二、多选题
-
2. 黑火药是中国古代四大发明之一,其爆炸反应为。下列说法正确的是( )A、位于元素周期表区 B、的价层电子轨道表示式:
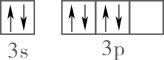 C、是极性分子
D、的电子式:
C、是极性分子
D、的电子式: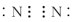
三、单选题
-
3. 实验室制取并探究其性质,下列实验装置能达到实验目的的是( )
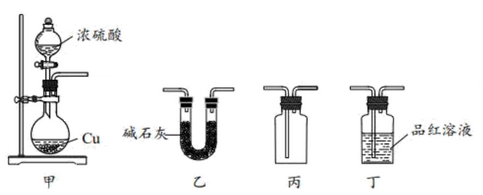 A、用装置甲制取 B、用装置乙干燥 C、用装置丙收集 D、用装置丁验证的还原性4. 氮元素可形成多种化合物。肼()又称联氨,是一种可燃性的液体,可用作火箭燃料。叠氮酸()是一种弱酸,可通过亚硝酸氧化肼获得。下列有关含氮微粒的说法正确的是( )A、中只含极性共价键 B、中原子的杂化轨道类型为 C、属于离子化合物 D、易液化是因为与之间易形成氢键5. 叠氮酸()是一种弱酸,可通过亚硝酸氧化肼获得,工业上利用催化氧化生成 , 反应为 , 将进一步氧化,用水吸收制备。下列说法正确的是( )A、与反应的离子方程式为 B、以为原料制备属于氮的固定 C、用蘸有浓氨水的玻璃棒靠近浓硝酸有白烟产生 D、催化氧化时,每生成 , 转移电子的数目为6. 硝酸是一种易挥发的液体,硝酸和纤维素可发生酯化反应制备硝酸纤维。下列有关物质的性质与用途具有对应关系的是( )A、性质稳定,可用作食品保护气 B、极易溶于水,常用作制冷剂 C、受热易分解,可用作氮肥 D、具有强氧化性,可用于制备硝酸纤维7. 短周期主族元素的原子序数依次增大。是地壳中含量最高的元素,是金属元素且第一电离能比同周期相邻元素大,与同主族。下列有关说法不正确的是( )A、电负性: B、离子半径: C、Y位于元素周期表第三周期ⅡA族 D、Z最高价氧化物对应水化物的酸性比W的弱8. 在指定条件下,下列选项所示的物质间转化能实现的是( )A、 B、 C、 D、(饱和溶液)9. 实验室用等作原料制取少量的实验流程如下:
A、用装置甲制取 B、用装置乙干燥 C、用装置丙收集 D、用装置丁验证的还原性4. 氮元素可形成多种化合物。肼()又称联氨,是一种可燃性的液体,可用作火箭燃料。叠氮酸()是一种弱酸,可通过亚硝酸氧化肼获得。下列有关含氮微粒的说法正确的是( )A、中只含极性共价键 B、中原子的杂化轨道类型为 C、属于离子化合物 D、易液化是因为与之间易形成氢键5. 叠氮酸()是一种弱酸,可通过亚硝酸氧化肼获得,工业上利用催化氧化生成 , 反应为 , 将进一步氧化,用水吸收制备。下列说法正确的是( )A、与反应的离子方程式为 B、以为原料制备属于氮的固定 C、用蘸有浓氨水的玻璃棒靠近浓硝酸有白烟产生 D、催化氧化时,每生成 , 转移电子的数目为6. 硝酸是一种易挥发的液体,硝酸和纤维素可发生酯化反应制备硝酸纤维。下列有关物质的性质与用途具有对应关系的是( )A、性质稳定,可用作食品保护气 B、极易溶于水,常用作制冷剂 C、受热易分解,可用作氮肥 D、具有强氧化性,可用于制备硝酸纤维7. 短周期主族元素的原子序数依次增大。是地壳中含量最高的元素,是金属元素且第一电离能比同周期相邻元素大,与同主族。下列有关说法不正确的是( )A、电负性: B、离子半径: C、Y位于元素周期表第三周期ⅡA族 D、Z最高价氧化物对应水化物的酸性比W的弱8. 在指定条件下,下列选项所示的物质间转化能实现的是( )A、 B、 C、 D、(饱和溶液)9. 实验室用等作原料制取少量的实验流程如下:
下列说法正确的是( )
A、“熔融”时应先将和混合加热一段时间后再加入 B、“溶解”后的溶液中存在大量的 C、“歧化”时氧化剂与还原剂的物质的量之比为 D、流程中可以循环使用的物质是10. 某有机物分子的结构简式如图所示。下列说法正确的是( ) A、该物质与乙酸互为同系物 B、分子中含有1个手性碳原子 C、该物质能发生加聚反应 D、分子中所有的碳原子共平面11. 根据实验操作和现象所得到的结论正确的是( )
A、该物质与乙酸互为同系物 B、分子中含有1个手性碳原子 C、该物质能发生加聚反应 D、分子中所有的碳原子共平面11. 根据实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
结论
A
常温下,铁片投入浓硫酸中,无明显现象
铁与浓硫酸不发生反应
B
将某气体通入溴水中,溴水褪色
该气体是乙烯
C
向乙醇中滴入少量酸性溶液,振荡,溶液的紫红色逐渐褪去
乙醇具有还原性
D
红热的炭投入浓硝酸中,产生红棕色气体
炭与浓硝酸发生了反应
A、A B、B C、C D、D12. 通过下列实验探究与的反应。将过量的通入溶液后,将溶液分为3份并进行以下实验:实验1:第一份溶液中加入少量溶液,溶液紫红色褪去
实验2:第二份溶液中滴加溶液,产生蓝色沉淀
实验3:第三份溶液中加入稀盐酸酸化的溶液,产生白色沉淀
下列说法正确的是( )
A、“实验一”中使溶液褪色的一定是 B、“实验二”说明溶液中含有 , 一定不含 C、“实验三”中产生的白色沉淀是 D、与反应的离子方程式为13. 工业上常采用溶液吸收工业尾气中的和 , 其原理如下:反应Ⅰ:
反应Ⅱ:
溶液浓度越大黏稠度越高。控制其他条件不变,将和体积比为、的混合气体分别通过体积相同、浓度不同的溶液后,氮氧化物吸收率变化如图所示。下列说法不正确的是( )
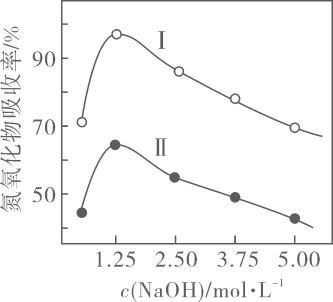 A、曲线Ⅰ表示体积比为的混合气体吸收率的变化 B、当浓度高于时,吸收率下降的原因可能是黏稠度过高,不利于氮氧化物气体的吸收 C、向体积比为的和混合气体中通入少量 , 可提高氮氧化物的吸收率 D、将和混合气体通入足量溶液中完全吸收,所得溶液中
A、曲线Ⅰ表示体积比为的混合气体吸收率的变化 B、当浓度高于时,吸收率下降的原因可能是黏稠度过高,不利于氮氧化物气体的吸收 C、向体积比为的和混合气体中通入少量 , 可提高氮氧化物的吸收率 D、将和混合气体通入足量溶液中完全吸收,所得溶液中四、结构与性质
-
14. 过渡金属(等)在工业生产中有重要的作用,是化学工作者研究的对象。(1)、的结构示意图如图-1所示。

①基态的核外电子排布式为。
②图中与之间形成的化学键称为。
③能与结合成 , 中的键角中的键角(填“>”、“<”或“=”)
(2)、锰元素能形成很多重要的化合物。①锰与碘形成的某种化合物的晶胞结构如图-2所示,该化合物的化学式为。

②能形成配合物 , 其配离子的结构如图-3所示(配体位于顶点)。若该配合物与足量反应生成沉淀,则化学式中的n为。

③三醋酸锰由硝酸锰晶体和乙酸酐反应制得。乙酸酐[]可由在一定条件下脱水形成,其结构如图-4所示,乙酸酐中所含的键数目为。已知羧酸是一大类含羧基()的有机酸,其酸性强弱由羧基中的羟基的极性大小决定。请解释的酸性大于的原因:。

五、有机推断题
-
15. 以乙烯为原料,合成化合物E的途径如下:
 (1)、D中碳原子采取的杂化方式为。(2)、C→D的反应类型为。(3)、写出B→C的化学反应方程式:。(4)、B与有机物X通过酯化反应生成
(1)、D中碳原子采取的杂化方式为。(2)、C→D的反应类型为。(3)、写出B→C的化学反应方程式:。(4)、B与有机物X通过酯化反应生成 , 则X的结构简式为。 (5)、已知:
, 则X的结构简式为。 (5)、已知:
 。试运用相关信息,补充完整以下合成路线流程图(补充①中的反应条件,写出有机物②、③的结构简式)。、、
。试运用相关信息,补充完整以下合成路线流程图(补充①中的反应条件,写出有机物②、③的结构简式)。、、 。
。六、工业流程题
-
16. 某锌焙烧矿(含和少量等)制备铁黄()和的步骤如下:
 (1)、滤渣的主要成分为。(2)、“还原”时加入过量精矿将还原为 , 该反应的化学方程式为。(3)、检验“还原”后的滤液中是否含的试剂是。(4)、向“还原”后的滤液中滴加氨水,至为5.5时停止滴加,开始通氧气,生成铁黄。通入氧气过程中,溶液随时间变化如图所示,已知时,完全沉淀的 , 时段发生的反应为;时段,溶液明显降低,请解释原因: 。
(1)、滤渣的主要成分为。(2)、“还原”时加入过量精矿将还原为 , 该反应的化学方程式为。(3)、检验“还原”后的滤液中是否含的试剂是。(4)、向“还原”后的滤液中滴加氨水,至为5.5时停止滴加,开始通氧气,生成铁黄。通入氧气过程中,溶液随时间变化如图所示,已知时,完全沉淀的 , 时段发生的反应为;时段,溶液明显降低,请解释原因: 。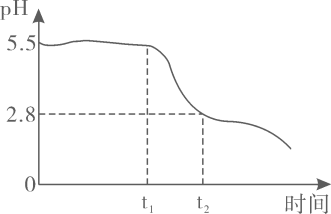 (5)、若上述流程中省略“还原”步骤,则制得的不纯,可能含有的杂质是。(6)、请补充完整由和的混合液制备的实验方案:向混合液中滴加溶液至在3.7~5.7之间,充分反应后过滤; ;边搅拌边向滤渣中滴加稀硫酸至沉淀完全溶解;将溶液蒸发浓缩,冷却结晶,过滤,干燥制得。(实验中须使用的试剂有:溶液、溶液、蒸馏水)。
(5)、若上述流程中省略“还原”步骤,则制得的不纯,可能含有的杂质是。(6)、请补充完整由和的混合液制备的实验方案:向混合液中滴加溶液至在3.7~5.7之间,充分反应后过滤; ;边搅拌边向滤渣中滴加稀硫酸至沉淀完全溶解;将溶液蒸发浓缩,冷却结晶,过滤,干燥制得。(实验中须使用的试剂有:溶液、溶液、蒸馏水)。已知:①当时,开始溶解。
②相关离子生成氢氧化物沉淀的如下表
离子
开始沉淀的
沉淀完全的
2.7
3.7
5.7
9.0
17. 含氮化合物对生态环境和人类健康都有一定的影响,必须采取相应的措施来治理或加以控制。(1)、生物硝化反硝化法可将酸性废水中的氨氮转化为氮气,其原理如图-1所示。
①的空间构型为。
②每处理含的酸性废水,理论上消耗的物质的量为。
③上述生物硝化反硝化法的优点是。
(2)、折点加氯法是将次氯酸钠投入废水中,将废水中的氨氮转化为的化学脱氮工艺。设定反应温度为 , 向含的酸性废水中投加时,浓度、氯胺()浓度与投入的溶液体积的关系如图-2所示。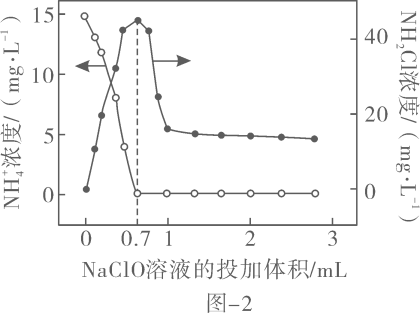
①在酸性废水中,投入的在过程中发生的反应为。投入量在的过程中反应的离子方程式为。
②实验证明,弱酸性有助于提高废水中氮的脱除率,其原因是。
(3)、腌制食品中亚硝酸盐允许残留量(以计)。为测定某咸菜中亚硝酸盐的残留量,取咸菜榨汁,经处理得无色溶液,将所得溶液转移至容量瓶并定容。取出溶液置于锥形瓶中,加入盐酸调节 , 再滴加至过量,待反应完成后用标准液滴定,共消耗体积为。则该市售咸菜的亚硝酸盐残留量是否符合安全标准。(写出计算过程) 。已知:;
-
-
-
-