湖北省黄冈市重点校2022-2023学年高一下学期化学期末综合选拔性联考试题
试卷更新日期:2023-07-28 类型:期末考试
一、单选题
-
1. 类比是研究物质性质常用的方法之一,下列类比不合理的是( )A、由能与反应生成 , 推测能与反应生成 B、向碳酸钠固体滴加几滴水,测得温度上升,推测向碳酸氢钠固体滴几滴水温度也上升 C、硅可作半导体器件,推测周期表金属与非金属交界线的锗具有半导体性能 D、溶液能与反应,推测溶液能与稀硫酸反应2. 向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知:b-a=5,线段Ⅳ表示生成一种含氧酸(HIO3),且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法不正确的是( )
 A、线段Ⅱ表示Fe2+的变化情况 B、线段Ⅳ发生反应的离子方程式为:I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O C、根据图象可计算a=6 D、原溶液中c(Fe2+)∶c(I-)∶c(Br-)=2∶1∶33. X、Y、Z、W是处于不同周期的前四周期常见元素,原子序数依次递增。Y原子最外层电子数是周期序数的3倍,基态z原子核外s能级与p能级电子数之比为。由上述元素组成的物质转化关系如图所示,其中m、n、q为单质,其它为化合物,甲具有磁性,丙为二元强酸。下列说法错误的是( )
A、线段Ⅱ表示Fe2+的变化情况 B、线段Ⅳ发生反应的离子方程式为:I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O C、根据图象可计算a=6 D、原溶液中c(Fe2+)∶c(I-)∶c(Br-)=2∶1∶33. X、Y、Z、W是处于不同周期的前四周期常见元素,原子序数依次递增。Y原子最外层电子数是周期序数的3倍,基态z原子核外s能级与p能级电子数之比为。由上述元素组成的物质转化关系如图所示,其中m、n、q为单质,其它为化合物,甲具有磁性,丙为二元强酸。下列说法错误的是( )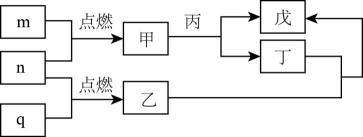 A、乙与丁反应物质的量之比为 B、乙分子构型为Ⅴ型 C、丙分子间可形成氢键 D、向戊中通入n可生成丁4. 用NA表示阿伏加德罗常数的值。下列叙述正确的是( )A、钠作除水剂时,每消耗1 mol Na,生成H2的分子数为NA B、工业合成氨时,每反应22.4 L(标准状况下)N2 , 生成的极性共价键数目为6NA C、电解精炼铜时,阳极质量每减少64 g,通过电路的电子数为2NA D、明矾净水时,0.1 mol/LAl3+形成的Al(OH)3胶粒的数目为0.1NA5. “人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
A、乙与丁反应物质的量之比为 B、乙分子构型为Ⅴ型 C、丙分子间可形成氢键 D、向戊中通入n可生成丁4. 用NA表示阿伏加德罗常数的值。下列叙述正确的是( )A、钠作除水剂时,每消耗1 mol Na,生成H2的分子数为NA B、工业合成氨时,每反应22.4 L(标准状况下)N2 , 生成的极性共价键数目为6NA C、电解精炼铜时,阳极质量每减少64 g,通过电路的电子数为2NA D、明矾净水时,0.1 mol/LAl3+形成的Al(OH)3胶粒的数目为0.1NA5. “人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( ) A、遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 B、滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 C、1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为3mol、7 mol D、该分子中的所有碳原子可能共平面6. 下列有关实验操作、现象和结论或解释均正确的是( )
A、遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 B、滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 C、1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为3mol、7 mol D、该分子中的所有碳原子可能共平面6. 下列有关实验操作、现象和结论或解释均正确的是( )选项
实验操作
实验现象
结论或解释
A
在Fe(NO3)2溶液中滴加酸化的H2O2
浅绿色变黄色
H2O2具有氧化性
B
向淀粉溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入银氨溶液溶液,
无银镜出现
不能判断是否水解
C
焰色反应实验时,某同学用洁净的铂丝蘸取样品在无色火焰上灼烧
直接观察到火焰的颜色呈黄色
该样品中含有钠元素,一定不含钾元素
D
向盛Na2SiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量
试管中溶液先变红后褪色,最后有白色沉淀
非金属性:Cl>Si
A、A B、B C、C D、D7. 下列实验方案不能达到实验目的的是( ) A、图A装置Cu和浓硝酸制取NO B、图B装置实验室制备Cl2 C、图C装置实验室制取乙酸乙酯 D、图D装置实验室分离CO和CO28. 狐刚子在“炼石胆取精华法”中作如下叙述:“以士擊(即砖坯)垒作两个方头炉,一炉中著铜盘,使定,即密泥之,一炉中以炭烧石胆(CuSO4·5H2O)使作烟,以物扇之,其精华尽入铜盘。炉中却火待冷……”。狐刚子所取“精华”为( )A、H2O B、SO2 C、稀硫酸 D、CuSO4溶液9. 下列有关甲、乙两种电池的说法中正确的是( )
A、图A装置Cu和浓硝酸制取NO B、图B装置实验室制备Cl2 C、图C装置实验室制取乙酸乙酯 D、图D装置实验室分离CO和CO28. 狐刚子在“炼石胆取精华法”中作如下叙述:“以士擊(即砖坯)垒作两个方头炉,一炉中著铜盘,使定,即密泥之,一炉中以炭烧石胆(CuSO4·5H2O)使作烟,以物扇之,其精华尽入铜盘。炉中却火待冷……”。狐刚子所取“精华”为( )A、H2O B、SO2 C、稀硫酸 D、CuSO4溶液9. 下列有关甲、乙两种电池的说法中正确的是( )
 A、甲:电池工作时化学能全部转化为电能 B、甲:电解液不可能采用氢氧化钠水溶液 C、乙:电池工作时,电子从a电极→灯泡→b电极→电解液→a电极 D、乙:正极电极反应式为CH3OCH3-12e- + 3H2O=2CO2 +12H+10. 下列三个化学反应焓变、平衡常数与温度的关系分别如下表所示。下列说法正确的是
A、甲:电池工作时化学能全部转化为电能 B、甲:电解液不可能采用氢氧化钠水溶液 C、乙:电池工作时,电子从a电极→灯泡→b电极→电解液→a电极 D、乙:正极电极反应式为CH3OCH3-12e- + 3H2O=2CO2 +12H+10. 下列三个化学反应焓变、平衡常数与温度的关系分别如下表所示。下列说法正确的是化学反应
平衡常数
温度
973K
1173K
①
1.47
2.15
②
2.38
1.67
③
a
b
A、1173K时,反应①起始 , 平衡时约为0.4 B、反应②是吸热反应, C、反应③达平衡后,升高温度或缩小反应容器的容积平衡逆向移动 D、相同温度下,;11. 二氧化氯(ClO2 , 黄绿色气体,易溶于水)是一种安全稳定、高效低毒的消毒剂,疫情防控中常用于环境的消毒。工业上通过情性电极电解氯化铵和盐酸的方法制备ClO2的原理如图所示。下列说法正确的是( ) A、当有0.2mol离子通过离子交换膜时,二氧化氯发生器中理论上产生13.5g ClO2 B、d为直流电源的负极,电解池a极上发生的电极反应为 C、二氧化氯发生器内,氧化剂与还原剂的物质的量之比为6∶1 D、离子交换膜为阳离子交换膜,在b极区流出的Y溶液是稀盐酸12. 煤的综合利用可以获得洁净的燃料及多种化工原料.下列不属于煤的综合利用的是( )A、煤干馏 B、煤液化 C、煤气化 D、煤燃烧13. 下列方案设计、现象和结论不正确的是( )
A、当有0.2mol离子通过离子交换膜时,二氧化氯发生器中理论上产生13.5g ClO2 B、d为直流电源的负极,电解池a极上发生的电极反应为 C、二氧化氯发生器内,氧化剂与还原剂的物质的量之比为6∶1 D、离子交换膜为阳离子交换膜,在b极区流出的Y溶液是稀盐酸12. 煤的综合利用可以获得洁净的燃料及多种化工原料.下列不属于煤的综合利用的是( )A、煤干馏 B、煤液化 C、煤气化 D、煤燃烧13. 下列方案设计、现象和结论不正确的是( )目的
方案设计
现象和结论
A
判断氯化银和碘化银的溶度积常数大小
向盛有溶液的试管中滴加溶液,再向其中滴加4~5滴溶液
先有白色沉淀生成,后又产生黄色沉淀,说明
B
证实金属防腐措施中牺牲阳极法的有效性
用饱和食盐水和琼脂粉配制琼脂溶液并倒入两个培养皿中,各滴加几滴酚酞和铁氰化钾溶液,将裹有锌皮和缠有铜丝的两个铁钉分别入培养皿,观察现象
裹有锌皮的铁钉周围出现红色,缠有铜丝的铁钉周围出现红色和蓝色,说明活泼性强的锌保护了铁
C
检验硫酸厂周边空气中是否含有二氧化硫
用注射器多次抽取空气,慢慢注入盛有酸性 , 稀溶液的同一试管中,观察溶液颜色变化
溶液不变色,说明空气中不含二氧化硫
D
检验乙炔分子中碳碳三键的稳定性
将饱和氯化钠溶液滴入盛有电石的烧瓶中制取乙炔,将纯净的乙炔通入盛有酸性高锰酸钾溶液的试管中,观察颜色变化
溶液紫红色逐渐褪去,说明乙炔不稳定,容易被氧化
A、A B、B C、C D、D14. 下列不能用勒夏特列原理解释的事实是( )A、黄绿色的氯水光照后颜色变浅 B、合成氨工业使用高压以提高氨的产量 C、棕红色的NO2加压后颜色先变深后变浅 D、氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深15. 化合物可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在以下热分解时无刺激性气体逸出。下列叙述正确的是( )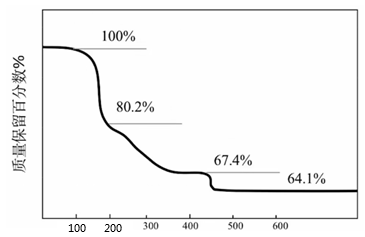 A、W、X、Y、Z的单质常温下均为气体 B、最高价氧化物的水化物的酸性: C、阶段热分解失去4个 D、热分解后生成固体化合物
A、W、X、Y、Z的单质常温下均为气体 B、最高价氧化物的水化物的酸性: C、阶段热分解失去4个 D、热分解后生成固体化合物二、工业流程题
-
16. 海水中溴元素主要以Br— 形式存在,工业上从海水中提取溴的流程如下:
 (1)、将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,写出吸收反应的化学方程式:(2)、吸收后的空气进行循环利用。吹出时,Br2 吹出率与吸收塔中SO2流量的关系如图所示。SO2 流量过大,Br2 吹出率反而下降的原因是:
(1)、将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,写出吸收反应的化学方程式:(2)、吸收后的空气进行循环利用。吹出时,Br2 吹出率与吸收塔中SO2流量的关系如图所示。SO2 流量过大,Br2 吹出率反而下降的原因是: (3)、工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2 , 完成下列化学方程式:Br2+ Na2CO3NaBrO3+ CO2+
(3)、工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2 , 完成下列化学方程式:Br2+ Na2CO3NaBrO3+ CO2+当有3molBr2参加反应,发生转移的电子的物质的量为。
(4)、用于吸收Br2的SO2是工业制硫酸的重要物质,其中主反应是催化氧化SO2.现将SO2与足量O2置于密闭容器中,在催化剂、500℃条件下发生反应。SO2与SO3的物质的量浓度随时间的变化如图所示,请回答下列问题。
i.反应开始至2min末,以SO2 的浓度变化表示该反应的平均速率是;2min时,反应是否达到化学平衡状态(填“是”或“否”)。
ii.关于该反应下列说法不正确的是。
a.催化剂可以增大化学反应速率
b.改变温度或压强,可以实现SO2的完全转化
c.若仅增大容器容积,则该化学反应速率增大
三、实验题
-
17. 资料显示,可以将氧化为。某小组同学设计实验探究被氧化的产物及铜元素的价态。
已知:易溶于溶液,发生反应(红棕色);和氧化性几乎相同。
I.将等体积的溶液加入到铜粉和的固体混合物中,振荡。
实验记录如下:
实验现象
实验Ⅰ
极少量溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色
实验Ⅱ
部分溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色
实验Ⅲ
完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色
(1)、初始阶段,被氧化的反应速率:实验Ⅰ(填“>”“<”或“=”)实验Ⅱ。(2)、实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有(蓝色)或(无色),进行以下实验探究:步骤a.取实验Ⅲ的深红棕色溶液,加入 , 多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
ⅰ.步骤a的目的是。
ⅱ.查阅资料, , (无色)容易被空气氧化。用离子方程式解释步骤的溶液中发生的变化:。
(3)、结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是 , 实验Ⅰ中铜被氧化的化学方程式是。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓溶液,(填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是。(4)、上述实验结果,仅将氧化为价。在隔绝空气的条件下进行电化学实验,证实了能将氧化为。装置如图所示,分别是。 (5)、运用氧化还原反应规律,分析在上述实验中被氧化的产物中价态不同的原因:。
(5)、运用氧化还原反应规律,分析在上述实验中被氧化的产物中价态不同的原因:。四、填空题
-
18. 反应:aA(g)+bB(g) cC(g)在恒温恒容条件下进行,各物质的浓度随时间变化的曲线如图所示。

(1)、该反应的化学方程式中,a:b:c为。(2)、反应从起始至20min内,A的平均反应速率v (A)=。平衡时B的体积分数为。(3)、判断该反应是否达到平衡的依据为(填字母)。
(1)、该反应的化学方程式中,a:b:c为。(2)、反应从起始至20min内,A的平均反应速率v (A)=。平衡时B的体积分数为。(3)、判断该反应是否达到平衡的依据为(填字母)。A 压强不随时间改变
B A的物质的量分数不随时间改变
C 气体的密度不随时间改变
D 单位时间内消耗A和B的物质的量相等
(4)、下列措施能增大反应速率的是(填字母)。A 升高温度 B 降低压强 C 减小C的浓度 D 加入合适的催化剂
(5)、N点的正反应速率v正(C)(填“大于”“小于”或“等于”)M点的逆反应速率v逆(C)。五、有机推断题
-
19. 高效低毒杀虫剂氯菊酯(I)可通过下列合成路线制备:

已知:化合物G和H在溶剂甲苯中发生反应生成化合物 , 和NaCl。
请回答下列问题:
(1)、A的结构简式为 , I中含有的含氧官能团的名称是 , A+B→C的反应类型是。(2)、反应E→F的化学方程式是。(3)、下列有关G和H的叙述正确的是(填序号)。a、H的结构简式为

b、G能与溴水发生加成反应
c、G和H都能与溶液反应生成白色沉淀
d、1molG最多能与3mol发生加成反应
(4)、芳香族化合物J比F少两个氢,J中有三种不同化学环境的氢,它们的数目比是9:2:1,则的可能结构有种;其中有且只含有一个酚羟基的同分异构体的酸性顺序为(用结构简式表示)。
-
-
-