河南省濮阳市2022-2023学年高二下学期化学学业质量检测试题
试卷更新日期:2023-07-28 类型:期末考试
一、单选题
-
1. 在人们的生产、生活和科技活动中,化学无处不在。下列有关说法错误的是( )A、纸尿裤等卫生用品及农林保水材料高吸水性树脂大都含有亲水基团 B、种植员如果将草木灰和化肥氯化铵混施会降低肥效 C、新冠疫情期间人们常使用75%的酒精溶液对皮肤和环境消毒 D、抗原检测提取管的材料聚乙烯是天然高分子化合物2. 下列有关反应热及相关知识的说法正确的是( )A、的燃烧热热化学方程式是 B、已知转化过程C(石墨,s)=(金刚石,s) , 则石墨比金刚石更稳定 C、中和热测定实验中,应把稀硫酸缓慢并分次倒入NaOH溶液中并搅拌 D、锌与稀硫酸的反应是放热反应,放热反应在常温常压下均能自发进行3. 2021年9月,中国科学院在Science上发表了颠覆性研究成果,在全球范围内首次实现了二氧化碳到淀粉的从头合成。该成果通过、制得 , 进而合成了人工淀粉[]。用代表阿伏加德罗常数的值,下列说法错误的是( )A、1mol中含有个π键 B、中的共价键是s-sσ键 C、中的氧原子采取杂化方式成键 D、淀粉能水解生成葡萄糖,给人体供给能量4. 化学工作者们常用化学语言来表征化学物质及其变化,下列化学用语正确的是( )A、的空间填充模型:
 B、乙酰胺的结构简式:
B、乙酰胺的结构简式: C、基态C原子的价层电子轨道表示式:
C、基态C原子的价层电子轨道表示式: D、基态Cr原子的核外电子排布式:
5. 物质变化常常伴随着能量变化。下图表示1mol(g)和1mol(g)反应生成NO(g)过程中能量的变化情况,下列有关说法正确的是( )
D、基态Cr原子的核外电子排布式:
5. 物质变化常常伴随着能量变化。下图表示1mol(g)和1mol(g)反应生成NO(g)过程中能量的变化情况,下列有关说法正确的是( ) A、该反应的热化学方程式为 B、16gO原子结合生成(g)时需要释放498kJ能量 C、NO分子中化学键的键能是632kJ D、断裂1molN-N键需要吸收946kJ能量6. 食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035g/mL。某研究小组用标准NaOH溶液测定食醋中醋酸的浓度,以检测食醋是否符合国家标准,某品牌白醋的醋酸浓度测定过程如图所示,下列有关叙述正确的是( )
A、该反应的热化学方程式为 B、16gO原子结合生成(g)时需要释放498kJ能量 C、NO分子中化学键的键能是632kJ D、断裂1molN-N键需要吸收946kJ能量6. 食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035g/mL。某研究小组用标准NaOH溶液测定食醋中醋酸的浓度,以检测食醋是否符合国家标准,某品牌白醋的醋酸浓度测定过程如图所示,下列有关叙述正确的是( ) A、量取10.00mL白醋可选用上图中的仪器乙 B、稀释时需使用烧杯、玻璃棒、胶头滴管和100mL容量瓶 C、滴定前锥形瓶需要用待测液(白醋稀释液)润洗2~3次 D、滴定过程中眼睛要注视碱式滴定管内溶液的刻度变化7. 磷酸奥司他韦是临床常用的抗病毒药物,常用于甲型和乙型流感治疗。其中间体结构如图所示,下列关于该有机物的说法错误的是( )
A、量取10.00mL白醋可选用上图中的仪器乙 B、稀释时需使用烧杯、玻璃棒、胶头滴管和100mL容量瓶 C、滴定前锥形瓶需要用待测液(白醋稀释液)润洗2~3次 D、滴定过程中眼睛要注视碱式滴定管内溶液的刻度变化7. 磷酸奥司他韦是临床常用的抗病毒药物,常用于甲型和乙型流感治疗。其中间体结构如图所示,下列关于该有机物的说法错误的是( ) A、所有碳原子一定不共面 B、分子中有手性碳原子 C、能与碳酸钠溶液反应产生二氧化碳 D、含氧官能团有酰胺基、醚键和酯基8. 碱金属氯化物是典型的离子化合物,NaCl和CsCl的晶胞结构如图所示,其中的碱金属离子能够与冠醚形成超分子,下列说法正确的是( )
A、所有碳原子一定不共面 B、分子中有手性碳原子 C、能与碳酸钠溶液反应产生二氧化碳 D、含氧官能团有酰胺基、醚键和酯基8. 碱金属氯化物是典型的离子化合物,NaCl和CsCl的晶胞结构如图所示,其中的碱金属离子能够与冠醚形成超分子,下列说法正确的是( ) A、NaCl晶体中a离子的配位数为12 B、每个CsCl晶胞中含有个1个CsCl分子 C、碱金属离子与冠醚通过离子键形成超分子 D、不同空穴尺寸的冠醚可识别不同的碱金属离子9. 可用作白色颜料和阻燃剂等。在实验室可利用的水解反应制取()的水解分三步,中间产物有SbOCl等),其总反应可表示为; 。下列有关说法错误的是( )A、实验室配制溶液时可将加入水中并加热 B、将缓慢加入大量水中有利于提高的转化率 C、实验后期加入少量氨水有利于提高的产率 D、水解时会发生反应10. 某兴趣小组设计并制作了一个简单的燃料电池,步骤如下:①按照如图装置组装仪器,U形管中注入滴有酚酞、1mol/L的溶液,在M处连接一个外加电源。一段时间后石墨Ⅱ附近气球的体积是石墨I附近气球体积的2倍。②2分钟后,将连接在M处的外加电源换作一个音乐盒,立即听到优美的音乐声响起,表明该小组的燃料电池制作成功。下列对该操作过程的叙述错误的是( )
A、NaCl晶体中a离子的配位数为12 B、每个CsCl晶胞中含有个1个CsCl分子 C、碱金属离子与冠醚通过离子键形成超分子 D、不同空穴尺寸的冠醚可识别不同的碱金属离子9. 可用作白色颜料和阻燃剂等。在实验室可利用的水解反应制取()的水解分三步,中间产物有SbOCl等),其总反应可表示为; 。下列有关说法错误的是( )A、实验室配制溶液时可将加入水中并加热 B、将缓慢加入大量水中有利于提高的转化率 C、实验后期加入少量氨水有利于提高的产率 D、水解时会发生反应10. 某兴趣小组设计并制作了一个简单的燃料电池,步骤如下:①按照如图装置组装仪器,U形管中注入滴有酚酞、1mol/L的溶液,在M处连接一个外加电源。一段时间后石墨Ⅱ附近气球的体积是石墨I附近气球体积的2倍。②2分钟后,将连接在M处的外加电源换作一个音乐盒,立即听到优美的音乐声响起,表明该小组的燃料电池制作成功。下列对该操作过程的叙述错误的是( ) A、步骤①中石墨I应连接外加电源的正极 B、步骤①中石墨Ⅱ附近的溶液变为红色 C、步骤②溶液中的移向电极石墨I D、步骤②中石墨Ⅱ电极上发生氧化反应11. 下列措施或现象不能用勒夏特列原理解释的是( )A、硫酸工业在高压条件下合成三氧化硫 B、用盐酸清洗锅炉水垢中的难溶碳酸盐 C、实验室橱柜中的氯水久置变质 D、生铁制品比纯铁制品更易发生锈蚀12. 元素W、X、Y、Z、M、N为原子序数依次增大的短周期主族元素,其中W与其他元素均不同周期,X、Y、Z、M、N能组成如下图所示的某水系离子电池的电解质,X、Y、Z、M同周期,Z与N同主族。X可与同族元素形成俗称为金刚砂的共价晶体,熔点高达2700℃,金刚砂具有与金刚石相似的结构。下列有关说法正确的是( )
A、步骤①中石墨I应连接外加电源的正极 B、步骤①中石墨Ⅱ附近的溶液变为红色 C、步骤②溶液中的移向电极石墨I D、步骤②中石墨Ⅱ电极上发生氧化反应11. 下列措施或现象不能用勒夏特列原理解释的是( )A、硫酸工业在高压条件下合成三氧化硫 B、用盐酸清洗锅炉水垢中的难溶碳酸盐 C、实验室橱柜中的氯水久置变质 D、生铁制品比纯铁制品更易发生锈蚀12. 元素W、X、Y、Z、M、N为原子序数依次增大的短周期主族元素,其中W与其他元素均不同周期,X、Y、Z、M、N能组成如下图所示的某水系离子电池的电解质,X、Y、Z、M同周期,Z与N同主族。X可与同族元素形成俗称为金刚砂的共价晶体,熔点高达2700℃,金刚砂具有与金刚石相似的结构。下列有关说法正确的是( ) A、WM分子中共价键的电子云轮廓图为
A、WM分子中共价键的电子云轮廓图为 B、分子的空间结构与水分子相似,属于极性分子
C、由键能大小可推知金刚石的熔点远低于2700℃
D、N所代表的元素基态原子核外有4个未成对电子
13. 科学家研究出一种新的催化剂能有效处理汽车尾气,其反应的化学方程式为 , 若反应在恒容密闭容器中进行,由该反应相关图像作出的判断正确的是( )
B、分子的空间结构与水分子相似,属于极性分子
C、由键能大小可推知金刚石的熔点远低于2700℃
D、N所代表的元素基态原子核外有4个未成对电子
13. 科学家研究出一种新的催化剂能有效处理汽车尾气,其反应的化学方程式为 , 若反应在恒容密闭容器中进行,由该反应相关图像作出的判断正确的是( )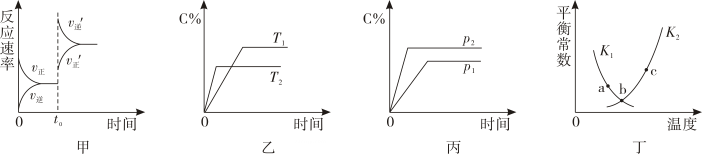 A、图甲中改变的反应条件为加入等量的NO和CO B、图乙中纵坐标可代表NO的百分含量 C、图丙中纵坐标可代表CO的百分含量 D、图丁中a、b、c三点均已达到化学平衡状态14. 实验是化学的最高法庭。下表实验中的实验操作、现象与结论均正确的是( )
A、图甲中改变的反应条件为加入等量的NO和CO B、图乙中纵坐标可代表NO的百分含量 C、图丙中纵坐标可代表CO的百分含量 D、图丁中a、b、c三点均已达到化学平衡状态14. 实验是化学的最高法庭。下表实验中的实验操作、现象与结论均正确的是( )选项
实验操作
实验现象
结论
A
将含有的乙烯气体通入酸性溶液中
溶液褪色
乙烯中含有
B
将含有氯化钠的苯甲酸置于坩埚中加热
固体质量大大减少
可用直接加热法除去苯甲酸中的氯化钠
C
将苯和苯磺酸的混合物加入到一定浓度的NaOH溶液中,充分振荡,静置
液体分层,上层是无色油状液体
可用NaOH溶液除去苯中的苯磺酸
D
将一根锌棒和一根铁棒用导线与电流表连接,插入纯水中
电流表指针未发生偏转
纯水不导电,水不是电解质
A、A B、B C、C D、D15. 胆矾()是一种重要的盐,在电镀、印染、颜料、农药等领域都有着广泛的应用,可写作 , 其结构如图1,胆矾溶于水可得溶液,如图2所示,向溶液中逐滴加入浓氨水至过量,得到透明的深蓝色溶液,其溶质为 , 再向其中加入乙醇,可析出深蓝色的晶体,其组成为 , 下列有关说法不正确的是( ) A、由图1知胆矾中的水在不同温度下会分步失去 B、胆矾晶体中存在离子键、共价键、氢键及范德华力 C、该实验证明配离子比稳定 D、加入乙醇能使在水中的溶解度减小16. 常温时,磷酸型体分布优势区域图如下图所示(虚线处表示两种型体浓度相等)。下列有关说法错误的是( )
A、由图1知胆矾中的水在不同温度下会分步失去 B、胆矾晶体中存在离子键、共价键、氢键及范德华力 C、该实验证明配离子比稳定 D、加入乙醇能使在水中的溶解度减小16. 常温时,磷酸型体分布优势区域图如下图所示(虚线处表示两种型体浓度相等)。下列有关说法错误的是( ) A、溶液中由水电离出的 B、溶液中存在: C、溶液中存在: D、0.1的溶液加水稀释,稀释过程中比值不变
A、溶液中由水电离出的 B、溶液中存在: C、溶液中存在: D、0.1的溶液加水稀释,稀释过程中比值不变二、原理综合题
-
17. 研究金属的腐蚀过程及防腐蚀对人们的日常生活有重大意义。某化学社团欲进行以下研究,回答相关问题:(1)、利用下图研究氧气的浓度对铁腐蚀速率的影响。插入海水中的铁棒(含碳量为10.8%)越靠近下端腐蚀就越(填“轻微”、“严重”)。
 (2)、利用下图研究电解质的酸碱性对铁腐蚀速率的影响。起始时两管内液面相平,均在恒温条件下研究。若溶液X是1mol/L的盐酸,一段时间后发现U形管内液面左低右高,则铁丝的腐蚀过程属于(填“吸氧腐蚀”或“析氢腐蚀”)。
(2)、利用下图研究电解质的酸碱性对铁腐蚀速率的影响。起始时两管内液面相平,均在恒温条件下研究。若溶液X是1mol/L的盐酸,一段时间后发现U形管内液面左低右高,则铁丝的腐蚀过程属于(填“吸氧腐蚀”或“析氢腐蚀”)。 (3)、利用下图装置研究铁的防腐过程:
(3)、利用下图装置研究铁的防腐过程:
①能最大程度地减缓铁棒腐蚀的方案是闭合(填“”、“”或“”)。
②若闭合 , 石墨电极附近的pH将(填“变大”、“变小”或“不变”)。
三、元素或物质推断题
-
18. W、X、Y、Z、M、N是原子序数依次增大的六种短周期元素,其中五种元素的元素性质或原子结构如下:
元素
元素性质或原子结构
W
电子只有一种自旋取向
X
基态原子最外层电子排布式为(n为正整数)
Z
原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都低于同周期相邻元素
M
原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都高于同周期相邻元素
N
最高正价和最低负价的代数和为6
请完成下列空白:
(1)、X、Y、Z三种元素的原子半径由大到小的顺序:(请填元素符号)。(2)、Y、Z两种元素的下列性质由大到小的顺序:电负性(请填元素符号)、第一电离能(请填元素符号)。(3)、X、Z的最简单氢化物的沸点:XZ(填“>”、“=”或“<”)。(4)、M的氧化物与N的最高价氧化物的水化物反应的化学方程式是:。四、工业流程题
-
19. 皓矾()主要用作制取颜料和其他含锌材料,在防腐、电镀、医学、畜牧业和农业上也有诸多应用。皓矾可由菱锌矿(主要成分为 , 还含有少量以及Ca、Mg、Fe、Cu等的化合物)制备,制备流程图如下:

已知:常温下,金属离子开始沉淀和完全沉淀()时的pH如下表所示:
金属离子
开始沉淀时pH
1.9
6.4
4.7
7.0
9.1
沉淀完全时pH
3.4
8.4
6.7
9.0
11.1
回答下列问题:
(1)、“浸取”工序中,能加快浸取效率的措施有(任写一种作答)。(2)、“氧化”时需控制温度在40~45℃进行反应,高于45℃的后果是。(3)、若“调pH过滤”工序中,调节溶液 , 所得“滤渣②”的主要成分有 , 则此时“滤液②”中为mol/L。(4)、“滤渣③”经化学除锌、物理加工处理后可得电极材料A,经电解法可在镀件上镀上一层铜。则电解时电极材料A发生的电极反应式是。(5)、“滤渣④”中含有和 , 可与热的浓硫酸反应制备氢氟酸,写出与热的浓硫酸反应的化学方程式。利用氢氟酸可制取杀鼠药氟乙酸(),氟乙酸的酸性(填“大于”“等于”或“小于”)乙酸的酸性。(6)、从滤液④获得皓矾晶体的具体操作为蒸发浓缩、、过滤、洗涤、干燥。五、原理综合题
-
20. 我国政府承诺争取在2030年前实现碳达峰,2060年前实现碳中和,彰显作为大国的担当和责任。因此,研发利用技术、降低空气中含量成为化学科学家研究的热点,其中将二氧化碳转化为绿色燃料甲醇是一个重要方向。回答下列问题:(1)、甲醇的制备反应一般认为通过如下两步来实现:
已知:
则反应的△H=kJ/mol。已知正反应的活化能是(正),则逆反应的活化能(逆)=kJ/mol(用含(正)的式子表示)。
(2)、在T℃下,向2L恒容密闭容器中充入1mol和3mol , 假设只进行反应 , 第20min时达到化学平衡状态,测得的反应速率为0.02。回答下列问题:①下列说法能说明反应达到化学平衡状态的是(填标号)。
A.
B.该温度下的值恒定
C.容器内气体的密度不再发生变化
D.反应物分子的有效碰撞几率不再变化
②计算T℃下该反应的化学平衡常数K=(保留3位有效数字)。
③从反应的自发性角度看,合成甲醇的反应在较(填“高”或“低”)温度下能自发进行。
(3)、某科研小组研究不同催化剂对反应的影响。相同条件下,在三个恒容容器中充入等量和的混合物,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内的转化率随温度变化如图所示:
①催化剂效果最佳的反应是(填“反应I”“反应II”或“反应III”)。
②b点v(正)v(逆)(填“>”“<”或“=”)。
③试解释c点的转化率比a点低的原因。
六、有机推断题
-
21. 超薄软性隐形眼镜可由加聚产物聚甲基丙烯酸羟乙酯(HEMA)制成,结构中的亲水基团(羟基)使得镜片柔软有弹性,佩戴时无异物感。HEMA的一种合成路线为:

已知:I的产量可以用来衡量一个国家石油化学工业的发展水平;A与I互为同系物;B的核磁共振氢谱有两组峰。请完成下列问题:
(1)、B→C的反应条件是。(2)、C→D的反应类型是。(3)、F中含有的含氧官能团名称为。G的名称为。(4)、写出下列反应的化学方程式:①A→B;
②H→HEMA。
(5)、K是F的同分异构体,能发生银镜反应,且1molK最多能消耗4mol。写出所有符合条件的K的结构简式。
-
-
-
-