高考二轮复习知识点:氮的氧化物的性质及其对环境的影响
试卷更新日期:2023-07-28 类型:二轮复习
一、选择题
-
1. 研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是()
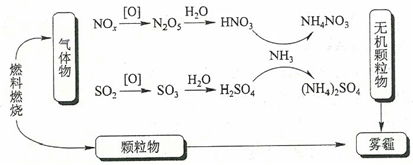
A、雾和霾的分散剂相同 B、雾霾中含有硝酸铵和硫酸铵 C、NH3是形成无机颗粒物的催化剂 D、雾霾的形成与过度施用氮肥有关2. 硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注,下列说法正确的是( )A、NO2和SO2均为红棕色且有刺激性气味的气体,是酸雨的主要成因 B、汽车尾气中的主要大气污染物为NO、SO2和PM2.5 C、植物直接吸收利用空气中的NO和NO2作为肥料,实现氮的固定 D、工业废气中的SO2可采用石灰法进行脱除3. 自然界与人类活动均对氮的循环产生影响。下列说法正确的是A、大豆富含蛋白质,豆浆煮沸后蛋白质转化为氨基酸 B、汽车尾气中的NO主要来源于汽油的不充分燃烧 C、氮化硅陶瓷属于传统无机非金属材料,可用于制造汽车发动机 D、亚硝酸钠可用于肉制品的生产,不仅可以防腐还可以保护其颜色4. SO2、Cl2、NO2都是大气污染物,下列说法正确的是( )A、都能使品红试液褪色,原理相同 B、都能与水反应,生成物都是电解质 C、等物质的量的SO2和Cl2混合通入装有湿润的有色布条的试管中,漂白效果更好 D、将SO2、NO2同时通入水中,加入BaCl2溶液有白色沉淀生成5. 海洋生物参与氮循环的过程如图所示,下列说法正确的是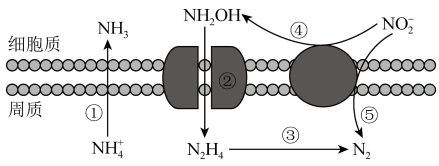 A、图中微粒间的转化均属于氧化还原反应 B、酸性环境有利于反应① C、反应③可能有氧气参与反应 D、反应③、⑤属于氮的固定6. 室温下,将充满的试管倒立于水中,充分反应,如图所示,下列分析错误的是
A、图中微粒间的转化均属于氧化还原反应 B、酸性环境有利于反应① C、反应③可能有氧气参与反应 D、反应③、⑤属于氮的固定6. 室温下,将充满的试管倒立于水中,充分反应,如图所示,下列分析错误的是 A、不能用排水法收集 B、剩余的无色气体约占试管体积的 C、试管中的溶液能使石蕊试液变红色 D、向试管中缓慢通入 , 液面上升但不可能充满试管7. 含有氮氧化物的尾气需处理后才能排放,溶液均可用于吸收NO和 , 其主要反应为:i.;
A、不能用排水法收集 B、剩余的无色气体约占试管体积的 C、试管中的溶液能使石蕊试液变红色 D、向试管中缓慢通入 , 液面上升但不可能充满试管7. 含有氮氧化物的尾气需处理后才能排放,溶液均可用于吸收NO和 , 其主要反应为:i.;ii.。已知,溶液不能单独吸收NO;一定条件下,一段时间内,当时,氮氧化物吸收效率最高。下列说法错误的是
A、氮氧化物的排放会导致产生光化学烟雾、形成酸雨等 B、采用气、液逆流方式可提高单位时间内NO和的吸收率 C、标准状况下,反应ⅱ中,每吸收2.24L 转移电子数约为 D、该条件下,时,氮氧化物吸收效率不是最高的可能原因是反应速率ⅱ<ⅰ8. 某钒催化剂在一定条件下形成相邻的氧化还原位和酸性吸附位,该催化剂催化NH3脱除电厂烟气中NO的反应机理如图所示。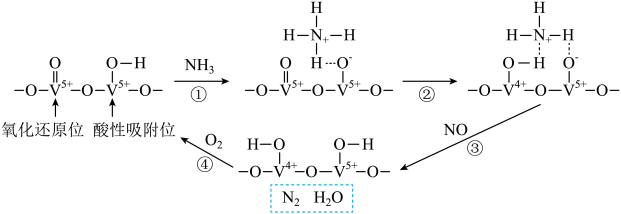
下列说法正确的是
A、反应①~④均为氧化还原反应 B、反应②为NH+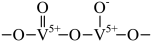 =NH+
=NH+ 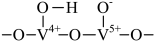 C、消耗0.5molO2 , 理论上可处理1molNO
D、总反应方程式为4NH3+6NO5N2+6H2O
9. 用方法可将汽车尾气中的和转化为无污染的气体。下列说法正确的是
C、消耗0.5molO2 , 理论上可处理1molNO
D、总反应方程式为4NH3+6NO5N2+6H2O
9. 用方法可将汽车尾气中的和转化为无污染的气体。下列说法正确的是 A、过程中作催化剂 B、过程Ⅰ只发生还原反应,过程Ⅱ只发生氧化反应 C、为直线型非极性分子,一个分子内存在4个键 D、该过程的总反应为:10. 下列说法错误的是A、将粗硅用HCl转化为SiHCl3 , 再经H2还原得到高纯硅 B、NaClO比HClO稳定得多,NaClO溶液可长期存放而不分解 C、碳化硅(SiC)具有类似金刚石的结构,硬度很大,可作耐磨材料 D、硝酸生产尾气中的NOx可用Na2CO3溶液或NH3处理11. 图为酸雨形成的示意图。下列说法正确的是( )
A、过程中作催化剂 B、过程Ⅰ只发生还原反应,过程Ⅱ只发生氧化反应 C、为直线型非极性分子,一个分子内存在4个键 D、该过程的总反应为:10. 下列说法错误的是A、将粗硅用HCl转化为SiHCl3 , 再经H2还原得到高纯硅 B、NaClO比HClO稳定得多,NaClO溶液可长期存放而不分解 C、碳化硅(SiC)具有类似金刚石的结构,硬度很大,可作耐磨材料 D、硝酸生产尾气中的NOx可用Na2CO3溶液或NH3处理11. 图为酸雨形成的示意图。下列说法正确的是( )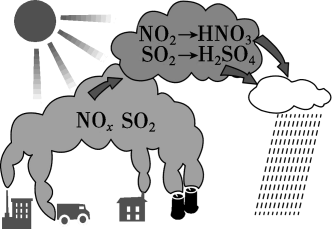 A、空气中的溶于水也会形成酸雨 B、易溶于水,并在雨水中转化为 C、含的雨水在空气中放置其pH可能会降低 D、硝酸型酸雨会腐蚀石灰岩建筑,而硫酸型酸雨不能12. SO2、NOx是重要化工原料,可用于硫酸、硝酸的生产。工业制硫酸时,接触室中主要反应为:2SO2(g)+O2(g) =2SO3(g) ΔH=-196.6 kJ·mol-1 , SO2、NOx也是大气主要污染物,NOx可与NH3混合,通过选择性催化剂高温脱除,SO2可通过碱液吸收去除。在指定条件下,下列选项所示的物质间转化能实现的是( )A、NO(g)HNO3(aq) B、SO2(g)H2SO4(aq) C、SO2 NH4HSO3(aq) D、NOxN2(g)13. 研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物一光化学烟雾,其中某些反应过程如图所示,下列说法错误的是( )
A、空气中的溶于水也会形成酸雨 B、易溶于水,并在雨水中转化为 C、含的雨水在空气中放置其pH可能会降低 D、硝酸型酸雨会腐蚀石灰岩建筑,而硫酸型酸雨不能12. SO2、NOx是重要化工原料,可用于硫酸、硝酸的生产。工业制硫酸时,接触室中主要反应为:2SO2(g)+O2(g) =2SO3(g) ΔH=-196.6 kJ·mol-1 , SO2、NOx也是大气主要污染物,NOx可与NH3混合,通过选择性催化剂高温脱除,SO2可通过碱液吸收去除。在指定条件下,下列选项所示的物质间转化能实现的是( )A、NO(g)HNO3(aq) B、SO2(g)H2SO4(aq) C、SO2 NH4HSO3(aq) D、NOxN2(g)13. 研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物一光化学烟雾,其中某些反应过程如图所示,下列说法错误的是( )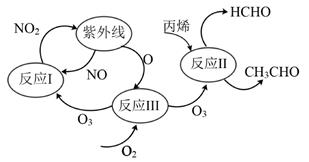 A、紫外线作用下,NO2中有氮氧键发生断裂 B、反应I的的方程式是2NO+O2=2NO2 C、反应II中丙烯是还原剂 D、经反应III,O2转化为了O314. 下列叙述错误的是( )A、食品中添加适量的二氧化硫可以起到漂白、防腐和抗氧化等作用 B、大气污染物主要包括氮氧化物、硫氧化物、二氧化碳等 C、将垃圾进行分类处理,可实现资源的合理利用 D、硫酸铝可用于去除污水中的细小悬浮物15. 以天然气为原料合成氨是新的生产氮肥的方法,其工艺流程如下。下列说法正确的是( )
A、紫外线作用下,NO2中有氮氧键发生断裂 B、反应I的的方程式是2NO+O2=2NO2 C、反应II中丙烯是还原剂 D、经反应III,O2转化为了O314. 下列叙述错误的是( )A、食品中添加适量的二氧化硫可以起到漂白、防腐和抗氧化等作用 B、大气污染物主要包括氮氧化物、硫氧化物、二氧化碳等 C、将垃圾进行分类处理,可实现资源的合理利用 D、硫酸铝可用于去除污水中的细小悬浮物15. 以天然气为原料合成氨是新的生产氮肥的方法,其工艺流程如下。下列说法正确的是( ) A、反应①使用催化剂可提高反应速率和甲烷的平衡转化率 B、反应②的原子利用率为100% C、生成1.0 mol NH4NO3至少需要0.75 mol CH4 D、反应③理论上当n( NH3):n(O2)= 4:3时,恰好完全反应16. 下列离子方程式书写正确的是( )A、用醋酸除去水垢: B、铝粉和NaOH溶液反应制取少量H2: C、NO2通入水中制硝酸: D、电解饱和食盐水:17. 室温下,将充满NO2的试管倒立在水中,实验现象如图。下列分析不正确的是( )
A、反应①使用催化剂可提高反应速率和甲烷的平衡转化率 B、反应②的原子利用率为100% C、生成1.0 mol NH4NO3至少需要0.75 mol CH4 D、反应③理论上当n( NH3):n(O2)= 4:3时,恰好完全反应16. 下列离子方程式书写正确的是( )A、用醋酸除去水垢: B、铝粉和NaOH溶液反应制取少量H2: C、NO2通入水中制硝酸: D、电解饱和食盐水:17. 室温下,将充满NO2的试管倒立在水中,实验现象如图。下列分析不正确的是( ) A、NO2易溶于水,不能用排水法收集 B、试管中剩余的无色气体是未溶解的NO2 C、取试管中的溶液,滴加紫色石蕊溶液,溶液显红色,是因为NO2与H2O反应生成了酸 D、向试管中再缓缓通入一定量的O2 , 试管中的液面上升18. 下列说法不正确的是( )A、常温下钠和钾的合金呈液态,可用作快中子反应堆的导热剂 B、铁粉和氧化铝可用于焊接铁轨 C、硫酸可用于金属材料表面的清洗 D、极少量的能促进血管扩张,防止栓塞19. 下列“类比”结果正确的是( )A、氯气能使紫色石蕊试液先变红后褪色,则SO2也能使紫色石蕊试液先变红后褪色 B、SiH4的沸点比CH4高,则PH3的沸点也比NH3高 C、CO2是酸性氧化物,则NO2也是酸性氧化物 D、MnO2与浓HCl共热可制Cl2 , 则MnO2与浓HBr共热也可制Br220. 我国空间技术发展迅速,跻身世界先进国家行列。下列说法错误的是 ( )
A、NO2易溶于水,不能用排水法收集 B、试管中剩余的无色气体是未溶解的NO2 C、取试管中的溶液,滴加紫色石蕊溶液,溶液显红色,是因为NO2与H2O反应生成了酸 D、向试管中再缓缓通入一定量的O2 , 试管中的液面上升18. 下列说法不正确的是( )A、常温下钠和钾的合金呈液态,可用作快中子反应堆的导热剂 B、铁粉和氧化铝可用于焊接铁轨 C、硫酸可用于金属材料表面的清洗 D、极少量的能促进血管扩张,防止栓塞19. 下列“类比”结果正确的是( )A、氯气能使紫色石蕊试液先变红后褪色,则SO2也能使紫色石蕊试液先变红后褪色 B、SiH4的沸点比CH4高,则PH3的沸点也比NH3高 C、CO2是酸性氧化物,则NO2也是酸性氧化物 D、MnO2与浓HCl共热可制Cl2 , 则MnO2与浓HBr共热也可制Br220. 我国空间技术发展迅速,跻身世界先进国家行列。下列说法错误的是 ( )
“天问一号”火星探测器

“人造太阳”核聚变装置

“长征二号”运载火箭
 “中国天眼”射电望远镜
“中国天眼”射电望远镜A. 太阳能帆板实现光伏发电属原电池
B. 核聚变燃料、互为同位素
C. 扩散到空气中变为红棕色
D. 碳化硅陶瓷属于新型无机非金属材料
A、A B、B C、C D、D21. 某化学兴趣小组用如图所示装置检验Pb(NO3)2受热分解的产物(图中夹持和加热设备略去)。在试管中放入研碎的Pb(NO3)2晶体后,加热;实验结束后,试管中得到黄色粉末(PbO),U形管下部有少量液体X,集气瓶中收集到无色气体Y。下列说法错误的是( ) A、液体X可能是液化的NO2或N2O4 B、在装置中用锡纸将胶塞、胶管与产生的气体隔开,主要是为了防止其被生成的气体腐蚀 C、气体Y可能是O2 , 也可能是NO2与水反应后生成的NO D、停止反应,应注意先把导气管移出水面,然后熄灭火焰22. 化学与人类生活、生产密切相关,下列说法正确的是( )A、经分析嫦娥五号采样返回器带回的月壤含有 ,该物质属于氧化物 B、雷雨发庄稼、光化学烟雾、水体富营养化、雾霾的形成均与氮的氧化物有关 C、75%的乙醇溶液可以有效杀死新型冠状病毒,因为其具有强的氧化性 D、生产SMS医用口罩所用的原料丙烯,主要来源于石油的裂解23. 氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-904kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。下列选项所述措施均能减少大气中NOx含量的是( )
A、液体X可能是液化的NO2或N2O4 B、在装置中用锡纸将胶塞、胶管与产生的气体隔开,主要是为了防止其被生成的气体腐蚀 C、气体Y可能是O2 , 也可能是NO2与水反应后生成的NO D、停止反应,应注意先把导气管移出水面,然后熄灭火焰22. 化学与人类生活、生产密切相关,下列说法正确的是( )A、经分析嫦娥五号采样返回器带回的月壤含有 ,该物质属于氧化物 B、雷雨发庄稼、光化学烟雾、水体富营养化、雾霾的形成均与氮的氧化物有关 C、75%的乙醇溶液可以有效杀死新型冠状病毒,因为其具有强的氧化性 D、生产SMS医用口罩所用的原料丙烯,主要来源于石油的裂解23. 氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-904kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。下列选项所述措施均能减少大气中NOx含量的是( )①减少化石燃料的使用②烟气催化脱硝处理③使用强氧化剂氧化脱氮④用生石灰改良酸性土壤
A、①②③ B、①③④ C、②③④ D、①②④24. 已知 .图中装置不能达到相应实验目的的是( )A
B
C
D




生成NO2
收集NO2
吸收NO2尾气
使NO2充分转化为HNO3
A、A B、B C、C D、D二、非选择题
-
25. SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放.(1)、
SCR(选择性催化还原)工作原理:
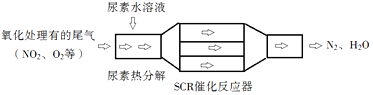
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2 , 该反应的化学方程式: .
②反应器中NH3还原NO2的化学方程式: .
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4 , 使催化剂中毒.用化学方程式表示(NH4)2SO4的形成: .
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g•mol﹣1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3 , 所得NH3用过量的v1 mL c1 mol•L﹣1H2SO4溶液吸收完全,剩余H2SO4用v2mL c2 mol•L﹣1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是 .
(2)、NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示.
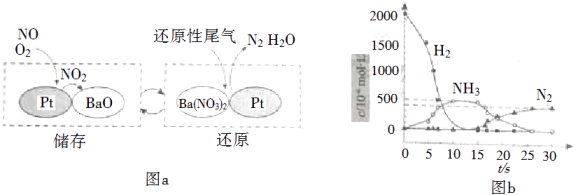
①通过BaO和Ba(NO3)2的相互转化实验NOx的储存和还原.储存NOx的物质是 .
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系.第一步反应消耗的H2与Ba(NO3)2的物质的量之比是 .
③还原过程中,有时会产生笑气(N2O).用同位素示踪法研究发现笑气的产生与NO有关.在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO.将该反应的化学方程式补充完整: .
26. 亚硝酰氯 可作为有机合成试剂。已知:①
②沸点: 为-6℃, 为-34℃, 为-152℃。
③ 易水解,能与 反应。
某研究小组用 和 在如图所示装置中制备 ,并分离回收未反应的原料。

回答问题:
(1)、通入 和 前先通入氩气,作用是;仪器 的名称是。(2)、将催化剂负载在玻璃棉上而不是直接平铺在玻璃管中,目的是。(3)、实验所需的 可用 和 溶液在稀 中反应制得,离子反应方程式为。(4)、为分离产物和未反应的原料,低温溶槽A的温度区间应控制在 , 仪器C收集的物质是。(5)、无色的尾气若遇到空气会变为红棕色,原因是。27. 烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
Ⅰ.采样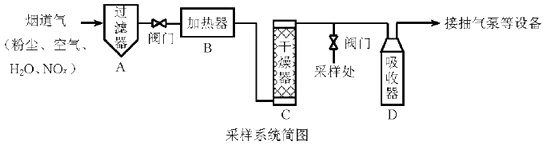
采样步骤:
①检验系统气密性;②加热器将烟道气加热至140℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。(1)、A中装有无碱玻璃棉,其作用是。(2)、C中填充的干燥剂是(填序号)。a.碱石灰
b.无水CuSO4
c.P2O5
(3)、用实验室常用仪器组装一套装置,其作用是与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。 (4)、采样步骤②加热烟道气的目的是。(5)、Ⅱ.NOx含量的测定
(4)、采样步骤②加热烟道气的目的是。(5)、Ⅱ.NOx含量的测定将v L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3− , 加水稀释至100.00 mL。量取20.00 mL该溶液,加入v1 mL c1 mol·L−1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L−1 K2Cr2O7标准溶液滴定剩余的Fe2+ , 终点时消耗v2 mL。
NO被H2O2氧化为NO3−的离子方程式是。
(6)、滴定操作使用的玻璃仪器主要有。(7)、滴定过程中发生下列反应:3Fe2++NO3−+4H+=NO↑+3Fe3++2H2O
Cr2O72−+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O
则气样中NOx折合成NO2的含量为mg·m−3。
(8)、判断下列情况对NOx含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”)若缺少采样步骤③,会使测试结果。
若FeSO4标准溶液部分变质,会使测定结果。
28. 含氮化合物(NOx、NO等)是主要污染物之一,消除含氮化合物的污染备受关注。请回答下列问题:(1)、I.NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图1所示;若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。
图1种BaO的作用是。用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,第一步反应的化学方程式为。
(2)、II.用铁去除含氮废水中的硝酸盐(NO)是重要的方法。一种去除NO的过程如图:
过程中“操作”的名称是。酸化废水与铁粉反应的离子方程式是。
(3)、研究发现Fe2+能与FeO(OH)反应生成Fe3O4。在去除NO的过程中,Fe3O4(导电)覆盖在铁粉表面,随着反应的进行,产生FeO(OH)(不导电),它覆盖在Fe3O4表面,形成钝化层,阻碍电子传输,导致NO的去除率低,若要提高NO的去除率,可采取的措施是。(4)、III.测定某废水中NO含量。先取VmL含NO水样并将O2驱除,加入催化剂、V1mLc1mol·L-1FeSO4标准溶液(过量),再加入稀H2SO4;最后用c2mol·L-1的K2Cr2O7标准溶液滴定剩余的Fe2+ , 滴定至终点时消耗V2mL。已知:3Fe2++NO+4H+=NO↑+3Fe3++2H2O,Cr2O+14H++6Fe2+=2Cr3++6Fe3++7H2O
加入稀H2SO4的作用是。
(5)、水样中NO的含量为mol·L-1(用含c1、c2、V1、V2、V1的代数式表示)。如果在加入FeSO4标准溶液之前没有驱除O2 , 则测定结果。(填“偏大”或“偏小”)。29. NOX(主要指NO和)是大气主要污染物之一。有效去除大气中的是环境保护的重要课题。回答下列问题:(1)、用水吸收NOX的相关热化学方程式如下。①反应的。
②中心原子上的价层电子对数为。
(2)、用稀硝酸吸收 , 得到和的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:。(3)、用酸性水溶液吸收 , 吸收过程中存在与生成和的反应,写出该反应的化学方程式:。(4)、在催化剂的作用下能与反应生成。①与生成的反应的化学方程式为 , 当1mol 完全反应时,转移的电子数为。
②在有氧条件下,新型催化剂M能催化与反应生成。将一定比例的、和的混合气体,匀速通入装有催化剂M的反应器中,反应相同时间的去除率随反应温度的变化曲线如图所示。

当反应温度高于380℃时,的去除率迅速下降的原因可能是。
30. 固体化合物X由3种短周期元素组成,某学习小组开展如下探究实验。 已知:非金属氧化物A的相对分子质量为44;气体C能使湿润的红色石蕊试纸变蓝色;气体G是空气中含量最多的单质。请问答:(1)、组成D的非金属元素是(填元素符号),写出C的电子式。(2)、步骤Ⅱ,发生反应的化学方程式是。(3)、工业上制备X是将金属单质与液态C反应得到,写出该反应的化学方程式为。(4)、某同学将擦亮的单质F投入装有足量浓硫酸的大试管中,微热,有黑色和白色的固体析出,但无气体产生(已知,黑色固体由2种元素组成,金属元素质量分数为80%,难溶于水和稀硫酸,可溶于硝酸)。请设计实验验证黑色固体的组成元素。
已知:非金属氧化物A的相对分子质量为44;气体C能使湿润的红色石蕊试纸变蓝色;气体G是空气中含量最多的单质。请问答:(1)、组成D的非金属元素是(填元素符号),写出C的电子式。(2)、步骤Ⅱ,发生反应的化学方程式是。(3)、工业上制备X是将金属单质与液态C反应得到,写出该反应的化学方程式为。(4)、某同学将擦亮的单质F投入装有足量浓硫酸的大试管中,微热,有黑色和白色的固体析出,但无气体产生(已知,黑色固体由2种元素组成,金属元素质量分数为80%,难溶于水和稀硫酸,可溶于硝酸)。请设计实验验证黑色固体的组成元素。