高考二轮复习知识点:硝酸的化学性质
试卷更新日期:2023-07-28 类型:二轮复习
一、选择题
-
1. 下列有关化学反应的叙述正确的是( )A、室温下,Na在空气中反应生成Na2O2 B、室温下,Al与4.0 mol﹒L-1NaOH溶液反应生成NaAlO2 C、室温下,Cu与浓HNO3反应放出NO气体 D、室温下,Fe与浓H2SO4反应生成FeSO42. 下列有关化学反应的叙述正确的是( )A、Fe在稀硝酸中发生钝化 B、MnO2和稀盐酸反应制取Cl2 C、SO2与过量氨水反应生成(NH4)2SO3 D、室温下Na与空气中O2反应制取Na2O23.
下述实验中均有红棕色气体产生,对比分析所的结论不正确的是( )
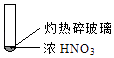
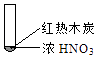
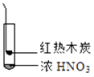
①
②
③
A、由①中的红棕色气体,推断产生的气体一定是混合气体 B、红棕色气体不能表明②中木炭与浓硝酸产生了反应 C、由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 D、③的气体产物中检测出CO2 , 由此说明木炭一定与浓硝酸发生了反应4. 根据实验操作及现象,下列结论中正确的是选项
实验操作及现象
结论
常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象
稀硝酸的氧化性比浓硝酸强
取一定量样品,溶解后加入溶液,产生白色沉淀。加入浓 , 仍有沉淀
此样品中含有
将银和溶液与铜和溶液组成原电池。连通后银表面有银白色金属沉积,铜电极附近溶液逐渐变蓝
的金属性比强
向溴水中加入苯,振荡后静置,水层颜色变浅
溴与苯发生了加成反应
A、A B、B C、C D、D5. 下列说法正确的是( )A、工业上通过电解六水合氯化镁制取金属镁 B、接触法制硫酸时,煅烧黄铁矿以得到三氧化硫 C、浓硝酸与铁在常温下不反应,所以可用铁质容器贮运浓硝酸 D、“洁厕灵”(主要成分为盐酸)和“84消毒液”(主要成分为次氯酸钠)不能混用6. 化学是以实验为基础的科学。下列实验操作或做法正确且能达到目的的是( )选项
操作或做法
目的
A
将铜丝插入浓硝酸中
制备
B
将密闭烧瓶中的 降温
探究温度对平衡移动的影响
C
将溴水滴入 溶液中,加入乙醇并振荡
萃取溶液中生成的碘
D
实验结束,将剩余 固体放回原试剂瓶
节约试剂
A、A B、B C、C D、D7. 实验室制备下列气体的方法可行的是( )气体
方法
A
氨气
加热氯化铵固体
B
二氧化氮
将铝片加到冷浓硝酸中
C
硫化氢
向硫化钠固体滴加浓硫酸
D
氧气
加热氯酸钾和二氧化锰的混合物
A、A B、B C、C D、D8. 关于非金属含氧酸及其盐的性质,下列说法正确的是( )A、浓H2SO4具有强吸水性,能吸收糖类化合物中的水分并使其炭化 B、NaClO、KClO3等氯的含氧酸盐的氧化性会随溶液的pH减小而增强 C、加热NaI与浓H3PO4混合物可制备HI,说明H3PO4比HI酸性强 D、浓HNO3和稀HNO3与Cu反应的还原产物分别为NO2和NO,故稀HNO3氧化性更强9. BiOCl是一种具有珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图: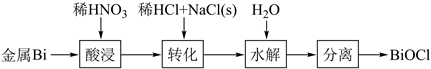
下列说法错误的是( )
A、酸浸工序中分次加入稀HNO3可降低反应剧烈程度 B、转化工序中加入稀HCl可抑制生成BiONO3 C、水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度 D、水解工序中加入少量NH4NO3(s)有利于BiOCl的生成10. 下列过程中的化学反应,相应的离子方程式正确的是( )A、用碳酸钠溶液处理水垢中的硫酸钙: CO32- +CaSO4 =CaCO3 + SO42- B、过量铁粉加入稀硝酸中:Fe + 4H+ + NO3- = Fe3+ +NO↑ +2H2O C、硫酸铝溶液中滴如少量氢氧化钾溶液: Al3+ +4 OH- =AlO2- + 2H2O D、氯化铜溶液中通入硫化氢: Cu2+ + S2- =CuS ↓11. 下列关于元素及其化合物的性质说法不正确的是A、浓硫酸与蔗糖反应,观察到蔗糖变黑,体现了浓硫酸的脱水性 B、硝酸见光受热易分解,一般保存在棕色试剂瓶中,放置在阴凉处 C、燃油发动机产生的、与反应能生成和 , 因此可以直接排放 D、铝制餐具不宜用来蒸煮或长时间存放酸性或者碱性食物12. 下列实验装置正确且能达到相应目的的是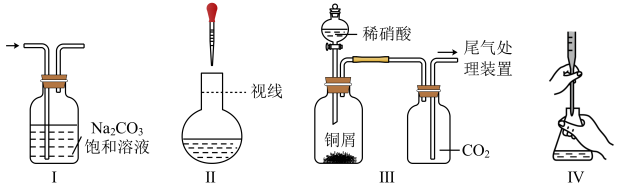 A、图I:除去CO2中的SO2 B、图II:配制一定物质的量浓度的溶液实验中,如图为定容时的操作 C、图III:制备并用排气法收集NO气体的装置(反应装置中已排空气) D、图IV:用氢氧化钠溶液滴定醋酸溶液13. 将铜丝插入浓硝酸中进行如图所示的实验,下列说法正确的是
A、图I:除去CO2中的SO2 B、图II:配制一定物质的量浓度的溶液实验中,如图为定容时的操作 C、图III:制备并用排气法收集NO气体的装置(反应装置中已排空气) D、图IV:用氢氧化钠溶液滴定醋酸溶液13. 将铜丝插入浓硝酸中进行如图所示的实验,下列说法正确的是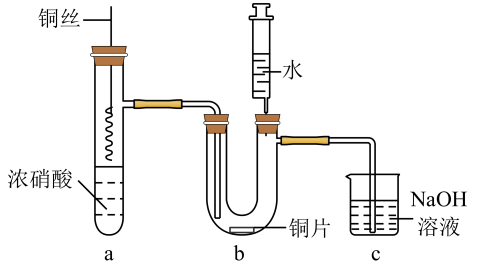 A、装置a中出现红棕色气体,只体现的酸性 B、一段时间后抽出铜丝,向装置b注入水,b中气体红棕色变浅 C、注入水后装置b中铜片表面产生气泡,说明与硝酸生成 D、装置c用吸收尾气,说明和均是酸性氧化物14. 某同学研究浓硝酸与KSCN溶液的反应,在通风橱中进行如下实验:
A、装置a中出现红棕色气体,只体现的酸性 B、一段时间后抽出铜丝,向装置b注入水,b中气体红棕色变浅 C、注入水后装置b中铜片表面产生气泡,说明与硝酸生成 D、装置c用吸收尾气,说明和均是酸性氧化物14. 某同学研究浓硝酸与KSCN溶液的反应,在通风橱中进行如下实验: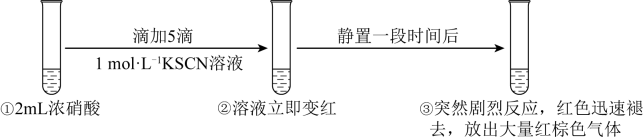
已知:SCN-能被氧化为黄色的(SCN)2 , (SCN)2可聚合为红色的(SCN)x。下列分析错误的是
A、SCN-被氧化为(SCN)2过程中,S的化合价升高 B、分析①②③知,(SCN)2聚合为(SCN)x的速率大于其被硝酸氧化的速率 C、取少量③中的溶液加入BaCl2溶液,产生白色沉淀,证明最终有生成 D、①中改用溶有NO2的浓硝酸重复上述实验,溶液先变红后迅速褪色并产生大量红棕色气体,证明NO2氧化性强于浓硝酸15. 陈述Ⅰ和Ⅱ均正确且具有因果关系的是选项
陈述Ⅰ
陈述Ⅱ
A
用铁槽盛放浓
铁不与浓反应
B
用氢氟酸刻蚀玻璃
能与玻璃中的反应
C
用钾盐作紫色烟花原料
电子跃迁到激发态释放能量,产生紫色光
D
高温还原制备金属K
金属性:
A、A B、B C、C D、D16. 下列物质的性质和用途之间的对应关系正确的是A、沸点低,工业上常用液氨作制冷剂 B、有强氧化性,可用于溶解银 C、溶液显碱性,常作烘焙糕点的膨松剂 D、具有还原性,可用于除去废水中的17. 下列反应既体现硝酸的酸性,又体现硝酸的氧化性的是A、 B、 C、 D、18. 在标准状况下将1.92g铜粉投入一定量浓HNO3中随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混和气体1.12L,则混和气体中NO的体积为A、112mL B、1008mL C、224mL D、448mL19. 下列说法正确的是A、工业上通过电解六水合氯化镁制取金属镁 B、接触法制硫酸时,煅烧黄铁矿以得到三氧化硫 C、浓硝酸与铁在常温下不能反应,所以可用铁质容器贮运浓硝酸 D、“洁厕灵”(主要成分为盐酸)和“84消毒液”(主要成分为次氯酸钠)不能混用20. 根据下列实验操作、现象及所得到的结论正确的是( )选项
实验操作和现象
解释或结论
A
工业上用SiO2与焦炭在高温条件制备粗硅,生成气体CO,得到黑色固体粗硅
非金属性:C>Si
B
将一块用砂纸打磨过的铝条放入试管,再加入98%浓硫酸3mL,铝条表面无明显现象
铝与浓硫酸常温下不反应
C
将稀硝酸加入过量铁粉中,充分反应后再滴加KSCN溶液:有气体生成,溶液不呈血红色
稀硝酸只能将Fe氧化为Fe2+
D
往烧杯中加入约20g研细的Ba(OH)2·8H2O晶体和10gNH4Cl晶体,并将烧杯放在滴有水的玻璃片上,用玻璃棒迅速搅拌;有刺激性气味气体生成,烧杯底部结冰,与玻璃片粘在一起
吸热反应不一定要加热才能进行
A、A B、B C、C D、D21. 有关物质性质的说法正确的是( )A、医学上利用醛基的性质进行血糖检测 B、硝酸中插入铜片,液面上方出现红棕色气体,说明铜与硝酸生成 C、向石蕊溶液中通入氯气,溶液先变红后褪色,证明氯气具有漂白性 D、向酸性高锰酸钾溶液中通入 , 溶液褪色,证明具有漂白性22. 下列物质的贮存方法正确的是( )A、浓硝酸贮存在棕色瓶中 B、金属锂贮存在煤油中 C、NaOH溶液长期贮存在滴瓶中 D、氢氟酸贮存在带玻璃塞的棕色细口瓶中23. 下列说法正确的是( )A、波长为的紫外光的光子能量大于蛋白质中的、、键的键能,因而会灼伤皮肤 B、浓硝酸与碳在加热条件下得到的红棕色气体一定是被碳还原生成的 C、镀锌或镀铜的钢管破损后均会加快钢管的腐蚀 D、硅胶、生石灰、均可用作食品干燥剂24. 下列有关计算正确的是( )A、Na2O2作供氧剂时,每生成5.6 L O2 (标况),转移电子数为0. 25NA B、1.92 g Cu与足量稀硝酸反应,被还原硝酸的物质的量为0.02 mol C、利用铝热反应制备金属时,每得到1 mol Fe,一定消耗0.5 mol氧化剂 D、已知NH3的燃烧热为316.25 kJ/mol,则NH3燃烧的热化学方程式为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-1265 kJ/mol25. 下列有关物质的用途与化学原理具有对应关系的是( )选项
用途
化学原理
A
用氢氟酸雕刻玻璃
氢氟酸显弱酸性
B
用FeCl3溶液蚀刻印刷电路板
FeCl3溶液显酸性
C
用SiO2制造坩埚
SiO2熔点高
D
用HNO3制备硝酸铵
HNO3具有强氧化性
A、A B、B C、C D、D26. 有关浓硝酸与浓硫酸的对比错误的是( )A、在加热条件下都能将碳氧化成二氧化碳 B、常温下都能用铁制或铝制容器盛放 C、长期露置在空气中,溶质质量分数都会变小 D、用蘸有浓氨水的玻璃棒靠近都会有白烟生成27. 下列有关结论正确的是( )A、常温常压下,向冷的浓硫酸中放入纯铜片,没有明显现象,说明铜与浓硫酸发生了钝化 B、将少量通入某NaClO溶液中,有生成,说明该条件下氧化性: C、加热NaCl与浓的混合物可制得HCl,说明H2SO4的酸性比HCl的酸性强 D、浓和稀与Cu反应的还原产物分别为和NO,说明稀的氧化性更强28. 常温下,利用下列试剂能制备对应气体的是( )选项
试剂
制备的气体
A
氯酸钾、浓盐酸
Cl2
B
铜、浓硫酸
SO2
C
浓硫酸、硫化亚铁
H2S
D
稀硝酸、锌
H2
A、A B、B C、C D、D二、非选择题
-
29. 已知A、B、C、D、E、F六种物质存在如下图所示转化关系(部分生成物和反应条件略去)
 (1)、若A,C均为氧化物
(1)、若A,C均为氧化物①D溶液中滴加KSCN溶液显红色,写出B→D的离子方程式。
②若F是正盐,其水溶液呈碱性,D是一种温室气体,写出E的一条用途。
(2)、若C为人体须臾不可离开的气体,则F的化学式可能为(至少写两种)。(3)、若C是一种白色沉淀,E是引起酸雨的主要气体,则A与反应的化学方程式可能为。30. HNO3是重要的化工原料,浓HNO3与Cu反应的装置如图1所示: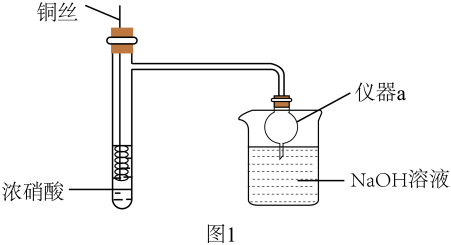
回答下列问题:
(1)、仪器a的名称是 , 在该实验中的作用为。(2)、关于该实验下列说法错误的是_______。A、该反应需要加热才能进行 B、可通过抽动铜丝控制反应开始和停止 C、反应后迅速生成大量红棕色气体 D、烧杯中仅发生中和反应(3)、某小组同学发现Cu与浓HNO3反应所得混合溶液为绿色,Cu与稀HNO3反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。【提出猜想】
猜想a:Cu(NO3)2浓度大
猜想b:NO2溶解在Cu(NO3)2溶液中
【实验验证】
实验i:配制饱和Cu(NO3)2溶液,溶液呈色,证明猜想a不成立。
实验ii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到 , 5min后,溶液完全变为蓝色,证明猜想b成立。
 (4)、另一组同学查阅资料发现:NO2能与水反应生成HNO2 , 进而发生下述反应:
(4)、另一组同学查阅资料发现:NO2能与水反应生成HNO2 , 进而发生下述反应:①由此该组同学认为通过实验说明猜想b成立不严谨,理由是。
②写出NO2与水反应生成HNO2的化学方程式。
③该组同学改进后设计了新的实验:
实验iii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。对比实验ii与实验iii,可推测Cu(NO3)2溶液为绿色的原因主要是。