高考二轮复习知识点:铵盐
试卷更新日期:2023-07-28 类型:二轮复习
一、选择题
-
1. 下列有关物质的性质与用途具有对应关系的是( )A、SO2具有氧化性,可用于漂白纸浆 B、NH4HCO3受热易分解,可用作氮肥 C、Fe2(SO4)3易溶于水,可用作净水剂 D、Al2O3熔点高,可用作耐高温材料2. 下列化肥与熟石灰研磨有刺激性气味的是( )A、NH4Cl B、KNO3 C、NaNO3 D、CO(NH2)23. 氨、氮、硫的化合物应用广泛。ClO2(分子空间填充模型为
 )。NaClO等含氯消毒剂可用于杀菌消毒。人工固氮可将N2转化为NH3 , 再进一步制备肼(N2H4)、硝酸、铵盐等化合物,肼和偏二甲肼(C2H8N2)常用作火箭燃料,肼的燃烧热为622.08 kJ·mol-1 , H2S可除去废水中Hg2+等重金属禹子,H2S 水溶液在空气中会缓慢氧化生成S而变诨浊。下列物质的性质与用途具有对应关系的是 A、H2S具有还原性,可除去废水中的Hg2+ B、HNO3具有强氧化性,可用于制NH4NO3 C、NH4Cl溶液呈酸性,可用于去除铁锈 D、NaClO 溶液呈碱性,可用于杀菌消毒4. 下列说法中正确的是( )A、吸热反应一定需要加热才能反应,而放热反应在常温下一定能进行 B、水银和生铁都属于纯金属 C、用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有 D、某硫酸铵肥料中只含一种杂质,氮元素的质量分数为20%,可能混有硝酸铵5. 下列有关物质的性质与用途具有对应关系的是( )A、铵盐都能与碱发生反应,可用作化肥 B、Al2O3具有两性,可用于电解冶炼铝 C、稀硫酸具有酸性,可用于除去铁锈 D、次氯酸见光易分解,可用作棉、麻和纸张的漂白剂6. 下列方案设计、现象和结论都正确的是( )
)。NaClO等含氯消毒剂可用于杀菌消毒。人工固氮可将N2转化为NH3 , 再进一步制备肼(N2H4)、硝酸、铵盐等化合物,肼和偏二甲肼(C2H8N2)常用作火箭燃料,肼的燃烧热为622.08 kJ·mol-1 , H2S可除去废水中Hg2+等重金属禹子,H2S 水溶液在空气中会缓慢氧化生成S而变诨浊。下列物质的性质与用途具有对应关系的是 A、H2S具有还原性,可除去废水中的Hg2+ B、HNO3具有强氧化性,可用于制NH4NO3 C、NH4Cl溶液呈酸性,可用于去除铁锈 D、NaClO 溶液呈碱性,可用于杀菌消毒4. 下列说法中正确的是( )A、吸热反应一定需要加热才能反应,而放热反应在常温下一定能进行 B、水银和生铁都属于纯金属 C、用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有 D、某硫酸铵肥料中只含一种杂质,氮元素的质量分数为20%,可能混有硝酸铵5. 下列有关物质的性质与用途具有对应关系的是( )A、铵盐都能与碱发生反应,可用作化肥 B、Al2O3具有两性,可用于电解冶炼铝 C、稀硫酸具有酸性,可用于除去铁锈 D、次氯酸见光易分解,可用作棉、麻和纸张的漂白剂6. 下列方案设计、现象和结论都正确的是( )目的
方案设计
现象和结论
A
验证分子中的碳碳双键
取样与适量溴水混合,充分反应,观察现象
溴水褪色,说明样品分子中含有碳碳双键
B
检验淀粉水解是否完全
将适量样品与稀硫酸反应,加入足量溶液后加入碘水,观察现象
无明显现象,说明淀粉水解完全
C
检验牙膏中的摩擦剂成分
取少量牙膏于试管中,加水溶解,滤渣中滴加足量盐酸
若滤渣溶解并产生无色气泡,则摩擦剂可能为
D
检验某固体是否为铵盐
取样品于试管中,滴加少量溶液并加热,用湿润的红色石蕊试纸靠近试管口
若试纸不变蓝色,则固体不是铵盐
A、A B、B C、C D、D7. 下列关于物质保存的解释,反应方程式不正确的是( )A、溶液中放入铁粉: B、浓硝酸保存于棕色试剂瓶: C、氮肥保存于阴凉处: D、金属钠保存于煤油中:8. NF3是一种优良的蚀刻气体。HF、F2均可用于制备NF3 , F2制备NF3的反应为4NH3+3F2 NF3+3NH4F.Ka(HF)=6.3×10−4 , Kb(NH3·H2O)=1.8×10−5。下列关于氨和铵盐的说法正确的是( )A、氨气易溶于水,是因为氨分子间能形成氢键 B、NH3和NH 中氮原子的轨道杂化类型不同 C、25 ℃,0.1 mol·L−1 NH4F溶液的pH<7 D、25 ℃,NH3与HNO3反应生成N2和H2O9. 氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-904kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。下列氮及其化合物的性质与用途具有对应关系的是( )A、N2不溶于水,可用作保护气 B、NH3具有还原性,可用作制冷剂 C、KNO3具有氧化性,可用于制黑火药 D、NH4Cl受热易分解,可用于制造化肥10. 室温下,通过下列实验探究NH4HCO3溶液的性质。实验
实验操作
实验现象
1
用pH试纸测定0.1mol·L-1NH4HCO3溶液的pH
pH约为8
2
向0.1mol·L-1NH4HCO3溶液中加入过量0.1mol·L-1Ba(OH)2溶液
析出白色沉淀
3
常温下,将等体积等物质的量浓度NH4HCO3与NaCl溶液混合
析出晶体
4
向0.1mol·L-1NH4HCO3溶液中加入0.1mol·L-1AlCl3溶液
有气泡产生
下列有关说法正确的是( )
A、0.1mol·L-1NH4HCO3溶液中存在c(NH )+c(NH3·H2O)+c(H+)=c(HCO )+c(CO )+c(H2CO3)+c(OH-) B、实验2反应静置后的上层清液中有c(Ba2+)·c(CO )<Ksp(BaCO3) C、实验3静置后的上层清液中有c(H+)+c(NH )>c(OH-)+c(HCO )+2c(CO ) D、实验4中产生的气体是NH311. 氮、磷、砷元素广泛应用于生产生活中,NH3、N2H4、NO、NO2、HNO3等是氮重要的化合物,下列氮及其化合物的性质与用途的对应关系正确的是( )A、氯化铵溶液显酸性,可用作除锈剂 B、氨气具有还原性,可用作致冷剂 C、氮气的化学性质不活泼,可用于合成氨 D、硝酸铵易分解放出气体和大量热,可用作化肥12. NH4HCO3是重要的氮肥。室温下,通过下列实验探究NH4HCO3的性质。实验
实验操作和现象
1
用pH试纸测定0.1mol/LNH4HCO3溶液的pH,测得pH约为8
2
向0.1mol/LNH4HCO3溶液中加入等体积的0.1mol/L的盐酸,有气体放出
3
向0.1mol/LNH4HCO3溶液逐滴加入0.1mol/LNaOH溶液,有刺激性气味气体放出
4
向0.1mol/LNH4HCO3溶液中加入FeSO4溶液,得到白色沉淀
下列说法正确的是( )
A、实验1溶液中:c(HCO )>c(NH ) B、实验2混合后的溶液中:c(NH )+c(NH3·H2O)=c(Cl-) C、实验3产生的气体能使湿润的蓝色石蕊试纸变红 D、实验4发生反应的离子方程式为Fe2++CO =FeCO3↓13. 化学知识无处不在,下列家务劳动涉及的化学知识错误的是( )选项
家务劳动
化学知识
A
将切过咸菜的钢制刀具洗净并擦干
减缓钢铁的电化学锈蚀
B
给花木施肥时,草木灰不与硝酸铵共施
草木灰与硝酸铵反应造成肥效降低
C
用温热的纯碱溶液清洗厨具油污
油脂在热的纯碱溶液中更易发生水解
D
用富含淀粉的谷物酿酒
淀粉水解为葡萄糖后再氧化为乙醇
A、A B、B C、C D、D14. 对下列中学化学常见实验装置的判断正确的是( ) A、甲装置可用来探究碳酸氢钠受热是否发生分解反应 B、乙装置中一段时间后,铁钉被腐蚀,红墨水向右移动 C、丙装置中溶液a为溴水或Na2S溶液,均可验证SO2具有还原性 D、丁装置在圆底烧瓶中加入苯、铁粉、溴水,用于制备溴苯15. 化学与生活、生产密切相关,下列说法错误的是( )A、煤的气化、液化和干馏都属于化学变化 B、地沟油不宜食用,但可分馏提取汽油 C、棉花的主要成分是纤维素,纤维素由碳、氢、氧元素组成 D、硝酸铵用于制备医用速冷冰袋,是利用了其溶于水快速吸热的性质16. 以197g六氨合氯化镁为原料,经酸化、碳化、热解、过滤、干燥制得932g碱式碳酸镁产品,同时获取副产物CO2 26.88L(标准状况)。原理如下(假定每步反应都没有损耗; x、y、z的最简整数比为x:y:z)。
A、甲装置可用来探究碳酸氢钠受热是否发生分解反应 B、乙装置中一段时间后,铁钉被腐蚀,红墨水向右移动 C、丙装置中溶液a为溴水或Na2S溶液,均可验证SO2具有还原性 D、丁装置在圆底烧瓶中加入苯、铁粉、溴水,用于制备溴苯15. 化学与生活、生产密切相关,下列说法错误的是( )A、煤的气化、液化和干馏都属于化学变化 B、地沟油不宜食用,但可分馏提取汽油 C、棉花的主要成分是纤维素,纤维素由碳、氢、氧元素组成 D、硝酸铵用于制备医用速冷冰袋,是利用了其溶于水快速吸热的性质16. 以197g六氨合氯化镁为原料,经酸化、碳化、热解、过滤、干燥制得932g碱式碳酸镁产品,同时获取副产物CO2 26.88L(标准状况)。原理如下(假定每步反应都没有损耗; x、y、z的最简整数比为x:y:z)。酸化反应:MgCl2·6NH3+6HCl=MgCl2+6NH4Cl;
碳化反应:MgCl2+2NH4HCO3=Mg(HCO3)2+2NH4Cl;
热解反应:Mg(HCO3)2→xMgCO3·yMg(OH)2·zH2O↓+CO2↑(未配平)。
下列说法正确的是( )
A、xMgCO3·yMg(OH)2·zH2O属于混合物 B、x=z=2 C、y=1 D、副产物NH4Cl可用作化肥,也可用热分解法制备氨气17. 用下列实验装置进行相应实验,能达到实验目的的是( ) A、用装置I过滤海带灰的浸泡液以获得含I-的溶液 B、用装置II蒸干氯化铵饱和溶液制备NH4Cl晶体 C、用装置III收集铜粉与稀硝酸反应产生的NO D、用图IV所示装置控制制取少量纯净的CO2气体18. 中华传统文化中蕴含着很多化学知识,下列说法正确的是( )A、“煮豆燃豆萁,豆在釜中泣”中“豆萁”的主要成分纤维素在人体内最终水解为葡萄糖 B、“薪柴之灰,令人以灰淋汁,取碱浣衣”,“薪柴之灰”不可与铵态氮肥混合施用 C、“火药乃焰硝、硫黄、杉木炭所合”,火药发生爆炸时,生成无色的SO2、NO2和CO2 D、“白墙黛瓦马头墙,回廊挂落花格窗”中“黛瓦”的青黑色是因为含有氧化铁的缘故19. 已知碳酸氢铵是一种常用氨肥,20℃以下稳定,工业生产NH4HCO3的工艺如图所示,下列说法错误的是( )
A、用装置I过滤海带灰的浸泡液以获得含I-的溶液 B、用装置II蒸干氯化铵饱和溶液制备NH4Cl晶体 C、用装置III收集铜粉与稀硝酸反应产生的NO D、用图IV所示装置控制制取少量纯净的CO2气体18. 中华传统文化中蕴含着很多化学知识,下列说法正确的是( )A、“煮豆燃豆萁,豆在釜中泣”中“豆萁”的主要成分纤维素在人体内最终水解为葡萄糖 B、“薪柴之灰,令人以灰淋汁,取碱浣衣”,“薪柴之灰”不可与铵态氮肥混合施用 C、“火药乃焰硝、硫黄、杉木炭所合”,火药发生爆炸时,生成无色的SO2、NO2和CO2 D、“白墙黛瓦马头墙,回廊挂落花格窗”中“黛瓦”的青黑色是因为含有氧化铁的缘故19. 已知碳酸氢铵是一种常用氨肥,20℃以下稳定,工业生产NH4HCO3的工艺如图所示,下列说法错误的是( )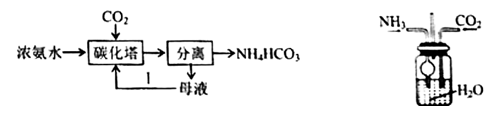 A、碳化塔中充入高压CO2能提高碳化速率 B、分离操作包括加压蒸发、浓缩结晶、趁热过滤 C、设计过程I是为了提高原料的利用率 D、实验室可以用如图装置模拟碳化塔制取少量NH4HCO320. 用如图实验装置进行有关实验,能达到实验目的的是( )
A、碳化塔中充入高压CO2能提高碳化速率 B、分离操作包括加压蒸发、浓缩结晶、趁热过滤 C、设计过程I是为了提高原料的利用率 D、实验室可以用如图装置模拟碳化塔制取少量NH4HCO320. 用如图实验装置进行有关实验,能达到实验目的的是( ) A、用甲装置定量测定化学反应速率 B、用乙装置加热NH4Cl固体制少量氨 C、用丙装置分离甲醇(沸点64.7℃)与水的混合物 D、用丁装置除去溶在CCl4中的Br221. “封管实验”具有简易、方便、节约、绿色等优点,关于如图所示三个“封管实验”(夹持装置未画出)的说法正确的是( )
A、用甲装置定量测定化学反应速率 B、用乙装置加热NH4Cl固体制少量氨 C、用丙装置分离甲醇(沸点64.7℃)与水的混合物 D、用丁装置除去溶在CCl4中的Br221. “封管实验”具有简易、方便、节约、绿色等优点,关于如图所示三个“封管实验”(夹持装置未画出)的说法正确的是( ) A、加热时,①中上部汇集了 固体 B、加热时,②中溶液变红,冷却后又变为无色 C、加热时,③中溶液红色褪去,冷却后溶液变红,体现 的漂白性 D、三个“封管实验”中所发生的化学反应都是可逆反应22. 如图装置实验,下列预期实验现象及结论均正确的是c中为蒸馏水( )
A、加热时,①中上部汇集了 固体 B、加热时,②中溶液变红,冷却后又变为无色 C、加热时,③中溶液红色褪去,冷却后溶液变红,体现 的漂白性 D、三个“封管实验”中所发生的化学反应都是可逆反应22. 如图装置实验,下列预期实验现象及结论均正确的是c中为蒸馏水( )
a
b
预期实验现象
结论
A
铁丝
浓硝酸
试管c中有大量红棕色气体
硝酸有强氧化性
B
木条
浓硫酸
木条变黑
浓硫酸有酸性及氧化性
C
生铁
NaCl溶液
导管处无现象
该实验没有发生反应
D
镁带
NH4Cl溶液
试管c中有无色气体
该无色气体中含有H2
A、A B、B C、C D、D23. 《本草纲目》中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”的记载。下列说法正确的是( )A、“薪柴之灰”与铵态氮肥混合施用可增强肥效 B、“以灰淋汁”的操作是萃取、分液 C、“取碱”得到的是一种碱溶液 D、“浣衣”过程有化学变化24. “封管实验”具有简易、方便、节约、绿色等优点,关于如图所示三个“封管实验”(夹持装置未画出)的说法正确的是( ) A、加热时,①中上部汇集了固体 B、加热时,②中溶液变红,冷却后又变为无色 C、加热时,③中溶液红色褪去,冷却后溶液变红 D、三个“封管实验”中所发生的化学反应都是可逆反应25. 化学与生活密切相关,下列观点错误的是( )A、硝酸铵、液氨可用作制冷剂 B、苏打、小苏打可用作食用面碱 C、二氧化氯、漂白粉可用作自来水的杀菌消毒剂 D、氧化铝、二氧化硅可用作制坩埚26. 侯氏制碱法在我国工业发展中具有重要作用。现某学习小组在实验室中利用下列反应装置模拟侯氏制碱法制备 NaHCO3 , 反应原理为 NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。下列说法正确的是( )
A、加热时,①中上部汇集了固体 B、加热时,②中溶液变红,冷却后又变为无色 C、加热时,③中溶液红色褪去,冷却后溶液变红 D、三个“封管实验”中所发生的化学反应都是可逆反应25. 化学与生活密切相关,下列观点错误的是( )A、硝酸铵、液氨可用作制冷剂 B、苏打、小苏打可用作食用面碱 C、二氧化氯、漂白粉可用作自来水的杀菌消毒剂 D、氧化铝、二氧化硅可用作制坩埚26. 侯氏制碱法在我国工业发展中具有重要作用。现某学习小组在实验室中利用下列反应装置模拟侯氏制碱法制备 NaHCO3 , 反应原理为 NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。下列说法正确的是( ) A、装置 a 中可改用碳酸钙粉末提高反应速率 B、装置 b、d 依次盛装饱和 Na2CO3 溶液、稀硫酸 C、装置 c 中含氨的饱和食盐水提高了 CO2 吸收效率 D、反应后将装置 c 中的锥形瓶充分冷却,蒸发结晶得到 NaHCO3 晶体27. 探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论错误的是( )
A、装置 a 中可改用碳酸钙粉末提高反应速率 B、装置 b、d 依次盛装饱和 Na2CO3 溶液、稀硫酸 C、装置 c 中含氨的饱和食盐水提高了 CO2 吸收效率 D、反应后将装置 c 中的锥形瓶充分冷却,蒸发结晶得到 NaHCO3 晶体27. 探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论错误的是( ) A、将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水 B、将pH=11的氨水稀释1000倍,测得pH > 8,说明NH3·H2O为弱碱 C、加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定 D、将红热的Pt丝伸入上图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO228. 关于NH4NO3的说法正确的是( )A、属于共价化合物 B、溶于水放热 C、既属于铵态氮肥也属于硝态氮肥 D、属于弱电解质29. 下列实验方案中,能达到相应实验目的的是( )
A、将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水 B、将pH=11的氨水稀释1000倍,测得pH > 8,说明NH3·H2O为弱碱 C、加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定 D、将红热的Pt丝伸入上图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO228. 关于NH4NO3的说法正确的是( )A、属于共价化合物 B、溶于水放热 C、既属于铵态氮肥也属于硝态氮肥 D、属于弱电解质29. 下列实验方案中,能达到相应实验目的的是( )选项
A
B
C
D
目的
验证锌与硫酸铜反应过程中有电子转移
探究亚硝酸钠的氧化性
实验室制备乙酸乙酯
实验室制备氨气
实验方案



 A、A B、B C、C D、D30. 下列根据实验操作和现象所得出的结论正确的是( )
A、A B、B C、C D、D30. 下列根据实验操作和现象所得出的结论正确的是( )选项
实验操作
实验现象
结论
A
蘸有浓氨水的玻璃棒靠近溶液X
有白烟产生
溶液X一定是浓盐酸
B
用玻璃棒蘸取溶液Y进行焰色反应实验
火焰呈黄色
溶液Y中一定含Na+
C
向Fe(NO3)2溶液中滴加硫酸酸化的H2O2溶液
溶液变黄
氧化性:H2O2>Fe3+
D
用煮沸过的蒸馏水将Na2SO3固体样品溶解,加稀盐酸酸化,再加入氯化钡溶液
有白色沉淀产生
Na2SO3样品中含有SO42-
A、A B、B C、C D、D二、非选择题
-
31. 高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,也可以做氧化剂、分析试剂等。实验室可由NaClO3等原料制取高氯酸铵(部分物质溶解度如图),其实验流程如图:

已知:氯酸钠受热分解生成高氯酸钠和氯化钠。
(1)、根据如下溶解度与温度的关系图像推测,80℃时浸取液冷却至0℃过滤,滤渣的主要成分为(写化学式)。反应器中加入氯化铵饱和溶液,然后加热并搅拌使其充分反应,反应的化学方程式为。若氯化铵用氨气和浓盐酸代替上述反应,则无需加热反应就能进行,其原因是。 (2)、反应得到的混合液中NH4ClO4和NaCl的质量分数分别为0.40和0.20。根据溶解度与温度的关系图像,从混合溶液中获得较多NH4ClO4晶体的实验操作依次为、(均填实验操作名称)、过滤、冷水洗涤、干燥,冷水洗涤的作用是。(3)、已知NH4ClO4在400℃时开始分解,某课题组设计实验探究NH4ClO4的分解产物(假设装置内的药品均足量)。甲同学设计如图实验(部分夹持装置已省略):
(2)、反应得到的混合液中NH4ClO4和NaCl的质量分数分别为0.40和0.20。根据溶解度与温度的关系图像,从混合溶液中获得较多NH4ClO4晶体的实验操作依次为、(均填实验操作名称)、过滤、冷水洗涤、干燥,冷水洗涤的作用是。(3)、已知NH4ClO4在400℃时开始分解,某课题组设计实验探究NH4ClO4的分解产物(假设装置内的药品均足量)。甲同学设计如图实验(部分夹持装置已省略):
①若高氯酸铵分解有氯气生成,则可能观察到C中的现象是 , 写出产生该现象的离子方程式。
②通过查阅资料:NH4ClO4在加热分解时还产生了一种使带火星木条复燃的气体。写出高氯酸铵分解的化学方程式。实验完毕后,取出E处硬质玻璃管中固体于试管中,滴加蒸馏水,产生的气体R能使湿润的红色石蕊试纸变蓝,R的电子式为。