高考二轮复习知识点:氮气的化学性质
试卷更新日期:2023-07-28 类型:二轮复习
一、非选择题
-
1. 磁性材料在很多领域具有应用前景,其制备过程如下(各步均在 氛围中进行):
①称取 ,配成 溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入 溶液。
③持续磁力搅拌,将 溶液以 的速度全部滴入三颈烧瓶中,100℃下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在 干燥。
⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:

回答下列问题:
(1)、仪器a的名称是;使用恒压滴液漏斗的原因是。(2)、实验室制取 有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和装置,选出一种可行的方法,化学方程式为 , 对应的装置为(填标号)。可供选择的试剂: 、 、 、 、饱和 、饱和
可供选择的发生装置(净化装置略去):
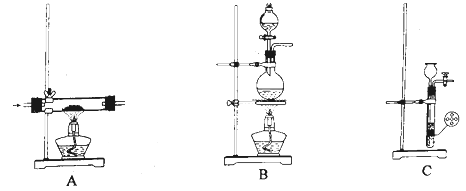 (3)、三颈烧瓶中反应生成了Fe和 ,离子方程式为。(4)、为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。A、采用适宜的滴液速度 B、用盐酸代替KOH溶液,抑制 水解 C、在空气氛围中制备 D、选择适宜的焙烧温度(5)、步骤④中判断沉淀是否已经用水洗涤干净,应选择的试剂为;使用乙醇洗涤的目的是。(6)、该实验所得磁性材料的产率为(保留3位有效数字)。2. 合成NH3是重要的研究课题,一种合成NH3的流程示意如图。
(3)、三颈烧瓶中反应生成了Fe和 ,离子方程式为。(4)、为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。A、采用适宜的滴液速度 B、用盐酸代替KOH溶液,抑制 水解 C、在空气氛围中制备 D、选择适宜的焙烧温度(5)、步骤④中判断沉淀是否已经用水洗涤干净,应选择的试剂为;使用乙醇洗涤的目的是。(6)、该实验所得磁性材料的产率为(保留3位有效数字)。2. 合成NH3是重要的研究课题,一种合成NH3的流程示意如图。
相关数据如表:
物质
熔点/℃
沸点/℃
与N2反应温度/℃
分解温度/℃
Mg
649
1090
>300
Mg3N2:>800
已知:Mg3N2溶于水发生反应Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
(1)、I.固氮:从结构上解释N2化学性质稳定的原因。上述固氮反应的化学方程式是。固氮的适宜温度范围是。(填编号)
a.500~600℃ b.700~800℃ c.900~1000℃
(2)、检测固氮作用:向固氮后的产物中加水,(填操作和现象),说明Mg能起到固氮作用。(3)、II.转氨:选用试剂a完成转化。选用H2O进行转化,发现从体系中分离出NH3较困难,若选用HCl气体进行转化,发现能产生NH3 , 且产物MgCl2能直接循环利用,但NH3的收率较低,原因是。
活性炭还原NO2的原理为2NO2(g)+2C(s)N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2N2O4)。实验测得NO2的转化率与时间的关系如图所示:
 (4)、反应达到平衡时CO2的体积分数为 , 混合气体的平均摩尔质量(A)(B)(填“大于”“小于”或“等于”)。(5)、下列能够判断该反应已达到平衡状态的是。(填序号)
(4)、反应达到平衡时CO2的体积分数为 , 混合气体的平均摩尔质量(A)(B)(填“大于”“小于”或“等于”)。(5)、下列能够判断该反应已达到平衡状态的是。(填序号)a.CO2的质量分数保持不变
b.容器中N2与CO2的百分含量之比保持不变
c.2v(逆)(NO2)=V(正)(N2)
d.混合气体的颜色保持不变
3. 某研究性小组为探究NO与Na2O2的反应,设计如图装置:
已知:NO能被酸性高锰酸钾溶液氧化成NO , MnO被还原为Mn2+。
请回答下列问题:
(1)、盛放浓硝酸的仪器名称 , 导管c的作用。(2)、写出装置A中发生反应的化学方程式 , 装置D中NO与酸性KMnO4溶液反应的离子方程式。(3)、若NO与Na2O2发生了反应,装置C中能观察到的实验现象是。有同学提出即使观察到此现象,也无法得出NO是否与Na2O2发生了反应,其理由是。(4)、实验过程中,观察到装置A中的溶液呈绿色,加热该绿色溶液一段时间(不考虑溶液体积变化),溶液的颜色变为蓝色,试分析溶液呈绿色的原因?。(5)、实验结束时,为减少装置中残留的NO对环境的危害,我们可采取的操作是。4. 物质类别和核心元素的化合价是研究元素及其化合物性质的重要工具。下图是氮元素的“价一类”二维图,请回答: (1)、图中的a可以用作火箭氧化剂,其化学式为。(2)、无色的b和红棕色的c均为空气污染物,能造成的环境问题是(任填一种)。工业上可用c生产d,反应的化学方程式为 , 反应中被氧化的氮与被还原的氮的物质的量之比为。生产时的尾气中含有少量的b和c(假设两者的物质的量相等),可将其通入烧碱溶液中加以吸收并生成e,反应的化学方程式为。(3)、实验室可以利用下图装置制取 , 其原理是 , 球形干燥管的作用是 , 其中盛装的是(填物质名称)。
(1)、图中的a可以用作火箭氧化剂,其化学式为。(2)、无色的b和红棕色的c均为空气污染物,能造成的环境问题是(任填一种)。工业上可用c生产d,反应的化学方程式为 , 反应中被氧化的氮与被还原的氮的物质的量之比为。生产时的尾气中含有少量的b和c(假设两者的物质的量相等),可将其通入烧碱溶液中加以吸收并生成e,反应的化学方程式为。(3)、实验室可以利用下图装置制取 , 其原理是 , 球形干燥管的作用是 , 其中盛装的是(填物质名称)。
二、选择题
-
5. 含氮物质种类繁多,例如N2、NH3、N2H4、HN3(酸性与醋酸相当)等。下列有关物质的说法中正确的是A、N2H4中两个氮原子之间有一对共用电子对,故其6个原子可能共平面 B、N2性质不活泼,可作为焊接镁条的保护气 C、N2H4具有还原性,可用于将AgNO3还原为单质Ag D、可向NaN3溶液中通CO2来制备HN36. 植物对氮元素的吸收过程如下,下列说法正确的是A、高温有利于加快过程① B、浇水和松土有利于过程② C、过程③中被还原 D、过程④叫做氮的固定7. 室温下,1体积水能溶解约700体积的NH3。将向下排空气法收集NH3后的试管倒扣在水槽里的水中,观察。对该实验现象的分析正确的是( )
 A、试管内液面上升,证明NH3与H2O发生了反应 B、试管中剩余少量气体,是因为NH3在水中的溶解达到了饱和 C、取试管中少量无色液体于另一试管中,向其中加入酚酞溶液,溶液显红色,原因是:NH3 + H2ONH3·H2ONH+ OH- D、将实验后试管中溶液敞口放置在空气中一段时间,pH会降低,主要是由于NH3被空气中的O2氧化8. 下列说法错误的是( )A、能使酸性溶液变为绿色 B、铁在纯氧中燃烧生成 C、在放电或高温条件下与生成 D、乙烯能使溴的四氯化碳溶液褪色9. 下列有关物质的性质与用途,具有对应关系的是( )A、二氧化硫具有强还原性,可用作漂白纸张 B、氧化镁熔点高,可用作电解冶炼镁的原料 C、氨气分解时吸热,可用作制冷剂 D、氮气常温下化学性质稳定,可用作粮食保护气10. 氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-904kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。下列氮及其化合物的性质与用途具有对应关系的是( )A、N2不溶于水,可用作保护气 B、NH3具有还原性,可用作制冷剂 C、KNO3具有氧化性,可用于制黑火药 D、NH4Cl受热易分解,可用于制造化肥11. 氮、磷、砷元素广泛应用于生产生活中,NH3、N2H4、NO、NO2、HNO3等是氮重要的化合物,下列氮及其化合物的性质与用途的对应关系正确的是( )A、氯化铵溶液显酸性,可用作除锈剂 B、氨气具有还原性,可用作致冷剂 C、氮气的化学性质不活泼,可用于合成氨 D、硝酸铵易分解放出气体和大量热,可用作化肥12. 下列类比合理的是( )A、 与 反应生成碳酸钠,则 与 反应生成亚硫酸钠 B、 含有叁键,化学性质稳定,则 的化学性质也很稳定 C、 与 反应生成 和 ,则 与 反应生成 和 D、 溶解度大于 ,则 溶解度大于13. 用括号中注明的方法分离下列各组混合物,其中正确的是( )A、碘的四氯化碳溶液(分液) B、氢氧化铁胶体和水(过滤) C、 和 (溶解过滤,再蒸发结晶) D、氮气和氧气(蒸馏)14. 下列转化在给定条件下能通过一步反应实现的是( )A、N2 NO2 B、Fe(OH)2 Fe(OH)3 C、S SO3 D、Al2O3 Al(OH)315. 下列有关氨的说法正确的是( )A、 的空间构型为平面三角形 B、 是非电解质 C、 的水溶液不能导电 D、氨催化氧化制硝酸属于氮的固定16. 实验室制取、收集NH3 , 并组装NH3的喷泉实验装置。下列图示装置和原理能达到实验目的的是( )A、制NH3
A、试管内液面上升,证明NH3与H2O发生了反应 B、试管中剩余少量气体,是因为NH3在水中的溶解达到了饱和 C、取试管中少量无色液体于另一试管中,向其中加入酚酞溶液,溶液显红色,原因是:NH3 + H2ONH3·H2ONH+ OH- D、将实验后试管中溶液敞口放置在空气中一段时间,pH会降低,主要是由于NH3被空气中的O2氧化8. 下列说法错误的是( )A、能使酸性溶液变为绿色 B、铁在纯氧中燃烧生成 C、在放电或高温条件下与生成 D、乙烯能使溴的四氯化碳溶液褪色9. 下列有关物质的性质与用途,具有对应关系的是( )A、二氧化硫具有强还原性,可用作漂白纸张 B、氧化镁熔点高,可用作电解冶炼镁的原料 C、氨气分解时吸热,可用作制冷剂 D、氮气常温下化学性质稳定,可用作粮食保护气10. 氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-904kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。下列氮及其化合物的性质与用途具有对应关系的是( )A、N2不溶于水,可用作保护气 B、NH3具有还原性,可用作制冷剂 C、KNO3具有氧化性,可用于制黑火药 D、NH4Cl受热易分解,可用于制造化肥11. 氮、磷、砷元素广泛应用于生产生活中,NH3、N2H4、NO、NO2、HNO3等是氮重要的化合物,下列氮及其化合物的性质与用途的对应关系正确的是( )A、氯化铵溶液显酸性,可用作除锈剂 B、氨气具有还原性,可用作致冷剂 C、氮气的化学性质不活泼,可用于合成氨 D、硝酸铵易分解放出气体和大量热,可用作化肥12. 下列类比合理的是( )A、 与 反应生成碳酸钠,则 与 反应生成亚硫酸钠 B、 含有叁键,化学性质稳定,则 的化学性质也很稳定 C、 与 反应生成 和 ,则 与 反应生成 和 D、 溶解度大于 ,则 溶解度大于13. 用括号中注明的方法分离下列各组混合物,其中正确的是( )A、碘的四氯化碳溶液(分液) B、氢氧化铁胶体和水(过滤) C、 和 (溶解过滤,再蒸发结晶) D、氮气和氧气(蒸馏)14. 下列转化在给定条件下能通过一步反应实现的是( )A、N2 NO2 B、Fe(OH)2 Fe(OH)3 C、S SO3 D、Al2O3 Al(OH)315. 下列有关氨的说法正确的是( )A、 的空间构型为平面三角形 B、 是非电解质 C、 的水溶液不能导电 D、氨催化氧化制硝酸属于氮的固定16. 实验室制取、收集NH3 , 并组装NH3的喷泉实验装置。下列图示装置和原理能达到实验目的的是( )A、制NH3 B、干燥NH3
B、干燥NH3 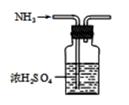 C、收集NH3
C、收集NH3  D、喷泉实验装置
D、喷泉实验装置  17. 侯氏制碱法在我国工业发展中具有重要作用。现某学习小组在实验室中利用下列反应装置模拟侯氏制碱法制备 NaHCO3 , 反应原理为 NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。下列说法正确的是( )
17. 侯氏制碱法在我国工业发展中具有重要作用。现某学习小组在实验室中利用下列反应装置模拟侯氏制碱法制备 NaHCO3 , 反应原理为 NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。下列说法正确的是( ) A、装置 a 中可改用碳酸钙粉末提高反应速率 B、装置 b、d 依次盛装饱和 Na2CO3 溶液、稀硫酸 C、装置 c 中含氨的饱和食盐水提高了 CO2 吸收效率 D、反应后将装置 c 中的锥形瓶充分冷却,蒸发结晶得到 NaHCO3 晶体18. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、HCl(aq) Cl2(g) FeCl2(s) B、Cu(OH)2(s) CuO(s) CuSO4(aq) C、N2(g) NH3(g) NH4NO3(s) D、Al2O3(s) AlCl3(aq) AlCl3(s)19. 下列有关化学反应的叙述正确的是( )A、SO2与Ba(NO3)2反应生成BaSO3 B、NH3在纯O2中燃烧生成NO2 C、过量CO2与氨水反应生成NH4HCO3 D、高温条件下Fe与水蒸气反应生成Fe(OH)3和H220. 下列关于氮及其化合物的说法,错误的是( )A、工业上可使用液氨作制冷剂 B、少量一氧化氮可防止血管栓塞 C、铵态氮肥宜与草木灰(主要成分为K2CO3)混合使用 D、硝酸可用于制造TNT、硝化甘油和硝化纤维21. 下列关于氮及其化合物的说法,错误的是( )A、铵盐一般都溶于水,且都可分解放出氨气 B、液氨气化时会吸收大量的热,所以NH3可用作制冷剂 C、汽车尾气中的氮氧化物是造成光化学烟雾的主要原因之一 D、工业浓硝酸通常呈黄色,是因为溶解了NO2气体22. 农业上有一句俗语“雷雨发庄稼”,该过程中不会涉及到的化学反应是( )A、N2+O2 2NO B、2NO+O2 → 2NO2 C、4NH3+5O2 4NO + 6H2O D、3NO2+H2O → 2HNO3+NO23. 由下列实验及现象不能推出相应结论的是( )
A、装置 a 中可改用碳酸钙粉末提高反应速率 B、装置 b、d 依次盛装饱和 Na2CO3 溶液、稀硫酸 C、装置 c 中含氨的饱和食盐水提高了 CO2 吸收效率 D、反应后将装置 c 中的锥形瓶充分冷却,蒸发结晶得到 NaHCO3 晶体18. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、HCl(aq) Cl2(g) FeCl2(s) B、Cu(OH)2(s) CuO(s) CuSO4(aq) C、N2(g) NH3(g) NH4NO3(s) D、Al2O3(s) AlCl3(aq) AlCl3(s)19. 下列有关化学反应的叙述正确的是( )A、SO2与Ba(NO3)2反应生成BaSO3 B、NH3在纯O2中燃烧生成NO2 C、过量CO2与氨水反应生成NH4HCO3 D、高温条件下Fe与水蒸气反应生成Fe(OH)3和H220. 下列关于氮及其化合物的说法,错误的是( )A、工业上可使用液氨作制冷剂 B、少量一氧化氮可防止血管栓塞 C、铵态氮肥宜与草木灰(主要成分为K2CO3)混合使用 D、硝酸可用于制造TNT、硝化甘油和硝化纤维21. 下列关于氮及其化合物的说法,错误的是( )A、铵盐一般都溶于水,且都可分解放出氨气 B、液氨气化时会吸收大量的热,所以NH3可用作制冷剂 C、汽车尾气中的氮氧化物是造成光化学烟雾的主要原因之一 D、工业浓硝酸通常呈黄色,是因为溶解了NO2气体22. 农业上有一句俗语“雷雨发庄稼”,该过程中不会涉及到的化学反应是( )A、N2+O2 2NO B、2NO+O2 → 2NO2 C、4NH3+5O2 4NO + 6H2O D、3NO2+H2O → 2HNO3+NO23. 由下列实验及现象不能推出相应结论的是( )选项
实验
现象
结论
A
将镁条点燃后迅速伸入充满N2的集气瓶中
集气瓶内有黄绿色粉末产生
N2具有氧化性
B
向2mLNa2S稀溶液中滴加0.1mol/LZnSO4溶液至不再有白色沉淀产生,然后再往上述溶液中滴加0.1mol/LCuSO4溶液
沉淀由白色变为黑色
Ksp(ZnS)>Ksp(CuS)
C
将镁片和铝片分别打磨后,用导线连接再插入NaOH溶液中
片刻后镁片上有大量气泡产生,铝片上产生的气泡很少
镁为电池正极
D
将装有CuCl2∙2H2O晶体的试管加热,在试管口放置湿润的蓝色石蕊试纸
试纸变为红色
CuCl2显酸性
A、A B、B C、C D、D24. 下列说法正确的是( )A、Na2O2 在空气中久置,因分解成 Na2O 和 O2 而变成白色固体 B、明矾溶于水能形成胶体,可用于自来水的杀菌消毒 C、电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法 D、氮气化学性质稳定,可将炽热的镁粉放在氮气中冷却25. 亚硝酸钠(NaNO2)是一种常用的发色剂和防腐剂,某学习小组利用如图装置(夹持装置略去)制取亚硝酸钠,已知:2NO+Na2O2=2NaNO2 , 2NO2+Na2O2=2NaNO3;NO能被酸性高锰酸钾氧化为NO3-。下列说法正确的是( )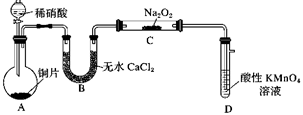 A、可将B中的药品换为浓硫酸 B、实验开始前通一段时间CO2 , 可制得比较纯净的NaNO2 C、开始滴加稀硝酸时,A中会有少量红棕色气体 D、装置D中溶液完全褪色后再停止滴加稀硝酸26. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、27. 利用如图所示装置进行下列实验,将X溶液逐滴加入固体Y中,装置B的试管中的现象错误的是( )
A、可将B中的药品换为浓硫酸 B、实验开始前通一段时间CO2 , 可制得比较纯净的NaNO2 C、开始滴加稀硝酸时,A中会有少量红棕色气体 D、装置D中溶液完全褪色后再停止滴加稀硝酸26. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、27. 利用如图所示装置进行下列实验,将X溶液逐滴加入固体Y中,装置B的试管中的现象错误的是( )选项
X溶液
固体Y
Z溶液
现象

A
稀硫酸
亚硫酸钠
品红试液
品红褪色
B
浓氨水
CaO
紫色石蕊试液
溶液变红
C
盐酸
石灰石
硅酸钠溶液
出现白色沉淀
D
双氧水
MnO2
氢硫酸溶液
产生浑浊
A、A B、B C、C D、D