高考二轮复习知识点:氮族元素简介
试卷更新日期:2023-07-28 类型:二轮复习
一、非选择题
-
1. 烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
Ⅰ.采样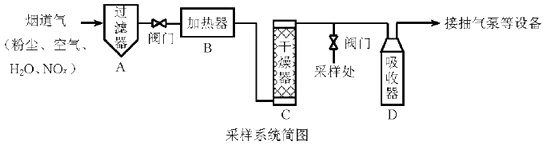
采样步骤:
①检验系统气密性;②加热器将烟道气加热至140℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。(1)、A中装有无碱玻璃棉,其作用是。(2)、C中填充的干燥剂是(填序号)。a.碱石灰
b.无水CuSO4
c.P2O5
(3)、用实验室常用仪器组装一套装置,其作用是与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。 (4)、采样步骤②加热烟道气的目的是。(5)、Ⅱ.NOx含量的测定
(4)、采样步骤②加热烟道气的目的是。(5)、Ⅱ.NOx含量的测定将v L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3− , 加水稀释至100.00 mL。量取20.00 mL该溶液,加入v1 mL c1 mol·L−1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L−1 K2Cr2O7标准溶液滴定剩余的Fe2+ , 终点时消耗v2 mL。
NO被H2O2氧化为NO3−的离子方程式是。
(6)、滴定操作使用的玻璃仪器主要有。(7)、滴定过程中发生下列反应:3Fe2++NO3−+4H+=NO↑+3Fe3++2H2O
Cr2O72−+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O
则气样中NOx折合成NO2的含量为mg·m−3。
(8)、判断下列情况对NOx含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”)若缺少采样步骤③,会使测试结果。
若FeSO4标准溶液部分变质,会使测定结果。
2. 饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在.(1)、砷与磷为同一主族元素,磷的原子结构示意图为 .(2)、根据元素周期律,下列说法正确的是 .a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)、关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3 , 同时生成SO42﹣ , 导致砷脱离矿体进入地下水.FeS2被O2氧化的离子方程式为 .(4)、去除水体中的砷,可先将As(Ⅲ)转化为As(Ⅴ),选用NaClO可实现该转化.研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果: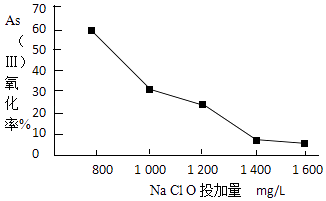
已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是 .
(5)、强阴离子交换柱可以吸附以阴离子形态存在的As(Ⅴ)达到去除As的目的.已知:一定条件下,As(Ⅴ)的存在形式如表所示:
pH
<2
2~7
7~11
11~14
存在形式
H3AsO4
H2AsO3﹣
HAsO42﹣
HAsO42﹣、AsO43﹣
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是 .
3. 氮是生命物质的重要组成元素之一,含氮物质与人类的生活密切相关.(1)、氮原子最外层电子排布式为:;氮离子(N3﹣)核外有种运动状态不同的电子;N4分子的空间结构如图: ,它是一种分子.(填“极性”或“非极性”) (2)、氨气是人工固氮的产物,它极易溶于水(1:700),生成NH3•H2O.请设计实验证明NH3•H2O是弱碱 .(3)、向100mL 0.1mol/L的盐酸中通入0.02mol氨气,充分吸收后测得溶液呈碱性.则该溶液中NH3•H2O、NH4+、Cl﹣三种微粒的物质的量浓度大小关系为 .(4)、铵盐可用作氮肥,实验室检验铵盐中的NH4+时,可取少量铵盐样品于试管中,加入强碱浓溶液,加热,若产生的气体能使 , 说明有NH4+ .(5)、NaN3可用于制造汽车安全气囊,当汽车遇到撞击时,NaN3能迅速分解产生Na和N2 . 请写出该反应的化学方程式 , 每生成3mol N2时,转移电子 mol.4. 磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性元件。(1)、基态铜原子的电子排布式为;高温时氧化铜会转化为氧化亚铜,原因是。(2)、元素周期表第3周期中,第一电离能比P小的非金属元素是(填元素符号)。(3)、N、P、As同主族,三种元素最简单氢化物沸点由低到高的顺序为 , 原因是。(4)、某直链多磷酸钠的阴离子呈如图1所示的无限单链状结构,其中磷氧四面体通过共用顶点的氧原子相连,则P原子的杂化方式为 , 该多磷酸钠的化学式为。
,它是一种分子.(填“极性”或“非极性”) (2)、氨气是人工固氮的产物,它极易溶于水(1:700),生成NH3•H2O.请设计实验证明NH3•H2O是弱碱 .(3)、向100mL 0.1mol/L的盐酸中通入0.02mol氨气,充分吸收后测得溶液呈碱性.则该溶液中NH3•H2O、NH4+、Cl﹣三种微粒的物质的量浓度大小关系为 .(4)、铵盐可用作氮肥,实验室检验铵盐中的NH4+时,可取少量铵盐样品于试管中,加入强碱浓溶液,加热,若产生的气体能使 , 说明有NH4+ .(5)、NaN3可用于制造汽车安全气囊,当汽车遇到撞击时,NaN3能迅速分解产生Na和N2 . 请写出该反应的化学方程式 , 每生成3mol N2时,转移电子 mol.4. 磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性元件。(1)、基态铜原子的电子排布式为;高温时氧化铜会转化为氧化亚铜,原因是。(2)、元素周期表第3周期中,第一电离能比P小的非金属元素是(填元素符号)。(3)、N、P、As同主族,三种元素最简单氢化物沸点由低到高的顺序为 , 原因是。(4)、某直链多磷酸钠的阴离子呈如图1所示的无限单链状结构,其中磷氧四面体通过共用顶点的氧原子相连,则P原子的杂化方式为 , 该多磷酸钠的化学式为。图1
 图2
图2  (5)、某磷青铜晶胞结构如图2所示。
(5)、某磷青铜晶胞结构如图2所示。①则其化学式为。
②该晶体中距离Sn原子最近的Cu原子有个。
③若晶体密度为8.82g·cm-3 , 最近的Cu原子核间距为pm(用含NA的代数式表示,设NA表示阿伏加德罗常数的值)。
5. 饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在.(1)、砷与磷为同一主族元素,磷的原子结构示意图为 .(2)、根据元素周期律,下列说法正确的是 .a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)、关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3 , 同时生成SO42﹣ , 导致砷脱离矿体进入地下水.FeS2被O2氧化的离子方程式为 .(4)、去除水体中的砷,可先将As(Ⅲ)转化为As(Ⅴ),选用NaClO可实现该转化.研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:
已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是 .
(5)、强阴离子交换柱可以吸附以阴离子形态存在的As(Ⅴ)达到去除As的目的.已知:一定条件下,As(Ⅴ)的存在形式如表所示:
pH
<2
2~7
7~11
11~14
存在形式
H3AsO4
H2AsO3﹣
HAsO42﹣
HAsO42﹣、AsO43﹣
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是 .
6. 氮及其化合物在生活、生产和科技等方面有重要的应用.(1)、写出氮原子的原子结构示意图;(2)、氮氧化物是造成雾霾天气的主要原因之一,利用ClO2和Na2SO3溶液处理氮氧化物的反应过程如下:NO NO2 N2
反应Ⅱ的离子方程式是;
(3)、羟胺(NH2OH)可看成是氨分子内的1个氢原子被羟基取代后的产物,常用作还原剂,其水溶液显弱碱性.①NH2OH的水溶液呈弱碱性的原理与NH3相似,NH2OH的水溶液中主要离子有
(填离子符号).
②某离子化合物的组成元素与NH2OH相同,其水溶液显酸性.该物质是
(填化学式),其溶液中离子浓度由大到小的顺序为 .
(4)、氨水在工业上用作沉淀剂.已知25℃时,Ksp[Fe(OH)3]=1.0×10﹣38 , Ksp[Al(OH)3]=1.0×10﹣32 , 向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水.当溶液中Fe3+和Al3+沉淀完全[c(Fe3+)、C(Al3+)均小于1.0×10﹣5mol•L﹣1]时,调节溶液的pH应略大于 .7. 2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想.运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物.已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键.(1)、该氮氢化合物的电子式为 .(2)、若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,写出该反应的化学方程式 .(3)、NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl.试写出上述氮氢化合物通入足量盐酸时,发生反应的化学方程式 .(4)、氮可以形成多种离子,如N3﹣ , NH2﹣ , N3﹣ , NH4+ , N2H5+ , N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+ , 因此有类似于NH4+的性质.①写出N2H62+在碱性溶液中反应的离子方程式 .
②NH2﹣的电子式为 , N采用杂化方式,粒子空间构型为 .
8. N是重要的非金属元素,尿素、羟胺、硝酸、亚硝酸钠均为重要的含氮化合物.(1)、尿素[CO(NH2)2]是人类利用无机物合成的第一种有机物.①尿素中元素原子半径最大的原子结构示意图为;
②尿素在土壤中的脲酶作用下会水解生成碳酸铵或碳酸氢铵,若与碱性肥料混合施用,会造成氮元素损失,请用离子方程式解释其原因;
③已知:20℃时,H2CO3:Ka1=4.2×10ˉ7、Ka2=5.6×10ˉ11;NH3•H2O:Kb=1.7×10ˉ5 , 碳酸氢铵溶液中HCO3ˉ、NH4+、OHˉ、H+四种离子浓度由大到小的顺序为
(2)、羟胺(NH2OH)可看做是氨分子内的1个氢原子被羟基取代的物质,常用作还原剂.
①利用羟胺的还原性,可以除去含Fe2+中的Fe3+ , 氧化产物是一种性质稳定、无污染的气体,写出反应的离子方程式②制备NH2OH•HCl(盐酸羟胺)的一种工艺流程如图所示:

ⅰ步骤中,发生反应的化学方程式为;
ⅱ步骤中使用的NaNO2外观酷似食盐,误食会中毒.可用电解法将工业废水中少量的NO2ˉ转化为N2以降低其危害.写出NO2ˉ在酸性条件下转化为氮气的电极反应式为 .
9. 如图是氮循环示意图,请回答下列问题.
①自然界中的固氮和人工固氮的共同点是将氮元素由游离态转化为 .
②雷电固氮反应的化学方程式是 , 其中氮元素被(填“氧化”或“还原”).
③根据循环图判断下列说法不正确的是 .
a.氮元素均被氧化
b.工业合成氨属于人工固氮
c.含氮无机物和含氮有机物可相互转化
d.碳、氢、氧三种元素也参与了氮循环.
10.图1为氮及其化合物的类别与化合价对应的关系图.
 (1)、实验室制取氨气.
(1)、实验室制取氨气.①化学方程式是 .
②用水吸收多余的氨气时,如将导管直接插入水中,会产生倒吸现象,产生该现象的原因是 .
(2)、完成下列化学方程式:体现N元素的还原性:a.汽车尾气中产生的NO:N2+O2 2NO.
b.氨的催化氧化: .
(3)、NO2易溶于水.标准状况下将体积为V mL的试管充满NO2后倒扣在水中,见图2.

①NO2溶于水的化学方程式是 .
②使试管中NO2恰好完全被水吸收需要缓慢通入氧气,通入标准状况下氧气的体积为 . 最终试管中所的硝酸的物质的量浓度为 .
③为了消除NO2的污染,可将它与氨气在催化剂作用下反应,生成水和一种无污染的物质,该物质是空气的主要成分之一,该反应的化学方程式是 .
(4)、写出除掉Fe2O3中的SiO2的离子方程式写出制取漂白粉的化学方程式 .11. 次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:(1)、H3PO2是一元中强酸,写出其电离方程式: .(2)、H3PO2中,磷元素的化合价为 .(3)、NaH2PO2是正盐还是酸式盐?其溶液显性(填弱酸性、中性、或者弱碱性).(4)、H3PO2也可以通过电解的方法制备.工作原理如图所示(阳膜和阴膜分别只允许阳离子,阴离子通过):
①写出阴极的电极反应式 .
②分析产品室可得到H3PO2的原因 .
③早期采用“三室电渗析法”制备H3PO2 , 将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是杂质.该杂质产生的原因是: .
12. 氮元素在自然界中存在多种价态,结合题干回答下列问题:(1)、氮元素原子核外有 个未成对电子,最外层有 种能量不同的电子.(2)、氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是 (填编号).a.NH3比PH3稳定性强
b.氮气与氢气能直接化合,磷与氢气很难直接化合
c.硝酸显强氧化性,磷酸不显强氧化性
d.氮气常温是气体,磷单质是固体
(3)、已知,氯胺NH2Cl熔点﹣66℃,NH4Cl熔点340℃,氯胺的电子式为 , 从物质结构的角度解释两者熔点相差较大的原因(4)、NH2Cl比HClO稳定性高,易水解,因水解后能产生可杀菌消毒的物质而成为饮用水的缓释消毒剂,NH2Cl发生水解的化学方程式为(5)、工业上利用铝粉除去含氮废水中的NO3﹣ , 当控制溶液pH在10.7左右时,反应过程中生成AlO2﹣、氮气和氨气,若氮气和氨气的体积比为4:1,则还原剂和氧化剂的物质的量之比为 ,若氮气和氨气的体积比为1:1,则除去0.1mol NO3﹣ , 消耗铝 g.二、选择题
-
13. 下图是磷酸、亚磷酸、次磷酸的结构式,其中磷酸为三元中强酸,亚磷酸为二元弱酸,则下列说法正确的是( )。
 A、磷酸( )的电离方程式为: B、亚磷酸( )与足量NaOH溶液反应生成 C、 溶液呈酸性,是因为 的水解程度比电离程度大 D、 溶液呈碱性14. 依据图中氮元素及其化合物的转化关系,判断下列说法不正确的是( )
A、磷酸( )的电离方程式为: B、亚磷酸( )与足量NaOH溶液反应生成 C、 溶液呈酸性,是因为 的水解程度比电离程度大 D、 溶液呈碱性14. 依据图中氮元素及其化合物的转化关系,判断下列说法不正确的是( )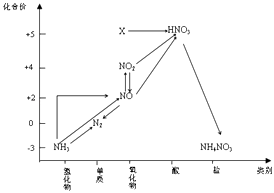 A、X是N2O5 B、可用排空气法收集NO气体 C、工业上以NH3、空气、水为原料生产硝酸 D、由NH3→N2 , 从原理上看,NH3可与NO2反应实现15. 下列有关碳、氮、氧三种元素的单质及其化合物的说法正确的是( )A、与互为等电子体,具有相同的化学键特征,具有相同的化学性质 B、碳、氮、氧三种元素对应的简单氢化物都可以作为配合物的配体 C、碳、氮、氧三种元素对应的简单氢化物中中心原子的杂化方式都是 D、三种离子的模型相同,离子立体构型相同16. 意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,下列说法正确的是( )
A、X是N2O5 B、可用排空气法收集NO气体 C、工业上以NH3、空气、水为原料生产硝酸 D、由NH3→N2 , 从原理上看,NH3可与NO2反应实现15. 下列有关碳、氮、氧三种元素的单质及其化合物的说法正确的是( )A、与互为等电子体,具有相同的化学键特征,具有相同的化学性质 B、碳、氮、氧三种元素对应的简单氢化物都可以作为配合物的配体 C、碳、氮、氧三种元素对应的简单氢化物中中心原子的杂化方式都是 D、三种离子的模型相同,离子立体构型相同16. 意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,下列说法正确的是( ) A、N4属于一种新型化合物 B、N4转化为N2属于物理变化 C、N4的相对分子质量为28 D、N4与N2互为同素异形体17. 部分含氮物质的分类与相应氮元素的化合价关系如图所示。下列说法错误的是( )
A、N4属于一种新型化合物 B、N4转化为N2属于物理变化 C、N4的相对分子质量为28 D、N4与N2互为同素异形体17. 部分含氮物质的分类与相应氮元素的化合价关系如图所示。下列说法错误的是( ) A、N2转化成a或b都属于固氮反应 B、a可用于侯氏制碱法制备纯碱 C、室温下,a与d反应能生成b或N2 D、d的浓溶液与炽热的碳反应可生成c18. 部分含氮物质的类别与相应氮元素的化合价关系如图所示。下列说法正确的是( )
A、N2转化成a或b都属于固氮反应 B、a可用于侯氏制碱法制备纯碱 C、室温下,a与d反应能生成b或N2 D、d的浓溶液与炽热的碳反应可生成c18. 部分含氮物质的类别与相应氮元素的化合价关系如图所示。下列说法正确的是( ) A、a与b在一定条件下可发生反应生成 B、汽车尾气中的b物质是汽油不完全燃烧导致的 C、常温下,金属在c的浓溶液中会钝化 D、室温时,d的水溶液一定呈酸性19. 2019年,我国青年化学家雷晓光被遴选为“青年化学家元素周期表”氮元素的代言人。下列与氮元素有关的说法正确的是( )A、14N与14C互为同位素 B、NH3的热稳定性比HF的强 C、NH3的电子数为10 D、Si3N4中N为+3价20. 汽车在剧烈碰撞后,安全气囊会弹出并充满一种保护气体。该气体在空气中含量最高,其分子式为( )A、O2 B、CO C、N2 D、CO221. 将Li3N固体溶于水中,产生了大量的氨气,下列有关此过程中的说法,正确的是( )A、产生氨气过程无能量变化 B、Li3N中只含有离子键 C、Li3N中含有离子键、共价键 D、产生氨气过程有电子转移22. 关于氮族元素的说法中正确的是( )A、最高正价都是+5价,最低负价都是﹣3价 B、随着原子序数的增大,原子半径逐渐增大 C、单质的熔、沸点随着原子序数的增大而增大 D、所形成的气态氢化物,以BiH3最不稳定23. 下列关于氮及其化合物的说法正确的是( )A、N2分子的结构稳定,因而氮气不能支持任何物质的燃烧 B、液氨汽化时要吸收大量热,因而液氨可用作制冷剂 C、NO可用向上排空气法或者排水法收集 D、浓硝酸保存在棕色瓶内是因为硝酸易挥发24. 固体A的化学式为NH5 , 能跟水反应,它的所有原子的电子层结构都跟与该原子同周期的稀有气体原子一样,则下列说法中,不正确的是( )A、1mol NH5中有5NA个N﹣H键(NA为阿伏加德罗常数) B、NH5中既有共价键、又有离子键,是离子晶体 C、NH5跟水的反应是氧化还原反应 D、NH5跟水反应的化学方程式为:NH5+H2O═NH3•H2O+H2↑25. 已知X、Y、Z、W(含同一元素)有如下所示转化关系,且X能与W发生反应生成一种易溶于水的盐,则X可能是( )X Y Z W.A、N2 B、NO2 C、NH3 D、NO26. 下列关于教材中的各项说法错误的一项是( )A、在化学反应中,反应物转化为生成物的同时,必然发生能量的变化 B、氮肥包括铵态氮肥、硝态氮肥和尿素 C、在书写热化学方程式时应标明反应物及生成物的状态,无需标明反应温度和压强 D、医疗上用的石膏绷带是利用熟石膏与水混合成糊状后很快凝固的性质27. 下列反应属于氮的固定作用的是( )A、N2和H2一定条件下反应制取NH3 B、硝酸工厂用NH3氧化制取NO C、NO和O2反应生成NO2 D、由NH3制碳酸氢铵和硫酸氨28. 如图A~D四种物质均含有同一种元素,A可以是单质也可以是气态氢化物,D是该元素最高价氧化物对应的水化物,则A,B,C,D中共同含有的元素可能是( )
A、a与b在一定条件下可发生反应生成 B、汽车尾气中的b物质是汽油不完全燃烧导致的 C、常温下,金属在c的浓溶液中会钝化 D、室温时,d的水溶液一定呈酸性19. 2019年,我国青年化学家雷晓光被遴选为“青年化学家元素周期表”氮元素的代言人。下列与氮元素有关的说法正确的是( )A、14N与14C互为同位素 B、NH3的热稳定性比HF的强 C、NH3的电子数为10 D、Si3N4中N为+3价20. 汽车在剧烈碰撞后,安全气囊会弹出并充满一种保护气体。该气体在空气中含量最高,其分子式为( )A、O2 B、CO C、N2 D、CO221. 将Li3N固体溶于水中,产生了大量的氨气,下列有关此过程中的说法,正确的是( )A、产生氨气过程无能量变化 B、Li3N中只含有离子键 C、Li3N中含有离子键、共价键 D、产生氨气过程有电子转移22. 关于氮族元素的说法中正确的是( )A、最高正价都是+5价,最低负价都是﹣3价 B、随着原子序数的增大,原子半径逐渐增大 C、单质的熔、沸点随着原子序数的增大而增大 D、所形成的气态氢化物,以BiH3最不稳定23. 下列关于氮及其化合物的说法正确的是( )A、N2分子的结构稳定,因而氮气不能支持任何物质的燃烧 B、液氨汽化时要吸收大量热,因而液氨可用作制冷剂 C、NO可用向上排空气法或者排水法收集 D、浓硝酸保存在棕色瓶内是因为硝酸易挥发24. 固体A的化学式为NH5 , 能跟水反应,它的所有原子的电子层结构都跟与该原子同周期的稀有气体原子一样,则下列说法中,不正确的是( )A、1mol NH5中有5NA个N﹣H键(NA为阿伏加德罗常数) B、NH5中既有共价键、又有离子键,是离子晶体 C、NH5跟水的反应是氧化还原反应 D、NH5跟水反应的化学方程式为:NH5+H2O═NH3•H2O+H2↑25. 已知X、Y、Z、W(含同一元素)有如下所示转化关系,且X能与W发生反应生成一种易溶于水的盐,则X可能是( )X Y Z W.A、N2 B、NO2 C、NH3 D、NO26. 下列关于教材中的各项说法错误的一项是( )A、在化学反应中,反应物转化为生成物的同时,必然发生能量的变化 B、氮肥包括铵态氮肥、硝态氮肥和尿素 C、在书写热化学方程式时应标明反应物及生成物的状态,无需标明反应温度和压强 D、医疗上用的石膏绷带是利用熟石膏与水混合成糊状后很快凝固的性质27. 下列反应属于氮的固定作用的是( )A、N2和H2一定条件下反应制取NH3 B、硝酸工厂用NH3氧化制取NO C、NO和O2反应生成NO2 D、由NH3制碳酸氢铵和硫酸氨28. 如图A~D四种物质均含有同一种元素,A可以是单质也可以是气态氢化物,D是该元素最高价氧化物对应的水化物,则A,B,C,D中共同含有的元素可能是( ) A、氯 B、铁 C、碳 D、氮29. 下列关于自然界中氮循环示意图(如图)的说法错误的是( )
A、氯 B、铁 C、碳 D、氮29. 下列关于自然界中氮循环示意图(如图)的说法错误的是( )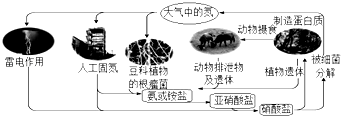 A、氮元素只被氧化 B、豆科植物根瘤菌固氮属于自然固氮 C、其它元素也参与了氮循环 D、含氮无机物和含氮有机物可相互转化
A、氮元素只被氧化 B、豆科植物根瘤菌固氮属于自然固氮 C、其它元素也参与了氮循环 D、含氮无机物和含氮有机物可相互转化三、多选题
-
30. 关于氮的变化关系图如下:

则下列说法正确的是( )
A、路线①②③是工业生产硝酸的主要途径 B、路线ⅠⅡⅢ是雷电固氮生成硝酸的主要途径 C、上述并不是所有反应都是氧化还原反应 D、上述反应中①②③均属于氮的固定