吉林省普通高中友好学校联合体2022-2023学年高一下学期期中联考化学试题
试卷更新日期:2023-07-28 类型:期中考试
一、单选题
-
1. 下列过程中涉及化学能转化为电能的是
A
B
C
D




使用燃料电池驱动新能源汽车
晶体硅太阳能电池提供“绿电”
天然气作为家用燃气蒸煮食品
用电烤箱烘焙面包
A、A B、B C、C D、D2. 下列各组反应中,不属于可逆反应的是A、N2+3H22NH3和2NH3N2+3H2 B、H2+I22HI和2HIH2+I2 C、2H2+O22H2O和2H2O2H2↑+O2↑ D、2SO2+O22SO3和2SO32SO2+O23. 下列反应属于取代反应的是A、CH4+2O2CO2+2H2O B、CH4C+2H2 C、CH4+2Cl2CH2Cl2+2HCl D、Fe+2HCl=FeCl2+H2↑4. 下列化学用语正确的是A、乙烷的电子式: B、甲烷分子的球棍模型:
B、甲烷分子的球棍模型: C、正丁烷的结构式:
C、正丁烷的结构式: D、丙烷分子的空间填充模型:
D、丙烷分子的空间填充模型: 5. 在光照条件下,甲烷与充分反应,得到的生成物中物质的量最多的物质是A、 B、 C、 D、HCI6. 如图是反应的速率(v)和时间(t)关系图,有关叙述错误的是
5. 在光照条件下,甲烷与充分反应,得到的生成物中物质的量最多的物质是A、 B、 C、 D、HCI6. 如图是反应的速率(v)和时间(t)关系图,有关叙述错误的是 A、内,反应依然进行着 B、内,反应处于平衡状态 C、内,不断减小,不断增大 D、内,相等,且不再变化7. 某原电池的总反应为 , 该原电池的正确构成是A、
A、内,反应依然进行着 B、内,反应处于平衡状态 C、内,不断减小,不断增大 D、内,相等,且不再变化7. 某原电池的总反应为 , 该原电池的正确构成是A、 B、
B、 C、
C、 D、
D、 8. 可逆反应A(g)+4B(g)⇌C(g)+D(s),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )A、v(A)=0.15mol/(L·min) B、v(B)=0.02mol/(L·s) C、v(C)=0.4mol/(L·min) D、v(D)=0.01mol/(L·s)9. 已知 4A+5B=2C+6D ,则关于反应速率正确的关系是 ( )A、4v(A)= 5v(B) B、5v(B)=6v(D) C、2v(A)=3v(D) D、2v(B)=5v(C)10. 一定温度下,浓度均为1 mol·L-1的A2和B2两种气体,在密闭容器中反应生成气体C,反应达到平衡后,测得:c(A2)=0.58mol/L,c(B2)=0.16mol/L,c(C)=0.84mol/L。则该反应的正确表达式为A、2A2+B2⇌2C B、A2+B2⇌2C C、A2+B2⇌C D、A2+2B2⇌2C11. 用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气的生成速率增大的是A、加热 B、不用稀硫酸,改用98%浓硫酸 C、滴加少量CuSO4溶液 D、不用铁片,改用铁粉12. “储存”在物质内部的化学能可通过原电池转化为电能,如图所示是某同学设计的几种装置,其中能构成原电池的是( )
8. 可逆反应A(g)+4B(g)⇌C(g)+D(s),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )A、v(A)=0.15mol/(L·min) B、v(B)=0.02mol/(L·s) C、v(C)=0.4mol/(L·min) D、v(D)=0.01mol/(L·s)9. 已知 4A+5B=2C+6D ,则关于反应速率正确的关系是 ( )A、4v(A)= 5v(B) B、5v(B)=6v(D) C、2v(A)=3v(D) D、2v(B)=5v(C)10. 一定温度下,浓度均为1 mol·L-1的A2和B2两种气体,在密闭容器中反应生成气体C,反应达到平衡后,测得:c(A2)=0.58mol/L,c(B2)=0.16mol/L,c(C)=0.84mol/L。则该反应的正确表达式为A、2A2+B2⇌2C B、A2+B2⇌2C C、A2+B2⇌C D、A2+2B2⇌2C11. 用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气的生成速率增大的是A、加热 B、不用稀硫酸,改用98%浓硫酸 C、滴加少量CuSO4溶液 D、不用铁片,改用铁粉12. “储存”在物质内部的化学能可通过原电池转化为电能,如图所示是某同学设计的几种装置,其中能构成原电池的是( )
 A、③⑤⑦ B、③④⑤ C、④⑤⑦ D、②⑤⑥13. X、Y、Z、W四种金属片在稀盐酸中,用导线连接,可以组成原电池,实验结果如图所示:则四种金属的活泼性由强到弱的顺序为
A、③⑤⑦ B、③④⑤ C、④⑤⑦ D、②⑤⑥13. X、Y、Z、W四种金属片在稀盐酸中,用导线连接,可以组成原电池,实验结果如图所示:则四种金属的活泼性由强到弱的顺序为 A、Z>Y>X>W B、Z>X>Y>W C、Z>Y>W>X D、Y>Z>X>W14. 类比推理是重要的学科思想,下列“类比”合理的是A、Fe与S反应生成FeS,则Cu与S反应生成 B、与水反应生成 , 则与水反应生成 C、Cu与浓常温下反应生成 , 则Fe与浓常温下反应生成 D、将蘸有浓氨水和浓盐酸的玻璃棒靠近会产生白烟,则将蘸有浓氨水和浓硫酸的玻璃棒靠近也会产生白烟15. 下列陈述I、II均正确并且有因果关系的是
A、Z>Y>X>W B、Z>X>Y>W C、Z>Y>W>X D、Y>Z>X>W14. 类比推理是重要的学科思想,下列“类比”合理的是A、Fe与S反应生成FeS,则Cu与S反应生成 B、与水反应生成 , 则与水反应生成 C、Cu与浓常温下反应生成 , 则Fe与浓常温下反应生成 D、将蘸有浓氨水和浓盐酸的玻璃棒靠近会产生白烟,则将蘸有浓氨水和浓硫酸的玻璃棒靠近也会产生白烟15. 下列陈述I、II均正确并且有因果关系的是选项
陈述I
陈述II
A
SO2有漂白性
SO2可使酸性高锰酸钾溶液褪色
B
NH3极易溶于水
充满NH3的试管倒置于水槽中,水面迅速上升
C
浓硫酸有强氧化性
浓硫酸可用于干燥H2和CO
D
常温下,铁与浓硫酸发生钝化
常温下,铁与浓硫酸不反应
A、A B、B C、C D、D16. 化学电源在日常生活和高科技领域中都有广泛应用,下列说法不正确的是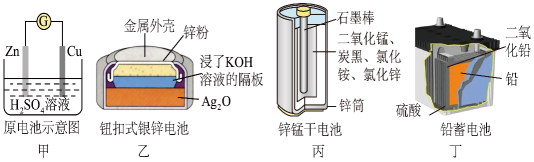 A、乙:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH- B、甲:溶液中Zn2+向Cu电极方向移动,电子由锌经电解质溶液流向铜电极 C、丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降 D、丙:锌筒作负极,发生氧化反应,锌筒会变薄17. 一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是
A、乙:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH- B、甲:溶液中Zn2+向Cu电极方向移动,电子由锌经电解质溶液流向铜电极 C、丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降 D、丙:锌筒作负极,发生氧化反应,锌筒会变薄17. 一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是 A、反应开始到10s,用Z表示的反应速率为0.079 mol/(L•s) B、反应开始到10s,X的物质的量浓度减少了0.79 mol/L C、反应开始到10s时,Y的转化率为39.5% D、反应的化学方程式为:X(g)+Y(g)=Z(g)18. 用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是
A、反应开始到10s,用Z表示的反应速率为0.079 mol/(L•s) B、反应开始到10s,X的物质的量浓度减少了0.79 mol/L C、反应开始到10s时,Y的转化率为39.5% D、反应的化学方程式为:X(g)+Y(g)=Z(g)18. 用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是 A、上下移动①中铜丝可控制SO2的量 B、②中选用品红溶液验证SO2的生成 C、③中选用NaOH溶液吸收多余的SO2 D、为确认CuSO4生成,向①中加水,观察颜色19. 下图为反应:H2(g)+Cl2(g)=2HCl(g)的能量变化示意图,下列说法正确的是
A、上下移动①中铜丝可控制SO2的量 B、②中选用品红溶液验证SO2的生成 C、③中选用NaOH溶液吸收多余的SO2 D、为确认CuSO4生成,向①中加水,观察颜色19. 下图为反应:H2(g)+Cl2(g)=2HCl(g)的能量变化示意图,下列说法正确的是 A、该反应每生成2molHCl,放出183kJ的热量 B、该反应生成液态HCl比生成气态HCl释放的能量少 C、氯气分子中的化学键比氢气分子中的化学键更稳定 D、1 molHCl分子中的化学键形成时吸收431kJ的能量20. 在一密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1 , 当反应达到平衡时,可能存在的数据是A、SO2为0.4 mol·L-1 , O2为0.2 mol·L-1 B、SO2为0.25 mol·L-1 C、SO2、SO3均为0.15 mol·L-1 D、SO3为0.4 mol·L-1
A、该反应每生成2molHCl,放出183kJ的热量 B、该反应生成液态HCl比生成气态HCl释放的能量少 C、氯气分子中的化学键比氢气分子中的化学键更稳定 D、1 molHCl分子中的化学键形成时吸收431kJ的能量20. 在一密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1 , 当反应达到平衡时,可能存在的数据是A、SO2为0.4 mol·L-1 , O2为0.2 mol·L-1 B、SO2为0.25 mol·L-1 C、SO2、SO3均为0.15 mol·L-1 D、SO3为0.4 mol·L-1二、填空题
-
21. 将下列物质进行分类(填序号):
①O2与O3;②与;③H2O和D2O;④冰与干冰;⑤
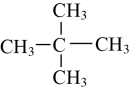 和
和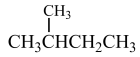 ⑥
⑥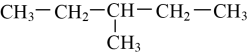 和
和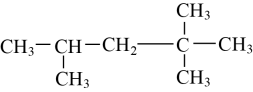 (1)、互为同位素的是;(2)、互为同素异形体的是;(3)、互为同分异构体的是;(4)、属于同系物的是。(5)、属于同一物质的是。22. 观察下面几种链状烷烃的球棍模型
(1)、互为同位素的是;(2)、互为同素异形体的是;(3)、互为同分异构体的是;(4)、属于同系物的是。(5)、属于同一物质的是。22. 观察下面几种链状烷烃的球棍模型
 (1)、①A的结构简式为。
(1)、①A的结构简式为。②B的同分异构体的结构简式为。
③C的分子式为。
④D的名称为。
(2)、上述4种物质的沸点从大到小的排序为(填字母顺序)。(3)、B的一氯取代产物有种同分异构体。(4)、若上述4种物质各为1g,在足量的氧气中燃烧,消耗氧气最多的是(填字母)三、实验题
-
23. 为了探究原电池的工作原理,某研究性学习小组进行了如下实验。(1)、分别按图1中甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。

①以下叙述中正确的是(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向Cu→Zn
D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是。
③在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极(填实验现象),其对应的电极反应式为。
(2)、某氢氧燃料电池装置如图2所示,a、b均为惰性电极。
①电池工作时,空气从(填“A”或“B”)口通入。
②正极上的电极反应式为
(3)、根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是____。A、KOH+HCl=KCl+H2O B、Cu+2Fe3+=2Fe2++Cu2+ C、Na2CO3+2HCl=2NaCl+H2O+CO2↑ D、Mg3N2+6H2O=3Mg(OH)2+2NH3↑四、元素或物质推断题
-
24. 研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价——物质类别关系如图。回答下列问题:
 (1)、在氮的单质和常见的含氮化合物中,常用作保护气的物质是(填化学式),常用作制冷剂的物质是(填名称)(2)、在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是。(3)、A极易溶于水,水溶液显性,实验室以NH4Cl固体为主要原料制备A气体,其化学方程式为;(4)、欲吸收尾气中的A,下列装置中不可选用(填字母)。(已知A难溶于CCl4)
(1)、在氮的单质和常见的含氮化合物中,常用作保护气的物质是(填化学式),常用作制冷剂的物质是(填名称)(2)、在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是。(3)、A极易溶于水,水溶液显性,实验室以NH4Cl固体为主要原料制备A气体,其化学方程式为;(4)、欲吸收尾气中的A,下列装置中不可选用(填字母)。(已知A难溶于CCl4)a.
 b.
b. c.
c. d.
d. (5)、氨气极易溶于水,可以利用如图装置进行喷泉实验。下列组合中也能产生“喷泉”现象的为(填字母)。
(5)、氨气极易溶于水,可以利用如图装置进行喷泉实验。下列组合中也能产生“喷泉”现象的为(填字母)。
a.NO和水 b.CO2和饱和NaHCO3溶液
c.Cl2和浓NaOH溶液 d.HCl和水
(6)、Ertl(获2007年诺贝尔化学奖)对合成氨机理进行深入研究,并将研究的成果用于汽车尾气处理中,在催化剂存在下可将NO和CO反应转化为两种无色无毒气体,用化学反应方程式表示这个过程。五、填空题
-
25. 某温度时,在一个2L的密闭容器中A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据,回答下列问题:
 (1)、该反应的化学方程式为。(2)、从开始至2min,B的平均反应速率为;平衡时,C的浓度为 , A的转化率为。(3)、反应达平衡时体系的压强是开始时的倍(用分数表示)。(4)、下列叙述能说明该反应已达到化学平衡状态的是____(填字母标号)。A、B的体积分数不再发生变化 B、相同时间内消耗3nmolA,同时消耗nmol的B C、混合气体的总质量不随时间的变化而变化 D、混合气体的密度不随时间的变化而变化(5)、在某一时刻采取下列措施能使该反应速率减小的是____(填字母标号)。A、增大压强 B、降低温度 C、体积不变,充入A D、体积不变,从容器中分离出A
(1)、该反应的化学方程式为。(2)、从开始至2min,B的平均反应速率为;平衡时,C的浓度为 , A的转化率为。(3)、反应达平衡时体系的压强是开始时的倍(用分数表示)。(4)、下列叙述能说明该反应已达到化学平衡状态的是____(填字母标号)。A、B的体积分数不再发生变化 B、相同时间内消耗3nmolA,同时消耗nmol的B C、混合气体的总质量不随时间的变化而变化 D、混合气体的密度不随时间的变化而变化(5)、在某一时刻采取下列措施能使该反应速率减小的是____(填字母标号)。A、增大压强 B、降低温度 C、体积不变,充入A D、体积不变,从容器中分离出A
-
-