高考二轮复习知识点:海水资源及其综合利用
试卷更新日期:2023-07-27 类型:二轮复习
一、选择题
-
1. 化学创造美好生活。下列生产活动中,没有运用相应化学原理的是( )
选项
生产活动
化学原理
A
用聚乙烯塑料制作食品保鲜膜
聚乙烯燃烧生成 和
B
利用海水制取溴和镁单质
可被氧化、 可被还原
C
利用氢氟酸刻蚀石英制作艺术品
氢氟酸可与 反应
D
公园的钢铁护栏涂刷多彩防锈漆
钢铁与潮湿空气隔绝可防止腐蚀
A、A B、B C、C D、D2. 一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是( )
A、物质X常选用生石灰 B、工业上常用电解熔融 制备金属镁 C、“氯化”过程中发生的反应为 D、“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水3. 下列说法错误的是( )A、某些胶态金属氧化物分散于玻璃中可制造有色玻璃 B、通常以海水提取粗食盐后的母液为原料制取溴 C、生物炼铜中通常利用某些细菌把不溶性的硫化铜转化为可溶性铜盐 D、工业制备硝酸的主要设备为沸腾炉、接触室和吸收塔4. 广东省海洋资源丰富。下列有关说法正确的是A、海底石油经裂化和裂解可得不饱和烃 B、海带等藻类植物中富含 C、潮汐能属于生物质资源 D、“海水晒盐”时主要发生化学变化5. 海水综合利用符合可持续发展的原则,其联合工业体系(部分)如图所示,下列说法中错误的是( ) A、①中可采用蒸馏法或者电渗析法 B、②中可通过电解熔融态的氯化镁制金属镁单质 C、③中生成1mol Br2 , 共消耗标准状况下Cl2 22.4L D、④的产品可生产盐酸、漂白液、漂白粉等6. I2的一种制备方法如图所示:
A、①中可采用蒸馏法或者电渗析法 B、②中可通过电解熔融态的氯化镁制金属镁单质 C、③中生成1mol Br2 , 共消耗标准状况下Cl2 22.4L D、④的产品可生产盐酸、漂白液、漂白粉等6. I2的一种制备方法如图所示:
下列说法正确的是:( )
A、“富集”时发生的离子方程式为 B、转化反应为 , 说明的还原性大于 C、通入过量Cl2 , 氧化产物只有一种 D、制备的I2可直接用于加碘盐7. 化学与社会、生产、生活密切相关。下列说法正确的是( )A、食品中的抗氧化剂对人体无害且均具有氧化性 B、从海水提取物质都必须通过化学反应才能实现 C、我国发射的“北斗组网卫星”所使用的光导纤维是一种有机高分子材料 D、“地沟油”禁止食用,但可以用来制肥皂8. 关于海水提溴和海带提碘的说法错误的是( )A、都经过浓缩、氧化、提取三个步骤 B、氧化步骤都可以通入氯气来实现 C、提取时利用了溴和碘的物理性质 D、实验室模拟时都用到了蒸发皿9. 下列变化中,只涉及物理变化的是( )A、盐酸除锈 B、石油分馏 C、海水提溴 D、煤干馏10. “吹出法”是工业上常用的一种海水提溴技术,该技术主要流程如下:
下列有关说法错误的是( )
A、氧化1所用的氯气可通过电解饱和 溶液制得 B、吹出后剩余溶液中可能大量存在的离子有 、 、 、 C、吸收过程发生反应的离子方程式为 D、氧化2所得溶液可通过萃取分离出溴11. 海洋具有十分巨大的开发潜力。下列有关海水综合利用的说法正确的是( )A、海水晒盐的过程中只涉及化学变化 B、利用潮汐发电是将化学能转化为电能 C、将 转变为 是海水提溴中关键的化学反应 D、从海水制得的氯化钠除食用外,还可用于氯碱工业以制备金属钠12. 海洋是一个资源宝库,海水资源的开发和利用是现代和未来永恒的主题。下面是海水利用的流程图:
下列有关说法错误的是( )
A、过程中制得NaHCO3是先往精盐溶液中通入CO2 , 再通入NH3 B、氯碱工业在阳极产生了使湿润淀粉碘化钾试纸变蓝的气体 C、反应②加热MgCl2·6H2O应在HCl气流保护下制备无水MgCl2 D、反应⑤中,用Na2CO3水溶液吸收Br2后,用70—80%硫酸富集Br213. “空气吹出法”海水提溴的工艺流程如图:
下列说法错误的是( )
A、进入吹出塔前,Br-被氧化为Br2 B、从吸收塔流出的溶液主要含HBr和H2SO4 C、经过吸收塔后,溴元素得到富集 D、两次通入水蒸气的作用都是参加反应14. 海洋是一个巨大的资源宝库,海水开发利用的部分过程如图所示。下列有关说法错误的是( ) A、①粗盐制精盐除采用过滤泥沙外,还必须除去 Ca2+、Mg2+、SO42-等杂质 B、工业生产中常选用石灰乳作为 Mg2+的沉淀剂,并对沉淀进行洗涤 C、第②步的反应是将 MgCl2•6H2O 晶体在空气中直接加热脱去结晶水得无水 MgCl2 D、第③步到第⑤步空气吹出法提取海水中溴通常使用 SO2 作还原剂15. 海洋是资源的宝库,下列生产过程中不涉及氧化还原反应的是( )A、海水晒盐 B、电解饱和食盐水 C、海带提碘 D、用氯气制漂粉精16. 化学与生活密切相关,下列过程不属于化学反应的是( )
A、①粗盐制精盐除采用过滤泥沙外,还必须除去 Ca2+、Mg2+、SO42-等杂质 B、工业生产中常选用石灰乳作为 Mg2+的沉淀剂,并对沉淀进行洗涤 C、第②步的反应是将 MgCl2•6H2O 晶体在空气中直接加热脱去结晶水得无水 MgCl2 D、第③步到第⑤步空气吹出法提取海水中溴通常使用 SO2 作还原剂15. 海洋是资源的宝库,下列生产过程中不涉及氧化还原反应的是( )A、海水晒盐 B、电解饱和食盐水 C、海带提碘 D、用氯气制漂粉精16. 化学与生活密切相关,下列过程不属于化学反应的是( )A
B
C
D




酸性重铬酸钾用于检测酒精
铝粉与强碱溶液反应放热
植物油在空气中变质,产生“哈喇”味
海水经风吹日晒获得粗盐
A、A B、B C、C D、D17. 化学与生活、生产密切相关。下列叙述错误的是( )A、高纯硅可用于制作光导纤维 B、碳酸钠热溶液呈碱性,可用于除去餐具上的油污 C、利用太阳能蒸发海水的过程属于物理变化 D、淀粉和纤维素水解的最终产物均为葡萄糖18. 海水是十分重要的自然资源.如图是海水资源利用的部分过程,下列有关说法不正确的是( ) A、第①步除去粗盐中的 Ca2+、Mg2+、SO42-等杂质离子加入试剂顺序为:NaOH 溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸 B、第②步由MgCl2•6H2O在空气中受热分解来制取无水MgCl2 C、第③步可通入Cl2 , 第④⑤步的目的是富集溴元素 D、海水淡化的方法主要有蒸馏法、电渗析法和离交换法19. 化学与科技、社会、生产和生活密切相关,下列说法正确的是( )A、从海水中提取物质都必须通过化学反应才能实现 B、热的纯碱溶液可用于洗涤煤油、柴油等矿物油污 C、N95口罩用0.3微米氯化钠颗粒进行测试,阻隔率达95%以上,戴N95口罩可有效阻隔PM2.5 D、乙醚、84消毒液、过氧乙酸、90%以上乙醇等这些消毒剂均能有效对抗新型冠状病毒20. 实验室模拟从海带提取碘单质的流程如下:
A、第①步除去粗盐中的 Ca2+、Mg2+、SO42-等杂质离子加入试剂顺序为:NaOH 溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸 B、第②步由MgCl2•6H2O在空气中受热分解来制取无水MgCl2 C、第③步可通入Cl2 , 第④⑤步的目的是富集溴元素 D、海水淡化的方法主要有蒸馏法、电渗析法和离交换法19. 化学与科技、社会、生产和生活密切相关,下列说法正确的是( )A、从海水中提取物质都必须通过化学反应才能实现 B、热的纯碱溶液可用于洗涤煤油、柴油等矿物油污 C、N95口罩用0.3微米氯化钠颗粒进行测试,阻隔率达95%以上,戴N95口罩可有效阻隔PM2.5 D、乙醚、84消毒液、过氧乙酸、90%以上乙醇等这些消毒剂均能有效对抗新型冠状病毒20. 实验室模拟从海带提取碘单质的流程如下:
下列有关说法正确的是( )
A、实验室在蒸发皿中灼烧干海带 B、操作1为过滤,操作3为蒸馏 H2SO4(aq) C、含I-的滤液中加入稀硫酸和 H2O2后,碘元素发生还原反应 D、含I-和IO3- 的混合溶液中加入稀硫酸发生反应的离子方程式为: 5I-+IO3- +6H+=3I2+3H2O21. 化工生产与人类进步紧密相联。下列有关说法错误的是( )A、空气吹出法提取海水中溴通常使用SO2作还原剂 B、侯氏制碱法工艺流程中利用了物质溶解度的差异 C、合成氨采用高温、高压和催化剂主要是提高氢气平衡转化率 D、工业用乙烯直接氧化法制环氧乙烷体现绿色化学和原子经济22. 海水中含量最高的非金属元素是( )A、O B、Cl C、Br D、I23. 海洋是资源的宝库,海水中含量最高的金属元素是( )A、Na B、Ca C、Mg D、Cu24. 化学与生产、生活密切相关。下列说法中错误的是( )A、海水提镁、炼铁、制造玻璃等工业都用到石灰石 B、将煤的液化、气化,能减少二氧化碳的排放 C、雾霾是一种分散系,N95活性炭口罩可用于防霾,其原理是吸附作用 D、晶体硅制得的光电池,能直接将光能转化为电能二、非选择题
-
25.
[选修2--化学与技术]海水晒盐的卤水中还有氯化镁,以卤水为原料生产镁的一中工艺流程如图所示.

回答下列问题:
(1)、脱硫槽、搅拌槽均用于脱除卤水中的(填离子符号),M的主要成分是(填化学式).(2)、除溴塔中主要的离子方程式为 .(3)、沸腾炉①和②的主要作用是 . 沸腾炉③通入热氯化氢的主要目的是 .(4)、电解槽中阴极的电极反应方程式为 .(5)、电解槽中阳极产物为 , 该产物可直接用于本工艺流程中的 .26. 某班以小组为单位,利用海水进行粗盐提纯及资源利用的项目化学习。(1)、小组1:收集了500mL奉贤海湾的海水,在实验室中提取粗盐,并检验杂质离子。该小组将100.00mL海水样品蒸发结晶,得到乳白色粗盐晶体m1g,若要检验该粗盐中是否含有硫酸根离子,方法是。取一半该粗盐,若将SO转化成硫酸钡沉淀,如何判断SO已沉淀完全;洗涤干燥后,称量得到0.0233g沉淀,则该海水中SO的含量为mol/L,若未洗涤,则测得结果(填“偏大”、“偏小”或“无影响”)。
(2)、 小组2:将小组1所得粗盐的一半进行精制,除去杂质离子Ca2+、Mg2+和SO , 操作流程如下:
步骤⑤操作中用到的玻璃仪器有 , 实验过程中多次产生沉淀,共需要过滤次。若m2=1.346g,据此能否计算该海水样品中的氯化钠的物质的量浓度?若能,请写出计算结果;若不能,请解释原因:。
(3)、小组3:利用小组2得到精盐的水溶液及铅笔、饮料瓶、电池等自制84消毒液。请对比该小组设计的两种制备装置甲和乙,你认为哪种装置更好 , 请说明理由。
 27. 卤族元素在自然界中主要以卤化物形式存在,完成下列填空:(1)、工业电解铝以铝土矿(Al2O3)为原料,冰晶石(Na3AlF4)为助熔剂。
27. 卤族元素在自然界中主要以卤化物形式存在,完成下列填空:(1)、工业电解铝以铝土矿(Al2O3)为原料,冰晶石(Na3AlF4)为助熔剂。①铝土矿中 的晶体类型;
②比较 的简单离子半径大小;
③ 最外层电子的电子云形状为。
(2)、从海水中获取的 主要用于氯碱工业,写出阳极的电极反应。(3)、采用“空气吹出法”从浓海水中吹出 ,并用纯碱吸收。纯碱吸收 的主要反应为: ,吸收 时,转移电子为mol。(4)、工业生产纯碱的方法是:向饱和食盐水中通入 和 ,即有 晶体析出。结合速率与平衡理论解释 析出的原因。(5)、向碘水溶液中通入过量的 ,发生反应: ,配平上述方程式。28. 海水中化学资源的综合开发利用,已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,如图为提取它们的主要步骤: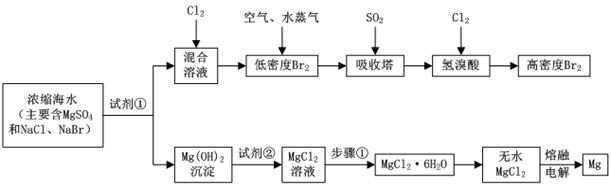
请回答:
(1)、Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。吸收塔中反应的离子方程式是 , 工业生产1mol高浓度Br2 , 理论上需要Cl2的物质的量为。
(2)、10L海水经过提纯浓缩,向吸收塔吸收后的溶液中加入0.100mol/LAgNO3溶液8.0mL恰好完全反应,则海水中含溴的含量为mg/L(不考虑提纯过程中溴的损失)。(3)、Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。上述流程中为了使MgSO4完全转化为Mg(OH)2 , 试剂①可以选用(写化学式)。
(4)、步骤①包括、、过滤、洗涤、干燥。(5)、通电时无水MgCl2在熔融状态下反应的化学方程式是。29. 碘是人体不可缺少的微量元素,也是制造各种无机及有机碘化物的重要原料。利用卤水(含有F)可提取碘。(1)、采用离子交换法从卤水中提取碘的工艺流程如下: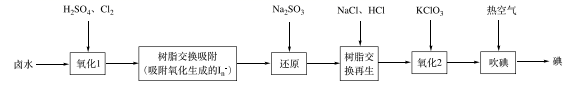
①“氧化1”中生成 ,其反应的离子方程式为。
②“还原”中溶液里含有 , 检验 的实验操作是。
③“吹碘”中通入热空气,利用了碘具有的性质。
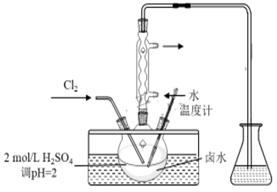
(2)、某实验小组采用如图所示装置、40℃水浴加热制取碘。实验过程中需要控制Cl2用量,否则酸性条件下过量Cl2能将I2进一步氧化成 。请补充完整检验反应后的三颈烧瓶中溶液是否含有 的实验方案:取适量三颈烧瓶中的溶液,。已知反应: +5I-+6H+=3I2+3H2O,实验中可选用的试剂:2mol·L-1硫酸、1 mol·L-1KI溶液、淀粉溶液、CCl4。
 (3)、为测定卤水样品中I的含量,进行下列实验:
(3)、为测定卤水样品中I的含量,进行下列实验:①取2.500L卤水样品减压浓缩至20.00mL,加入过量的0.1500mol·L-1CuCl2溶液20.00mL。
②密封静置2h,生成白色沉淀(发生反应为2Cu2++4I-=I2+2CuI↓)。
③用电感耦合等离子体发射光谱仪测定反应后溶液中c(Cu2+)=0.0125 mol·L-1。
根据上述实验数据,计算卤水样品中I的含量(单位mg·L-1 , 溶液混合前后总体积变化不计,写出计算过程):。
30. 海水是巨大的化学资源宝库,利用海水可以获取很多物质。海水中主要离子有Na+、K+、Ca2+、Mg2+、Cl-、SO42-等。利用1:淡水工业
(1)、海水淡化的方法主要有、电渗析法、离子交换法等。(2)、电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。
①淡水在室(填X、Y或Z)形成后流出。
②一般海水不直接通入到阴极室中,原因是。
(3)、离子交换法净化海水模拟过程如图所示,氢型阳离子交换原理可表示为:HR+Na+=NaR+H+ , ……。羟型阴离子交换树脂填充段存在的反应有。
利用2:提溴工业
(4)、用海水晒盐之后的盐卤可提取溴,提取流程如图:
①用热空气将溴赶出,在吸收塔先用浓Na2CO3溶液吸收Br2 , Br2歧化为Br-和BrO3- , 再加入W溶液得到Br2。推测W是。
②蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是。
③将1m3海水浓缩至1L,使用该法最终得到38.4gBr2 , 若总提取率为60%,则原海水中溴的浓度是 mg/L。
31. 启普发生器是荷兰科学家设计的实验室气体发生装置,由图中漏斗1和容器2两部分构成;现借助启普发生器及相关装置模拟侯氏制碱法制备日用化学品——NH4Cl和Na2CO3。回答相关问题:(NaHCO3的制备)
反应原理:NH3+NaCl+CO2+H2O=NH4Cl+NaHCO3↓
反应装置:
 (1)、启普发生器中发生的离子反应方程式为 , 如果上述装置中导管被堵塞,启普发生器中观察到的现象是。(2)、仪器3中盛装的试剂是;已知常温,NaCl的溶解度为35.9g,仪器4中含氨的饱和食盐水的配制方法是将20.0mL浓氨水与8.0gNaCl混合振荡过滤,试推测过滤除去的物质为。(3)、观察仪器4中CO2流速的方法是 , 仪器5中试剂的作用是。(4)、反应结束后,对仪器4进行冷却并趁冷过滤其中的悬浊液,“趁冷”的目的是。(5)、(Na2CO3的制备)
(1)、启普发生器中发生的离子反应方程式为 , 如果上述装置中导管被堵塞,启普发生器中观察到的现象是。(2)、仪器3中盛装的试剂是;已知常温,NaCl的溶解度为35.9g,仪器4中含氨的饱和食盐水的配制方法是将20.0mL浓氨水与8.0gNaCl混合振荡过滤,试推测过滤除去的物质为。(3)、观察仪器4中CO2流速的方法是 , 仪器5中试剂的作用是。(4)、反应结束后,对仪器4进行冷却并趁冷过滤其中的悬浊液,“趁冷”的目的是。(5)、(Na2CO3的制备)将(4)所得固体转移至蒸发皿中加热得到Na2CO3;请设计简单实验证明NaHCO3固体已分解完全。
(6)、(NH4Cl的制备)向(4)所得母液中加入两种物质并降温,NH4Cl会逐步结晶析出,所加物质的名称是 , 过滤NH4Cl晶体后的滤液可以再次循环使用。