高考二轮复习知识点:氯、溴、碘及其化合物的综合应用
试卷更新日期:2023-07-27 类型:二轮复习
一、选择题
-
1. 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色
X溶液中一定含有Fe2+
B
向浓度均为0.05 mol·L−1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成
Ksp(AgI)> Ksp(AgCl)
C
向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色
Br2的氧化性比I2的强
D
用pH试纸测得:CH3COONa溶液的pH约为
9,NaNO2溶液的pH约为8
HNO2电离出H+的能力比CH3COOH的强
A、A B、B C、C D、D2. 化学与日常生活密切相关,下列说法错误的是( )A、碘酒是指单质碘的乙醇溶液 B、84消毒液的有效成分是NaClO C、浓硫酸可刻蚀石英制艺术品 D、装饰材料释放的甲醛会造成污染3. 下列选项所示的物质间转化都能实现的是A、 B、 C、 D、4. 75%乙醇、含氯消毒剂都能有效灭活病毒。下列说法正确的是A、乙醇能与水以任意比例互溶 B、乙醇浓度越高灭活效果越好 C、漂粉精的主要成分是NaClO D、都是利用氧化性灭活病毒5. 氨是水体污染物的主要成分之一,工业上可用次氯酸盐作处理剂,有关反应可表示为:①
②
在一定条件下模拟处理氨氮废水:将的氨水分别和不同量的混合,测得溶液中氨去除率、总氮(氨氮和硝氮的总和)残余率与投入量(用x表示)的关系如下图所示。下列说法正确的是
 A、的数值为0.009 B、时, C、时,x越大,生成的量越少 D、时,6. 洁厕灵与84消毒液混合会产生氯气:2HCl + NaClO = NaCl + Cl2↑ + H2O,下列说法错误的是A、2molHCl反应将转移NA个电子 B、n氧化剂:n还原剂=1:1 C、NaClO作氧化剂,失去电子 D、Cl2既是氧化产物又是还原产物7. 将pH传感器、氯离子传感器、氧气传感器分别插入盛有氯水的广口瓶中,用强光照射,测得的实验数据如图所示。下列说法正确的是( )
A、的数值为0.009 B、时, C、时,x越大,生成的量越少 D、时,6. 洁厕灵与84消毒液混合会产生氯气:2HCl + NaClO = NaCl + Cl2↑ + H2O,下列说法错误的是A、2molHCl反应将转移NA个电子 B、n氧化剂:n还原剂=1:1 C、NaClO作氧化剂,失去电子 D、Cl2既是氧化产物又是还原产物7. 将pH传感器、氯离子传感器、氧气传感器分别插入盛有氯水的广口瓶中,用强光照射,测得的实验数据如图所示。下列说法正确的是( ) A、图甲中pH减小是由于光照促进了HClO的电离 B、图乙中增大主要是由于反应消耗了水 C、图丙中氧气的体积分数增大是由于HClO的分解 D、该体系中存在两个电离平衡和两个化学平衡8. 75%乙醇、含氯消毒剂都能有效灭活病毒。下列说法正确的是( )A、乙醇能与水以任意比例互溶 B、乙醇浓度越高灭活效果越好 C、漂粉精的主要成分是NaClO D、都是利用氧化性灭活病毒9. 实验室用苯与溴反应制备溴苯,关于说法正确的是( )A、可以用溴水代替液溴,减少溴的挥发 B、将生成气体直接通入溶液,检验反应是否生成HBr C、铁粉作催化剂,苯与溴既能发生加成反应,也能发生取代反应 D、反应后的混合液经稀碱溶液洗涤、分液、蒸馏,即可得到溴苯10. “劳动创造幸福,实干成就伟业。”下列劳动项目与所涉及的化学知识关联错误的是
A、图甲中pH减小是由于光照促进了HClO的电离 B、图乙中增大主要是由于反应消耗了水 C、图丙中氧气的体积分数增大是由于HClO的分解 D、该体系中存在两个电离平衡和两个化学平衡8. 75%乙醇、含氯消毒剂都能有效灭活病毒。下列说法正确的是( )A、乙醇能与水以任意比例互溶 B、乙醇浓度越高灭活效果越好 C、漂粉精的主要成分是NaClO D、都是利用氧化性灭活病毒9. 实验室用苯与溴反应制备溴苯,关于说法正确的是( )A、可以用溴水代替液溴,减少溴的挥发 B、将生成气体直接通入溶液,检验反应是否生成HBr C、铁粉作催化剂,苯与溴既能发生加成反应,也能发生取代反应 D、反应后的混合液经稀碱溶液洗涤、分液、蒸馏,即可得到溴苯10. “劳动创造幸福,实干成就伟业。”下列劳动项目与所涉及的化学知识关联错误的是选项
劳动项目
化学知识
A
用硅单质制作太阳能电池板
硅元素在地壳中含量丰富
B
用高浓度白酒浸泡药材制成药酒
相似相溶原理
C
用KSCN溶液检验菠菜中是否含铁元素
含Fe3+的溶液遇SCN-变为红色
D
用ClO2给自来水消毒
ClO2具有强氧化性
A、A B、B C、C D、D11. 下列物质性质与用途具有对应关系的是A、易升华,可用于检验淀粉的存在 B、漂白粉具有强氧化性,可用于消毒杀菌 C、液溴呈红棕色,可用于与苯反应制备溴苯 D、浓硫酸具有脱水性,可用于与反应制HF12. 化学知识与科技、生产、生活有密切的关系。下列叙述错误的是A、利用作灭火剂,是因为铵盐易分解且吸热,同时分解产物不支持燃烧 B、红酒中添加 , 利用了的还原性和杀菌消毒的能力 C、是一种绿色消毒剂,可用于自来水杀菌消毒 D、利用制取K,该反应可以说明Na的金属性强于K13. 部分含氮及氯物质的价类二维图如下,下列推断不合理的是 A、a和c可在一定条件下反应生成b B、工业上通过a→b→d→e来制备 C、浓的a′溶液和浓的c′溶液反应可以得到b′ D、a和b′可在一定条件下反应生成b14. 下列说法错误的是( )A、当沉淀的结晶颗粒较大且静置易沉降时,常可采用倾析法进行分离或洗涤 B、为检验浓硫酸作用下,乙醇发生消去反应所得的有机产物,需先将产生的气体通过足量NaOH溶液,再通过溴水 C、在制备阿司匹林时,常将粗产品用少量酒精洗涤1~2次 D、用淀粉检验是否存在碘单质时,需控制温度,温度偏高会导致蓝色褪去15. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、Fe FeCl2 Fe(OH)2 B、N2(g) NO(g)HNO3(aq) C、NaCl(aq)Cl2漂白粉 D、SiO2H2SiO3(胶体)Na2SiO3溶液16. 下列说法错误的是( )A、碘化银常用作感光材料,是胶卷中必不可少的成分 B、石英、水晶、硅藻土的主要成分都是SiO2 C、氧化铁红颜料跟某些油料混合,可以制成防锈油漆 D、石墨可做润滑剂和电极材料17. 下列说法正确的是( )A、浓硫酸具有强吸水性,能吸收糖类化合物中的水分而使其炭化 B、具有还原性,可用于自来水的杀菌消毒 C、盐碱地(含较多等)不利于作物生长,可施加熟石灰进行改良 D、铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业18. 溴化氢比碘化氢( )A、键长短 B、沸点高 C、稳定性小 D、还原性强19. 三氟化氯(ClF3)可应用于航天工业,是一种很强的氧化剂和氟化剂,它能与大多数有机和无机材料甚至塑料反应,可以使许多材料不接触火源就燃烧。下列分析错误的是( )A、可以代替H2O2充当火箭推进剂中的氧化剂 B、能与一些金属反应生成氯化物和氟化物 C、三氟化氯可用于清洁化学气相沉积的反应舱附着的半导体物质 D、ClF3与水按照1:2反应生成两种强酸20. 海洋中资源丰富,有关说法正确的是( )A、碘元素主要存在海水中 B、通常用海水晒盐后的母液为原料提溴 C、镁是海水中含量最多的金属元素 D、从海水中提取食盐和溴的过程都是物理变化21. NaClO是家用消毒液的有效成分,可通过Cl2与NaOH反应制得。NaClO能与CO2反应生成HClO。常温下ClO2为黄绿色有毒气体,易溶于水。ClO2体积分数大于10%或其水溶液在温度过高时可能发生爆炸,与碱反应生成ClO和ClO等。实验室制备ClO2的反应原理为2KClO3+H2C2O4+H2SO4=2ClO2↑+2CO2↑+K2SO4+2H2O。下列说法正确的是( )A、新制氯水需存放在带玻璃塞的棕色试剂瓶中 B、可用广泛pH试纸测定新制氯水的pH值 C、NaClO与CO2反应的离子方程式为NaClO+CO2+H2O=HClO+Na++HCO D、使用NaClO消毒时,可用盐酸酸化
A、a和c可在一定条件下反应生成b B、工业上通过a→b→d→e来制备 C、浓的a′溶液和浓的c′溶液反应可以得到b′ D、a和b′可在一定条件下反应生成b14. 下列说法错误的是( )A、当沉淀的结晶颗粒较大且静置易沉降时,常可采用倾析法进行分离或洗涤 B、为检验浓硫酸作用下,乙醇发生消去反应所得的有机产物,需先将产生的气体通过足量NaOH溶液,再通过溴水 C、在制备阿司匹林时,常将粗产品用少量酒精洗涤1~2次 D、用淀粉检验是否存在碘单质时,需控制温度,温度偏高会导致蓝色褪去15. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、Fe FeCl2 Fe(OH)2 B、N2(g) NO(g)HNO3(aq) C、NaCl(aq)Cl2漂白粉 D、SiO2H2SiO3(胶体)Na2SiO3溶液16. 下列说法错误的是( )A、碘化银常用作感光材料,是胶卷中必不可少的成分 B、石英、水晶、硅藻土的主要成分都是SiO2 C、氧化铁红颜料跟某些油料混合,可以制成防锈油漆 D、石墨可做润滑剂和电极材料17. 下列说法正确的是( )A、浓硫酸具有强吸水性,能吸收糖类化合物中的水分而使其炭化 B、具有还原性,可用于自来水的杀菌消毒 C、盐碱地(含较多等)不利于作物生长,可施加熟石灰进行改良 D、铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业18. 溴化氢比碘化氢( )A、键长短 B、沸点高 C、稳定性小 D、还原性强19. 三氟化氯(ClF3)可应用于航天工业,是一种很强的氧化剂和氟化剂,它能与大多数有机和无机材料甚至塑料反应,可以使许多材料不接触火源就燃烧。下列分析错误的是( )A、可以代替H2O2充当火箭推进剂中的氧化剂 B、能与一些金属反应生成氯化物和氟化物 C、三氟化氯可用于清洁化学气相沉积的反应舱附着的半导体物质 D、ClF3与水按照1:2反应生成两种强酸20. 海洋中资源丰富,有关说法正确的是( )A、碘元素主要存在海水中 B、通常用海水晒盐后的母液为原料提溴 C、镁是海水中含量最多的金属元素 D、从海水中提取食盐和溴的过程都是物理变化21. NaClO是家用消毒液的有效成分,可通过Cl2与NaOH反应制得。NaClO能与CO2反应生成HClO。常温下ClO2为黄绿色有毒气体,易溶于水。ClO2体积分数大于10%或其水溶液在温度过高时可能发生爆炸,与碱反应生成ClO和ClO等。实验室制备ClO2的反应原理为2KClO3+H2C2O4+H2SO4=2ClO2↑+2CO2↑+K2SO4+2H2O。下列说法正确的是( )A、新制氯水需存放在带玻璃塞的棕色试剂瓶中 B、可用广泛pH试纸测定新制氯水的pH值 C、NaClO与CO2反应的离子方程式为NaClO+CO2+H2O=HClO+Na++HCO D、使用NaClO消毒时,可用盐酸酸化二、多选题
-
22. 一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是( )A、过量的氢气与氮气 B、过量的浓盐酸与二氧化锰 C、过量的铜与浓硫酸 D、过量的锌与18 mol/L硫酸23. 二氧化氯(ClO2)是一种黄绿色易溶于水的气体,是一种安全无毒的绿色消毒剂,常用于饮用水消毒。下列有关ClO2制备与杀菌的说法不合理的是( )A、NaClO2在酸性条件下歧化生成ClO2和NaCl,则n(氧化剂)∶n(还原剂)=4∶1 B、ClO2在强碱性环境中使用失效,可能的原因是2ClO2+2OH-=++H2O C、可用饱和食盐水除去ClO2中的NH3 D、ClO2的消毒效率(单位质量的氧化剂得到的电子数)是Cl2的2.63倍24. 部分含氯物质的分类与相应氯元素的化合价关系如下图所示,下列说法正确的是
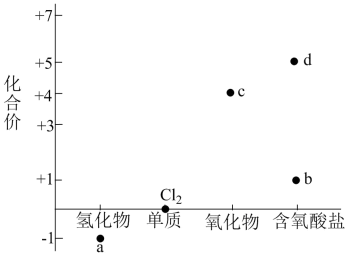 A、洁厕灵的主要成分为a,84消毒液的主要成分为b的一种,两者如果混用会产生有毒气体 B、c的化学式为 , 是HClO的酸酐 C、a的浓溶液可与d的溶液反应制备 D、新制氯水中存在如下平衡:25. 在指定条件下,下列选项所示的物质间转化不能实现的是( )A、 B、 C、 D、
A、洁厕灵的主要成分为a,84消毒液的主要成分为b的一种,两者如果混用会产生有毒气体 B、c的化学式为 , 是HClO的酸酐 C、a的浓溶液可与d的溶液反应制备 D、新制氯水中存在如下平衡:25. 在指定条件下,下列选项所示的物质间转化不能实现的是( )A、 B、 C、 D、三、非选择题
-
26. 溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,回答下列问题:(1)、海水提溴过程中,向浓缩的海水中通入 氯气将其中的Br﹣氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br﹣和BrO3﹣ , 其离子方程式为;(2)、溴与氯能以共价键结合形成BrCl.BrCl分子中,显正电性.BrCl与水发生反应的化学方程式为;(3)、CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s)+Br2(g)△H=+105.4kJ/mol在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa.
①如反应体系的体积不变,提高反应温度,则p (Br2)将会(填“增大”、“不变”或“减小”).
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为 .
27. NaCN超标的电镀废水可用两段氧化法处理:Ⅰ.NaCN与NaClO反应,生成NaOCN和NaCl
Ⅱ.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10﹣10)有剧毒;HCN、HOCN中N元素的化合价相同.
完成下列填空:
(1)、第一次氧化时,溶液的pH应调节为(选填“酸性”、“碱性”或“中性”);原因是 .(2)、写出第二次氧化时发生反应的离子方程式.(3)、处理100m3含NaCN10.3mg/L的废水,实际至少需NaClOg(实际用量应为理论值的4倍),才能使NaCN含量低于0.5mg/L,达到排放标准.
(4)、(CN)2与Cl2的化学性质相似.(CN)2与NaOH溶液反应生成、和H2O.(5)、上述反应涉及到的元素中,氯原子核外电子能量最高的电子亚层是;H、C、N、O、Na的原子半径从小到大的顺序为 .(6)、HCN是直线型分子,HCN是分子(选填“极性”或“非极性”).HClO的电子式为 .28. 海洋中有丰富的NaCl资源。研究表明,氯离子的侵入是造成钢筋混凝土腐蚀的主要原因(Na+对腐蚀无影响)。海砂经淡化后,Cl-的含量达到一定标准才能作建筑用砂。某合作学习小组猜测Cl-会加快金属与盐溶液或酸溶液的反应速率。(1)、工业上通过电解饱和NaCl溶液制Cl2的离子方程式为。(2)、实验室用如图所示装置模拟工业上制Cl2。检验产生的Cl2的操作及现象是。 (3)、探究Cl-是否会加快金属与盐溶液的反应速率。
(3)、探究Cl-是否会加快金属与盐溶液的反应速率。①小组同学利用图1所示装置进行探究。当Zn-Cu原电池工作约30s后,向电池槽内加入少量NaCl固体,电流随时间的变化如图2所示。甲同学认为加入NaCl固体后电流强度增大并不能说明Cl-会加快金属与盐溶液的反应速率,其理由可能是。

②乙同学利用温度传感器进行探究。分别取20mL0.1mol/LCuSO4溶液于A、B两个100mL烧杯中;向B烧杯中加入5gNaCl固体,使其溶解。在相同温度下,分别往两个烧杯中加入相同的用砂纸打磨过的镁条,采集温度数据,得出Cl-会加快金属与盐溶液的反应速率。已知0-100sA烧杯中溶液温度随时间的变化如图所示,请在答题卡相应位置画出0~100sB烧杯中溶液温度随时间的变化情况(100s时反应仍在进行) 。
 (4)、探究Cl-是否会加快金属与酸溶液的反应速率。小组同学的实验记录如表:
(4)、探究Cl-是否会加快金属与酸溶液的反应速率。小组同学的实验记录如表:实验序号
Zn片
酸
其他试剂
生成VmLH2的时间
I
完全相同
100mL0.1mol/L硫酸溶液
—
t1
II
100mL0.2mol/L盐酸
—
t2
III
100mLamol/L硫酸溶液
少量_
t3
其中,t1>t2 , t1>t3。
①由实验I和实验II(填“能”或“不能”)推知Cl-会加快金属与酸溶液的反应速率,理由是。
②小组同学一致认为,由实验I和实验III可推知Cl-会加快金属与酸溶液的反应速率,则实验III中,a处填 , b处填。
(5)、提出一种合理的降低海砂中Cl-含量的方法:。29. 海洋元素“溴”的单质及其化合物的用途广泛。(1)、Br原子的最外层电子排布式为 , 其中未成对电子的电子云形状为。(2)、能作为溴、碘元素原子得电子能力递变规律的判断依据是(填序号)。a.IBr中溴为﹣1价 b.HBr、HI的酸性
c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)、从原子结构角度解释氯的非金属性强于溴的原因:。(4)、Br2和碱金属单质形成的MBr熔点如表:MBr
NaBr
KBr
RbBr
CsBr
熔点/℃
747
734
693
636
NaBr的电子式 , MBr熔点呈现表中趋势的原因是。
(5)、海水提溴过程中,先向酸化的浓缩海水中通入 , 将其中的Br—氧化,再用“空气吹出法”吹出Br2 , 并用纯碱吸收:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),则吸收1mol Br2 , 转移电子mol,反应中氧化产物为。(6)、随后用硫酸酸化吸收液,得到Br2和Na2SO4的混合溶液。相同条件下,若用盐酸酸化,则所得Br2的质量减少,可能原因是。30. 碘单质对动植物的生命极其重要,还可用于医药、照相、染料和系统监测等。某学习小组在实验室中从海藻和油井盐水生产母液中提取碘单质的主要步骤如图1所示:
已知:本实验条件下,氧化性:Cl2>IO>MnO2>I2
回答下列问题:
(1)、检验海藻和油井盐水生产母液中含有I-的操作和现象为。(2)、“氧化”时,小组同学选用氯气作氧化剂,装置如图2所示:
①实验室用装置A制备Cl2时,适合选用的试剂为。
②实验时,控制向装置B中通入Cl2的速率和用量的常用方法为 , 若Cl2过量,造成的后果为(用离子方程式表示),向通入过量Cl2所得的溶液中加入一种试剂,可提高I2的产率,该试剂为(填选项字母)。
a.KI b.NaOH c.硝酸
③若用MnO2代替Cl2 , 优点是 , (答出一点即可);缺点是分离出的固体残渣中含有少量I2。小组同学用如图3所示装置进行固体残渣中I2的深度萃取,实验时装置D中溶剂受热蒸发,蒸汽沿蒸汽导管上升至装置F,冷凝后滴入滤纸套筒中,与固体残渣接触进行萃取,液面达到虹吸管顶端时,经虹吸管返回烧瓶。装置F的进水口为(填“上口”或“下口”),与常规萃取相比,该萃取装置的优点为。
(3)、“蒸馏”时,若加热一段时间后发现忘记加沸石,合理的处理方法为。