高考二轮复习知识点:化学用语2
试卷更新日期:2023-07-27 类型:二轮复习
一、选择题
-
1. 化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:

下列说法错误的是
A、Z的分子式为C13H16O5 B、X分子中共平面的碳原子最多有8个 C、Y与足量H2加成后的产物分子中含有4个手性碳原子 D、1molZ可与3molNaOH反应,生成1molH2O2. 下列化学用语只能用来表示一种微粒的是A、C3H8 B、 C、二氯乙烷
D、
C、二氯乙烷
D、 3. 下列化学用语或图示表达错误的是A、NaOH的电子式为
3. 下列化学用语或图示表达错误的是A、NaOH的电子式为 B、HClO的结构式为H-O-Cl
C、乙醇的分子式为
D、氯离子的结构示意图为
B、HClO的结构式为H-O-Cl
C、乙醇的分子式为
D、氯离子的结构示意图为 4. 下列化学用语或图示表达错误的是( )A、N2的结构式:N≡N B、Na+的原子结构示意图:
4. 下列化学用语或图示表达错误的是( )A、N2的结构式:N≡N B、Na+的原子结构示意图: C、溴乙烷的分子模型:
C、溴乙烷的分子模型:  D、CO2的电子式:
D、CO2的电子式:  5. 下列化学用语或图示表达错误的是。A、乙炔的结构简式为 B、的结构式为 C、基态原子电子轨道表示式为
5. 下列化学用语或图示表达错误的是。A、乙炔的结构简式为 B、的结构式为 C、基态原子电子轨道表示式为 D、的电子式为
6. 利用反应可制备。下列说法正确的是( )A、是还原产物 B、是弱电解质 C、的结构式为 D、NaClO和NaCl所含的化学键类型完全相同7. 下列化学用语或图示表达错误的是A、的结构式: B、NaOH的电子式:
D、的电子式为
6. 利用反应可制备。下列说法正确的是( )A、是还原产物 B、是弱电解质 C、的结构式为 D、NaClO和NaCl所含的化学键类型完全相同7. 下列化学用语或图示表达错误的是A、的结构式: B、NaOH的电子式: C、的VSEPR模型:
C、的VSEPR模型: D、的空间结构模型:
D、的空间结构模型: 8. BCl3水解反应方程式为:BCl3+3H2O=B(OH)3+3HCl,下列说法错误的是( )A、Cl的原子结构示意图为
8. BCl3水解反应方程式为:BCl3+3H2O=B(OH)3+3HCl,下列说法错误的是( )A、Cl的原子结构示意图为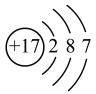 B、H2O的空间填充模型为
B、H2O的空间填充模型为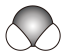 C、BCl3的电子式为:
C、BCl3的电子式为: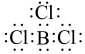 D、B(OH)3的结构简式为
D、B(OH)3的结构简式为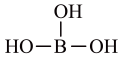 9. 下列有关电极方程式或离子方程式错误的是A、碱性锌锰电池的正极反应:MnO2+H2O+e-=MnO(OH)+OH- B、铅酸蓄电池充电时的阳极反应:Pb2++2H2O-2e-=PbO2+4H+ C、K3[Fe(CN)6]溶液滴入FeCl2溶液中:K++Fe2++[Fe(CN)6]3-=KFe[Fe(CN)6]↓ D、TiCl4加入水中:TiCl4+(x+2)H2O=TiO2·xH2O↓+4H++4Cl-10. 下列符号表征或说法正确的是( )A、电离: B、位于元素周期表p区 C、空间结构:平面三角形 D、电子式:
9. 下列有关电极方程式或离子方程式错误的是A、碱性锌锰电池的正极反应:MnO2+H2O+e-=MnO(OH)+OH- B、铅酸蓄电池充电时的阳极反应:Pb2++2H2O-2e-=PbO2+4H+ C、K3[Fe(CN)6]溶液滴入FeCl2溶液中:K++Fe2++[Fe(CN)6]3-=KFe[Fe(CN)6]↓ D、TiCl4加入水中:TiCl4+(x+2)H2O=TiO2·xH2O↓+4H++4Cl-10. 下列符号表征或说法正确的是( )A、电离: B、位于元素周期表p区 C、空间结构:平面三角形 D、电子式: 11. 下列有关化学用语表示正确的是( )A、过氧化钠的化学式:NaO B、钠离子的结构示意图:
11. 下列有关化学用语表示正确的是( )A、过氧化钠的化学式:NaO B、钠离子的结构示意图: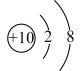 C、次氯酸钠(NaClO)中Cl元素的化合价:+1
D、NaClO的电离方程式:NaClO=Na++Cl++O2-
12. NA为阿伏加德罗常数的值。下列说法正确的是( )A、3.6 g D2O中含有的中子数为2NA B、10g C2H4和4g CO组成的混合气体中含有的分子数为0.5NA C、标准状况下,2.24L HF中含有的分子数为0.1NA D、KIO3与HI溶液反应,生成0.1 mol I2转移的电子数为0.2NA13. 设NA表示阿伏加德罗常数的数值,下列说法正确的是( )A、18gNH4+中所含的电子数为11NA B、将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA C、含3.0g HCHO 的水溶液中原子总数为0.4NA D、标准状况下,20gD2O 分子中所含中子数为10NA14. 阿伏加德罗常熟的值为NA . 下列说法正确的是( )A、1L0.1mol•L﹣1NH4CL溶液中,NH4+的数量为0.1NA B、2.4gMg与H2SO4完全反应,转移的电子数为0.1NA C、标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA D、0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA15. 国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误的是( )A、CH3CH2OH能与水互溶 B、NaClO通过氧化灭活病毒 C、过氧乙酸相对分子质量为76g/mol D、氯仿的化学式为16. NA为阿伏加德罗常数的值。下列叙述正确的是( )A、31 g白磷中含磷磷单键键数为NA B、标准状况下,22.4 L HF含有的质子数为10NA C、0.1 mol·L-1的CH3COONH4 , 溶液显中性,1 L该溶液中含阴离子数小于0.1NA D、Na2O2与H2O反应生成0.1 mol O2时转移电子数为0.1NA17. 我国科学家进行了如图所示的碳循环研究。下列说法正确的是( )
C、次氯酸钠(NaClO)中Cl元素的化合价:+1
D、NaClO的电离方程式:NaClO=Na++Cl++O2-
12. NA为阿伏加德罗常数的值。下列说法正确的是( )A、3.6 g D2O中含有的中子数为2NA B、10g C2H4和4g CO组成的混合气体中含有的分子数为0.5NA C、标准状况下,2.24L HF中含有的分子数为0.1NA D、KIO3与HI溶液反应,生成0.1 mol I2转移的电子数为0.2NA13. 设NA表示阿伏加德罗常数的数值,下列说法正确的是( )A、18gNH4+中所含的电子数为11NA B、将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA C、含3.0g HCHO 的水溶液中原子总数为0.4NA D、标准状况下,20gD2O 分子中所含中子数为10NA14. 阿伏加德罗常熟的值为NA . 下列说法正确的是( )A、1L0.1mol•L﹣1NH4CL溶液中,NH4+的数量为0.1NA B、2.4gMg与H2SO4完全反应,转移的电子数为0.1NA C、标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA D、0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA15. 国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误的是( )A、CH3CH2OH能与水互溶 B、NaClO通过氧化灭活病毒 C、过氧乙酸相对分子质量为76g/mol D、氯仿的化学式为16. NA为阿伏加德罗常数的值。下列叙述正确的是( )A、31 g白磷中含磷磷单键键数为NA B、标准状况下,22.4 L HF含有的质子数为10NA C、0.1 mol·L-1的CH3COONH4 , 溶液显中性,1 L该溶液中含阴离子数小于0.1NA D、Na2O2与H2O反应生成0.1 mol O2时转移电子数为0.1NA17. 我国科学家进行了如图所示的碳循环研究。下列说法正确的是( )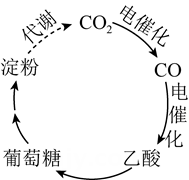 A、淀粉是多糖,在一定条件下能水解成葡萄糖 B、葡萄糖与果糖互为同分异构体,都属于烃类 C、 中含有 个电子 D、 被还原生成18. 盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用图1所示的方法制备。其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积变化,下列说法正确的是
A、淀粉是多糖,在一定条件下能水解成葡萄糖 B、葡萄糖与果糖互为同分异构体,都属于烃类 C、 中含有 个电子 D、 被还原生成18. 盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用图1所示的方法制备。其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积变化,下列说法正确的是 A、电池工作时,Pt电极是正极 B、图2中,A为H+和e- , B为NH3OH+ C、电池工作时,每消耗2.24LNO(标准状况下),左室溶液质量增加3.3g D、电池工作一段时间后,正、负极区溶液的pH均下降19. 表示阿伏加德罗常数的值,下列说法正确的是( )A、1.8g重水()中所含质子数为 B、常温下的Ba(OH)2溶液中OH-的数目为0.2 C、106gNa2CO3固体中含有个 D、标准状况下,中含有的分子数为20. 我国科学家采用单原子Ni和纳米Cu作串联催化剂,通过电解法将CO2转化为乙烯,装置示意图如图。
A、电池工作时,Pt电极是正极 B、图2中,A为H+和e- , B为NH3OH+ C、电池工作时,每消耗2.24LNO(标准状况下),左室溶液质量增加3.3g D、电池工作一段时间后,正、负极区溶液的pH均下降19. 表示阿伏加德罗常数的值,下列说法正确的是( )A、1.8g重水()中所含质子数为 B、常温下的Ba(OH)2溶液中OH-的数目为0.2 C、106gNa2CO3固体中含有个 D、标准状况下,中含有的分子数为20. 我国科学家采用单原子Ni和纳米Cu作串联催化剂,通过电解法将CO2转化为乙烯,装置示意图如图。
已知:电解效率n(B)= ×100%
下列说法正确的是( )
A、电极a连接电源的正极 B、电极b上发生反应: 2H2O+2e-= H2 ↑+2OH- C、通电后右室溶液质量减少 D、若电解效率为60%,电路中通过1 mol 电子时,标况下产生1.12L乙烯21. 下列化学用语或图示表达错误的是( )A、乙炔的结构简式: B、顺丁烯的分子结构模型: C、基态原子的价层电子的轨道表示式:
C、基态原子的价层电子的轨道表示式: D、的电子式:
D、的电子式: 22. 下列化学用语表示正确的是A、中子数为17的硫离子: B、的形成过程:
22. 下列化学用语表示正确的是A、中子数为17的硫离子: B、的形成过程: C、为位于周期表区
D、的球棍模型为:
C、为位于周期表区
D、的球棍模型为: 23. 下列化学用语表达正确的是A、中子数为10的氧原子: B、Ca2+的结构示意图:
23. 下列化学用语表达正确的是A、中子数为10的氧原子: B、Ca2+的结构示意图: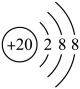 C、CH4的球棍模型:
C、CH4的球棍模型:  D、HBr的形成过程为
D、HBr的形成过程为 
二、多选题
-
24. 我国化工专家吴蕴初自主破解了“味精”的蛋白质水解工业生产方式。味精的主要成分为谷氨酸单钠盐。 是谷氨酸(结构简式如下)的同分异构体,与谷氨酸具有相同的官能团种类与数目。下列有关说法正确的是( )
 A、谷氨酸分子式为 B、谷氨酸分子中有2个手性碳原子 C、谷氨酸单钠能溶于水 D、 的数目(不含立体异构)有8种25. 下列电离方程式正确的是( )A、 B、 C、 D、
A、谷氨酸分子式为 B、谷氨酸分子中有2个手性碳原子 C、谷氨酸单钠能溶于水 D、 的数目(不含立体异构)有8种25. 下列电离方程式正确的是( )A、 B、 C、 D、三、非选择题
-
26. 阿帕替尼是我国自主研制的一种小分子酪氨酸酶抑制剂,是目前唯一一种口服治疗晚期胃癌的靶向药物。其合成路线如下图所示。

回答下列问题:
(1)、H中含氧官能团的名称为。(2)、B的结构简式为 , C的分子式为。(3)、D→E、G→H的反应类型分别为。(4)、E→G化学反应方程式。(5)、F的同分异构体中,含一个苯环,核磁共振氢谱有2组峰且面积比为的结构简式为。27. 化学在药物合成方面有广泛应用。(1)、I.有机物E是--种药物中间体,医药工业中的一种合成方法如下:
已知:
 。
。回答下列问题:
A的化学名称为。
(2)、B的结构简式为。B →C的反应条件是。(3)、C具有的官能团名称是。(4)、C→D反应类型为。(5)、由D生成E的化学方程式为。(6)、Ⅱ.布洛芬在临床上广泛用来解热镇痛及抗炎抗风湿,其结构如图所示。有机物F是布洛芬的同系物,F的同分异构体同时满足下列条件的总数为种。

a.相对分子质量比布洛芬小28;
b.苯环上仅有两个取代基,且羧基与苯环直接相连。
其中分子中核磁共振氢谱有4组吸收峰,峰值比为9:2:2:1,布洛芬的结构简式为。
28. 无机盐X由五种元素组成,某学习小组按如下流程进行实验: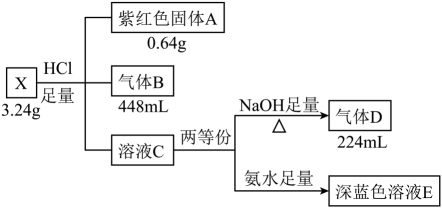
已知:上述气体体积均在标准状况下测得。气体B为纯净物,有刺激性气味,标准状况下密度为2.86 g/L。请回答:
(1)、X的组成元素是 , X的化学式是。(2)、写出C→D转化过程的离子方程式。(3)、深蓝色溶液E与气体B反应可生成X沉淀,写出该反应的离子方程式。(4)、若盐X与足量盐酸的反应改在密闭容器中进行,得到固体A、气体B和溶液M(M中不合固体A的组成元素)。设计实验检验溶液M中的。29. 分铜液净化渣主要含铜、碲(Te)、锑(Sb)、砷(As)等元素的化合物,一种回收工艺流程如图所示:
已知:①“碱浸”时,铜、锑转化为难溶氢氧化物或氧化物,碱浸液含有、。
②“酸浸”时,锑元素反应生成难溶的浸渣。
回答下列问题:
(1)、As位于第四周期VA族,基态As的价层电子排布式为。(2)、“碱浸”时,与NaOH反应的离子方程式为。(3)、向碱浸液加入盐酸调节pH=4,有析出,分离出的操作是。滤液中As元素最主要的存在形式为(常温下,的各级电离常数为:、、)。A. B. C. D.
(4)、①中,Sb的化合价为。②“氯盐酸浸”时,通入的目的是。
(5)、“水解”时,生成SbOCl的化学方程式为。(6)、可用作电子元件材料,熔点为733℃,其熔点远高于的原因为。晶胞是长方体结构(如图所示),碲的配位数为。已知为阿伏加德罗常数的值,则该晶体的密度为(列出计算表达式) 30. 19世纪初,法国科学家杜龙和珀蒂测定比热时发现:金属的比热( )与其相对原子质量的乘积近似为常数25.08 。将40.0g惰性金属M加热到100℃,投入20.0g温度为36.7℃的水中,最终体系的温度为46.7℃。推算该金属的近似摩尔质量(水的比热为4.18 ,请写出计算过程,结果保留整数)。
30. 19世纪初,法国科学家杜龙和珀蒂测定比热时发现:金属的比热( )与其相对原子质量的乘积近似为常数25.08 。将40.0g惰性金属M加热到100℃,投入20.0g温度为36.7℃的水中,最终体系的温度为46.7℃。推算该金属的近似摩尔质量(水的比热为4.18 ,请写出计算过程,结果保留整数)。