山东省潍坊市2023年中考化学真题
试卷更新日期:2023-07-27 类型:中考真卷
一、单选题
-
1. 中华传统文化典籍中包含很多化学知识。下列解释错误的是( )A、《华阳国志》:“取井火煮之,一斛水得五斗盐”——加热蒸发可得食盐 B、《天工开物》:“凡石灰,经火焚炼为用”——煅烧石灰石可生成熟石灰 C、《梦溪笔谈》:“熬胆矾铁釜,久之易化为铜”——铁的金属活动性强于铜 D、《周易》:“泽中有火,上火下泽”——池中有机物发酵产生可燃性气体2. 化肥对农作物的生长有重要影响。下列肥料能防止农作物倒伏的是( )A、 B、 C、 D、3. 规范的实验操作是实验成功和安全的重要保证。下列实验操作正确的是( )A、
 气密性检验
B、
气密性检验
B、 验满
C、
验满
C、 稀释浓硫酸
D、
稀释浓硫酸
D、 测溶液
4. 2023年世界地球日的主题是“珍惜地球资源,转变发展方式,倡导低碳生活”,下列做法符合这一主题的是( )A、露天焚烧秸秆,增强土壤肥性 B、采用绿色工艺,减少化工污染 C、加大燃煤发电,推广化石燃料 D、滥用农药化肥,提高粮食产量5. 下列物质的性质与用途,对应关系错误的是( )A、金刚石硬度大,用于切割大理石 B、干冰升华吸热,用于人工降雨 C、石墨烯导电性强,用作新型电阻触摸屏的电极 D、氢氧化钠固体易吸水,用于干燥二氧化碳6. 水是宝贵的自然资源。下列有关水的认识正确的是( )A、生活中加热煮沸降低水的硬度 B、工业上使用明矾对自来水消毒 C、农业上提倡大田漫灌浇灌作物 D、家庭中大力推广使用含磷洗涤剂7. 科学家利用“基因剪刀”技术降低了水稻中砷的含量。如图是砷元素在元素周期表中的信息及原子结构示意图。下列说法错误的是( )
测溶液
4. 2023年世界地球日的主题是“珍惜地球资源,转变发展方式,倡导低碳生活”,下列做法符合这一主题的是( )A、露天焚烧秸秆,增强土壤肥性 B、采用绿色工艺,减少化工污染 C、加大燃煤发电,推广化石燃料 D、滥用农药化肥,提高粮食产量5. 下列物质的性质与用途,对应关系错误的是( )A、金刚石硬度大,用于切割大理石 B、干冰升华吸热,用于人工降雨 C、石墨烯导电性强,用作新型电阻触摸屏的电极 D、氢氧化钠固体易吸水,用于干燥二氧化碳6. 水是宝贵的自然资源。下列有关水的认识正确的是( )A、生活中加热煮沸降低水的硬度 B、工业上使用明矾对自来水消毒 C、农业上提倡大田漫灌浇灌作物 D、家庭中大力推广使用含磷洗涤剂7. 科学家利用“基因剪刀”技术降低了水稻中砷的含量。如图是砷元素在元素周期表中的信息及原子结构示意图。下列说法错误的是( )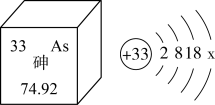 A、砷属于非金属元素 B、砷的原子序数为33 C、砷原子的相对原子质量为 D、 , 砷与磷元素化学性质相似8. 热爱劳动从我做起。对下列家务劳动中所涉及的化学知识叙述错误的是( )
A、砷属于非金属元素 B、砷的原子序数为33 C、砷原子的相对原子质量为 D、 , 砷与磷元素化学性质相似8. 热爱劳动从我做起。对下列家务劳动中所涉及的化学知识叙述错误的是( )选项
家务劳动
化学知识
A
洗洁精清洗餐具油污
洗洁精能溶解油污
B
熟石灰改良酸性土壤
酸与碱能发生中和反应
C
白醋除去水壶中的水垢
白醋可溶解碳酸钙等沉淀
D
冰箱内放置活性炭炭包
活性炭能吸附异味
A、A B、B C、C D、D9. 推理是学习化学常用的思维方法。下列有关说法正确的是( )A、金属阳离子带正电荷,则带正电荷的微观粒子都是金属阳离子 B、中和反应生成盐和水,则生成盐和水的反应一定是中和反应 C、碱溶液能使酚酞溶液变红,则能使酚酞溶液变红的溶液都是碱溶液 D、元素的种类由质子数决定,则质子数相同的原子一定属于同种元素10. 《神农本草经》记载,柳树的根、皮、枝、叶等有清热解毒功效,其有效成分为水杨酸。下列说法错误的是( )A、水杨酸属于有机物 B、一个水杨酸分子由16个原子构成 C、水杨酸由碳、氢、氧三种元素组成 D、水杨酸中碳、氢、氧三种元素的质量比为7:6:311. 某化学学习小组为探究铁丝生锈、铁丝燃烧的影响因素,进行如下实验(点燃操作已略去)。下列说法错误的是( ) A、对比①③可知:水是铁丝生锈的条件之一 B、对比①②可知:氧气是铁丝生锈的条件之一 C、对比②③可知:氧气是铁丝燃烧的条件之一 D、对比③④可知:铁丝形状能影响铁丝的燃烧
A、对比①③可知:水是铁丝生锈的条件之一 B、对比①②可知:氧气是铁丝生锈的条件之一 C、对比②③可知:氧气是铁丝燃烧的条件之一 D、对比③④可知:铁丝形状能影响铁丝的燃烧二、多选题
-
12. 化学技术驱动“碳达峰、碳中和”。转化为炭黑回收利用的反应机理如图所示,依次发生过程Ⅰ和Ⅱ,“→”表示从反应物到生成物。下列说法正确的是( )
 A、过程Ⅰ的化学方程式为 B、过程Ⅰ、Ⅱ中铁元素化合价均发生改变 C、为反应的催化剂 D、总反应可表示为13. 向两个盛有相同质量铝粉和铁粉的烧杯中,分别滴加相同浓度的稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示。下列说法正确的是( )
A、过程Ⅰ的化学方程式为 B、过程Ⅰ、Ⅱ中铁元素化合价均发生改变 C、为反应的催化剂 D、总反应可表示为13. 向两个盛有相同质量铝粉和铁粉的烧杯中,分别滴加相同浓度的稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示。下列说法正确的是( ) A、a点时,两个烧杯中的酸都恰好完全反应 B、b点时,两个烧杯中产生氢气的质量相同 C、c点时,两个烧杯中都有金属剩余 D、右侧曲线不能反映铁和铝的金属活动性强弱14. 下列实验操作不能达到实验目的的是( )
A、a点时,两个烧杯中的酸都恰好完全反应 B、b点时,两个烧杯中产生氢气的质量相同 C、c点时,两个烧杯中都有金属剩余 D、右侧曲线不能反映铁和铝的金属活动性强弱14. 下列实验操作不能达到实验目的的是( )选项
实验目的
主要实验操作
A
鉴别铵态氮肥和钾肥
取样,分别加入熟石灰混合研磨,闻气味
B
分离和粉末
滴加足量的稀盐酸,然后蒸发结晶
C
除去溶液中混有的
滴加过量溶液,过滤
D
检验溶液在空气中部分变质
滴加过量的溶液,静置,再向上层清液滴加酚酞
A、A B、B C、C D、D三、单选题
-
15. 某化学反应在密闭容器中进行,各物质的分子数目,质量随时间变化情况如图1,图2所示。下列说法错误的是( )
 A、Z一定属于化合物 B、参加反应的X与Y的质量比为3:14 C、反应前后分子总数不变 D、Y与Z的相对分子质量之比为28:17
A、Z一定属于化合物 B、参加反应的X与Y的质量比为3:14 C、反应前后分子总数不变 D、Y与Z的相对分子质量之比为28:17四、多选题
-
16. 如图为和两种物质的溶解度曲线。下列说法正确的是( )
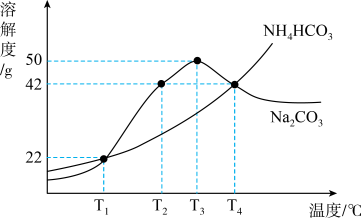 A、时,等质量的两物质饱和溶液升温到 , 为使两种溶液恰好饱和,所加固体质量相等 B、时,饱和溶液升温到 , 溶质质量分数变大 C、时,将固体加到水中,所得溶液质量为 D、时,将饱和溶液降温到 , 析出固体17. 向盛有一定质量和混合溶液的烧杯中,加入锌粉至过量使其充分反应(溶液始终未饱和),烧杯中溶质、溶剂和金属的质量随锌粉质量变化情况如图所示。下列说法正确的是( )
A、时,等质量的两物质饱和溶液升温到 , 为使两种溶液恰好饱和,所加固体质量相等 B、时,饱和溶液升温到 , 溶质质量分数变大 C、时,将固体加到水中,所得溶液质量为 D、时,将饱和溶液降温到 , 析出固体17. 向盛有一定质量和混合溶液的烧杯中,加入锌粉至过量使其充分反应(溶液始终未饱和),烧杯中溶质、溶剂和金属的质量随锌粉质量变化情况如图所示。下列说法正确的是( ) A、丙代表烧杯中金属质量 B、ab段发生反应: C、溶液质量: D、c点溶液一定是无色的
A、丙代表烧杯中金属质量 B、ab段发生反应: C、溶液质量: D、c点溶液一定是无色的五、填空题
-
18. 我国第一艘电磁弹射型航空母舰——“福建”舰已成功开展系泊试验,航空母舰的建造涉及金属冶炼,材料性能、生活医疗等诸多领域。回答下列问题:
 (1)、建造航空母舰需要大量的钢材。高炉炼铁中还原赤铁矿的化学方程式为。(2)、航母舰载机的玻璃钢雷达罩属于(填“合成材料”“金属材料”或“复合材料”)。纯铜可制作航母电缆,铜铝镍合金可制作飞机轴承,说明铜铝镍合金比纯铜的硬度(填“大”或“小”)。(3)、为防止患坏血病,远洋训练官兵在饮食中需要补充(填一种营养素);自热食品为远洋官兵提供了生活便利,某自热食品中的自热粉含有生石灰、碳酸钠、铝粉等,使用时只需加水即可自加热,放出热量的化合反应的化学方程式为。相同质量的生石灰和自热粉分别加入等质量的水时,温度随时间的变化曲线如图所示,请据图分析自热粉加热的优点(写一条即可)。(4)、多级闪急蒸馏是海水淡化方法之一。其原理是:通过对多级蒸发室不断减小压强,(填“升高”或“降低”)水的沸点,使海水不断气化、冷凝,最终得到蒸馏水。
(1)、建造航空母舰需要大量的钢材。高炉炼铁中还原赤铁矿的化学方程式为。(2)、航母舰载机的玻璃钢雷达罩属于(填“合成材料”“金属材料”或“复合材料”)。纯铜可制作航母电缆,铜铝镍合金可制作飞机轴承,说明铜铝镍合金比纯铜的硬度(填“大”或“小”)。(3)、为防止患坏血病,远洋训练官兵在饮食中需要补充(填一种营养素);自热食品为远洋官兵提供了生活便利,某自热食品中的自热粉含有生石灰、碳酸钠、铝粉等,使用时只需加水即可自加热,放出热量的化合反应的化学方程式为。相同质量的生石灰和自热粉分别加入等质量的水时,温度随时间的变化曲线如图所示,请据图分析自热粉加热的优点(写一条即可)。(4)、多级闪急蒸馏是海水淡化方法之一。其原理是:通过对多级蒸发室不断减小压强,(填“升高”或“降低”)水的沸点,使海水不断气化、冷凝,最终得到蒸馏水。六、实验题
-
19. 氧气、二氧化碳是航空母舰中的常用储备气体,在急救、灭火等方面具有重要的应用。气体的制备是初中化学实验重要的内容,请根据下列装置回答问题:
 (1)、仪器①的名称是。(2)、实验室利用装置A,选用氯酸钾和二氧化锰制取氧气,化学方程式为 , 实验结束后,从剩余固体中回收二氧化锰,有下列操作步骤;①过滤;②洗涤;③溶解;④干燥,正确的操作顺序是(填数字编号)。为检验二氧化锰是否洗涤干净,可向最后一次洗涤液中,滴加溶液(写试剂化学式),观察现象即可。(3)、实验室用装置B、C、D进行实验时,C中蜡烛燃烧更旺,D中溶液变浑浊,则B中产生的气体为 , 小试管的作用是。(4)、为制取二氧化碳,需将溶质质量分数为的浓盐酸稀释至 , 所加蒸馏水(密度为)的体积为。用装置E、F测量二氧化碳的体积时,若E中无植物油,则测得的二氧化碳的体积(填“偏大”“偏小”或“无影响”)。
(1)、仪器①的名称是。(2)、实验室利用装置A,选用氯酸钾和二氧化锰制取氧气,化学方程式为 , 实验结束后,从剩余固体中回收二氧化锰,有下列操作步骤;①过滤;②洗涤;③溶解;④干燥,正确的操作顺序是(填数字编号)。为检验二氧化锰是否洗涤干净,可向最后一次洗涤液中,滴加溶液(写试剂化学式),观察现象即可。(3)、实验室用装置B、C、D进行实验时,C中蜡烛燃烧更旺,D中溶液变浑浊,则B中产生的气体为 , 小试管的作用是。(4)、为制取二氧化碳,需将溶质质量分数为的浓盐酸稀释至 , 所加蒸馏水(密度为)的体积为。用装置E、F测量二氧化碳的体积时,若E中无植物油,则测得的二氧化碳的体积(填“偏大”“偏小”或“无影响”)。七、填空题
-
20. 氢能助力“神舟十六”邀游太空,氢氧燃料电池技术在航海、航空航天等方面发展迅速,图1是氢气的制取、储存、释放和应用的流程图。


请回答下列问题:
(1)、利用太阳光和催化剂可实现水的高效分解。图2为光解制氢的微观模型图,写出反应Ⅰ的化学方程式。(2)、气态储氢是将氢气压缩存储于高压罐中,请从微观角度分析氢气能被压缩的原因。(3)、固态储氢是通过合金材料在一定条件下的化学吸附储氢。图1利用镁镍合金()存储氢气,该储氢反应的化学方程式为。在熔炼镁镍合金时,需要通入氩气作保护气,目的是。(4)、氢氧燃料电池的总反应可表示为 , 工作过程中的能量转化形式是。21. “宏观—微观—符号”是化学独特的表示物质及其变化的方法。请从不同角度完成对性质的学习。 (1)、的水溶液 , 在物质的分类中属于(填“碱”“盐”或“氧化物”)。医疗上用于治疗胃酸过多症,请根据图1分析该反应的微观实质。(2)、图2是向溶液滴加溶液的微观示意图,请分析并推测:向溶液中滴加溶液,观察到的实验现象为。(3)、灭火器是航母上的必备用品。泡沫灭火器的原料之一是 , 其反应原理为 , X的化学式为 , 从微观角度分析,反应后溶液中减少的离子是(用符号表示)。(4)、受热易分解产生和两种常见氧化物,化学方程式为。
(1)、的水溶液 , 在物质的分类中属于(填“碱”“盐”或“氧化物”)。医疗上用于治疗胃酸过多症,请根据图1分析该反应的微观实质。(2)、图2是向溶液滴加溶液的微观示意图,请分析并推测:向溶液中滴加溶液,观察到的实验现象为。(3)、灭火器是航母上的必备用品。泡沫灭火器的原料之一是 , 其反应原理为 , X的化学式为 , 从微观角度分析,反应后溶液中减少的离子是(用符号表示)。(4)、受热易分解产生和两种常见氧化物,化学方程式为。
【结论】既能与酸反应,也能与碱反应,还能与部分盐反应,且受热不稳定。(5)、【应用】
溶液中存在和 , 下列物质不能与其发生反应的是____(填字母序号)。A、石灰水 B、食醋 C、纯碱 D、食盐八、流程题
-
22. 稀土被称为“工业维生素”,能显著提升建造航母及舰载机的材料性能,含有稀土元素钇的氧化钇()被广泛应用于航空航天涂层材料。以富钇稀土矿(主要成分为 , 含有少量的等杂质)生产氧化钇的工艺流程如下,回答下列问题:
 (1)、在粉碎机中研磨粉碎的目的是。(2)、操作Ⅰ的名称是 , “酸溶”过程中,发生反应的化学方程式为。(3)、向反应釜2中通入气体X使溶液呈碱性,调节溶液的pH除去滤液Ⅰ中杂质,沉淀Ⅱ的主要成分是(填化学式)。
(1)、在粉碎机中研磨粉碎的目的是。(2)、操作Ⅰ的名称是 , “酸溶”过程中,发生反应的化学方程式为。(3)、向反应釜2中通入气体X使溶液呈碱性,调节溶液的pH除去滤液Ⅰ中杂质,沉淀Ⅱ的主要成分是(填化学式)。沉淀池中“沉钇”过程有等物质产生,“沉钇”的化学方程式为。
(4)、流程中可循环使用的物质为(填化学式)。九、科学探究题
-
23. 镁被誉为“国防金属”,在航空母舰、舰载机,导弹等武器中应用广泛。某化学学习小组观察镁与硫酸铜溶液反应时,产生大量无色气体,同时有蓝绿色不溶物和棕褐色不溶物生成。学习小组对生成物展开以下探究:
【实验一】探究无色气体的成分
【查阅资料】部分盐溶于水后,能与水分子作用解离出或 , 使溶液显酸性或碱性。
【作出猜想】根据文献资料和元素守恒,对气体成分作出如下猜想:猜想1;;猜想2:;猜想3:。
【实验探究】小组成员按如图装置进行实验:
实验步骤
实验现象
实验结论
①扇闻导管口气体的气味
无明显气味
猜想1不成立
②
带火星的木条不复燃
猜想2不成立
③用燃着的木条靠近肥皂泡
肥皂泡破裂,燃烧,发出爆鸣声
猜想3成立
【深化探究】分别测量上述硫酸铜溶液和相同溶质质量分数的硫酸钠溶液的 , 发现硫酸铜溶液的 , 硫酸钠溶液的。
【结论】硫酸铜溶液显酸性,是由(填微粒符号)与水分子相互作用的结果;金属镁能与溶液中的反应生成。
【实验二】探究蓝绿色不溶物的成分
【查阅资料】碱式碳酸铜为绿色固体,不溶于水但能溶于酸。
【作出猜想】猜想1:;猜想2:;猜想3:和。
【实验探究】向蓝绿色不溶物滴加足量稀硫酸,不溶物溶解,无气泡产生。则猜想(填数字)错误。小明同学结合初中所学知识,认为猜想1也不合理,理由是。
【查阅资料】某种碱式硫酸铜为蓝绿色固体,不溶于水能溶于酸。
【设计实验】请你帮助小明设计方案,验证蓝绿色不溶物中含有。简述实验操作及现象(可供选择的试剂:稀盐酸,稀硫酸,溶液):。
【实验三】探究棕褐色不溶物的成分
【查阅资料】
①棕褐色不溶物成分较为复杂,为和中的不确定组成;
②不溶于水,能与稀硫酸发生反应:。
【实验探究】取少量棕褐色不溶物于试管中,滴加稀硫酸至过量,溶液变蓝,试管底部有亮红色固体。
【交流讨论】对棕褐色不溶物成分的推测较多,以下为其中两位同学的讨论:甲同学认为一定有 , 乙同学反对该观点,认为没有 , 而是(填化学式),也能产生上述实验现象,理由是(结合化学方程式和必要的文字说明)。

十、计算题
-
24. 航母舰体需要定期除锈维护,为实现对除锈废液(溶质主要成分为、其他杂质忽略)的综合利用,需测定废液中的质量分数,取废液样品,依次加入溶质质量分数相同的溶液,过滤,称重,相关数据如图。

回答下列问题:
(1)、第③次过滤后,滤液中溶质的成分为(用化学式表示)。(2)、所用溶液溶质的质量分数(写出计算过程)。(3)、废液样品中的质量分数为(结果精确至0.1%)。
-
-
-
-
-