2023-2024学年高中化学必修第一册4.3化学键(人教版)
试卷更新日期:2023-07-27 类型:同步测试
一、选择题
-
1. 近期科学家首次用X射线激光技术观察到CO与O2在催化剂表面生成CO2的历程(部分微粒未画出)。反应过程如图,下列说法正确的是( )
 A、状态Ⅰ→状态Ⅱ发生了化学变化 B、CO2是具有极性共价键的直线型分子 C、CO和O生成CO2的过程不涉及电子转移 D、状态Ⅲ→状态Ⅴ表示CO与O2的反应2. 下列说法正确的是( )A、He、Ne、Ar都是由分子构成的,但分子内部不存在共价键 B、碘单质升华过程中,吸收的热量用于克服碘原子之间的共价键 C、固体NaCl属于离子化合物,和之间通过静电引力形成离子键 D、HCl和分子中,各原子最外层都达到了8电子稳定结构3. 下列说法不正确的是( )A、非金属元素的原子间不能形成离子化合物 B、HCl、HBr和HI的稳定性依次减弱 C、氯化氢气体溶于水共价键被破坏 D、干冰由固态变为气态,分子间作用力被破坏4. 下列说法错误的是( )A、二氧化硅可用来制造光导纤维 B、溶于水和干冰升华都只有分子间作用力改变 C、氯气、臭氧、二氧化氯都可用于饮用水的消毒 D、黏胶纤维中的长纤维一般称为人造丝,短纤维称为人造棉,都可用于纺织工业5. 下列叙述与范德华力无关的是( )A、气体物质加压或降温时能凝结或凝固 B、氯化钠的熔点较高 C、干冰易升华,固体不易升华 D、熔、沸点高低:6. 目前,科学家发现在负压和超低温条件下,可将水形成像棉花糖一样的气溶胶的冰,该冰称为“气态冰”。下列说法不正确的是( )A、该冰具有丁达尔效应 B、“气态冰”与普通冰化学性质相同 C、18g“气态冰”在标准状况下的体积等于22.4L D、“气态冰”分子中存在极性共价键7. 下列说法正确的是 ( )A、键角决定了分子的空间结构 B、共价键的键能越大,共价键越牢固,含有该键的分子越稳定 C、CH4、CCl4中键长相等,键角不同 D、的键能是的键能的两倍8. 下列说法正确的是 ( )
A、状态Ⅰ→状态Ⅱ发生了化学变化 B、CO2是具有极性共价键的直线型分子 C、CO和O生成CO2的过程不涉及电子转移 D、状态Ⅲ→状态Ⅴ表示CO与O2的反应2. 下列说法正确的是( )A、He、Ne、Ar都是由分子构成的,但分子内部不存在共价键 B、碘单质升华过程中,吸收的热量用于克服碘原子之间的共价键 C、固体NaCl属于离子化合物,和之间通过静电引力形成离子键 D、HCl和分子中,各原子最外层都达到了8电子稳定结构3. 下列说法不正确的是( )A、非金属元素的原子间不能形成离子化合物 B、HCl、HBr和HI的稳定性依次减弱 C、氯化氢气体溶于水共价键被破坏 D、干冰由固态变为气态,分子间作用力被破坏4. 下列说法错误的是( )A、二氧化硅可用来制造光导纤维 B、溶于水和干冰升华都只有分子间作用力改变 C、氯气、臭氧、二氧化氯都可用于饮用水的消毒 D、黏胶纤维中的长纤维一般称为人造丝,短纤维称为人造棉,都可用于纺织工业5. 下列叙述与范德华力无关的是( )A、气体物质加压或降温时能凝结或凝固 B、氯化钠的熔点较高 C、干冰易升华,固体不易升华 D、熔、沸点高低:6. 目前,科学家发现在负压和超低温条件下,可将水形成像棉花糖一样的气溶胶的冰,该冰称为“气态冰”。下列说法不正确的是( )A、该冰具有丁达尔效应 B、“气态冰”与普通冰化学性质相同 C、18g“气态冰”在标准状况下的体积等于22.4L D、“气态冰”分子中存在极性共价键7. 下列说法正确的是 ( )A、键角决定了分子的空间结构 B、共价键的键能越大,共价键越牢固,含有该键的分子越稳定 C、CH4、CCl4中键长相等,键角不同 D、的键能是的键能的两倍8. 下列说法正确的是 ( )①共价键的特征是具有饱和性和方向性
②共价化合物中一定含共价键,一定不含离子键
③H2O的非直线结构是由共价键的饱和性决定的
④分子中不一定存在共价键
⑤烯烃比烷烃的化学性质活泼是由于烷烃中的σ键比烯烃中的σ键稳定
A、①②④ B、①⑤ C、②③④ D、①③⑤二、多选题
-
9. 为实现“碳中和”,的再利用非常关键,据文献报道与可在催化下生成 , 其反应机理如下图。下列说法正确的是( )
 A、过程中只涉及极性键的断开与形成 B、反应过程中,既有氧化还原反应,又有非氧化还原反应 C、图中涉及碳的价态没有发生变化 D、总反应为10. 短周期主族元素W、Q、X、Y、Z的原子序数依次增大;灰黑色晶体Y的导电性介于导体和绝缘体之间,一种制备晶体Y的路线如图所示,通常状态下YW4呈气态且W的单质是最清洁能源。
A、过程中只涉及极性键的断开与形成 B、反应过程中,既有氧化还原反应,又有非氧化还原反应 C、图中涉及碳的价态没有发生变化 D、总反应为10. 短周期主族元素W、Q、X、Y、Z的原子序数依次增大;灰黑色晶体Y的导电性介于导体和绝缘体之间,一种制备晶体Y的路线如图所示,通常状态下YW4呈气态且W的单质是最清洁能源。YQ2X2YYW4Y的单质
下列说法正确的是
A、常温下,W与Q形成的化合物为液态 B、X的最高价氧化对应的水化物是强酸 C、ZQ2可用于自来水消毒 D、YW4中仅含离子键11. 下列有关叙述正确的是A、在BCl3分子中,所有原子都满足最外层8电子结构 B、核外电子排布完全相同的两种微粒,其化学性质一定相同 C、已知NaH是离子化合物,则其电子式是Na+[:H]- D、NaCl晶体中,每个Na+同时吸引6个Cl-12. 下列物质之需克服范德华力,就可气化的是( )A、液态氮 B、液态氟化氢 C、液态氨 D、干冰13. X、Y、Z、W为原子序数依次增大的短周期元素,X元素与Y、Z元素相邻,Y元素的最高价氧化物对应的水化物和其气态氢化物反应生成一种盐M,W元素形成的单质在常温下为气体。下列说法错误的是( )A、W元素的最高价态为+7价 B、M中含有的化学键包括离子键、共价键、配位键和氢键 C、RO2(R=X、Y、Z、W)的晶体类型相同 D、最高价氧化物对应水化物的酸性:Y>X>Z14. 如图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子价电子数的3倍。下列说法正确的是( ) A、X和Z的最高化合价均为+7价 B、HX和HZ在水中均为强酸,电子式可表示为
A、X和Z的最高化合价均为+7价 B、HX和HZ在水中均为强酸,电子式可表示为 与
与  C、四种元素中,Y原子半径最大,X原子半径最小
D、Z、W和氢三种元素可形成同时含有离子键和共价键的化合物
15. 短周期主族元素 、 、 、 的原子序数依次增大, 的阴离子与锂离子具有相同的电子层结构, 的一种核素常用于考古断代, 原子的最外层电子数是内层电子数的3倍, 、 、 原子的最外层电子数总和等于 的原子序数。下列推断错误的是( )A、原子半径: B、化合物 中既含离子键又含共价键 C、最简单气态氢化物的稳定性: D、由上述四种元素组成的化合物的水溶液不可能呈碱性
C、四种元素中,Y原子半径最大,X原子半径最小
D、Z、W和氢三种元素可形成同时含有离子键和共价键的化合物
15. 短周期主族元素 、 、 、 的原子序数依次增大, 的阴离子与锂离子具有相同的电子层结构, 的一种核素常用于考古断代, 原子的最外层电子数是内层电子数的3倍, 、 、 原子的最外层电子数总和等于 的原子序数。下列推断错误的是( )A、原子半径: B、化合物 中既含离子键又含共价键 C、最简单气态氢化物的稳定性: D、由上述四种元素组成的化合物的水溶液不可能呈碱性三、非选择题
-
16. 在下列变化中:①I2升华;②烧碱熔化;③NaCl溶于水;④HCl溶于水;⑤O2溶于水;⑥Na2O2溶于水,未发生化学键破坏的是 , 仅发生离子键破坏的是 , 仅发生共价键破坏的是 , 既发生离子键破坏,又发生共价键破坏的是。17. 请回答下列问题:(1)、31Ga基态原子的核外电子排布式是 , 某种半导体材料由Ga和As两种元素组成,该半导体材料的化学式是 , 其晶体结构类型可能为 .(2)、维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构式如图所示:以下关于维生素B1的说法正确的是 .

a.只含σ键和π键
b.既有共价键又有离子键
c.该物质的熔点可能高于NaCl
d.既含有极性键又含有非极性键
(3)、维生素B1晶体溶于水的过程中要克服的微粒间的作用力有 .A、离子键、共价键 B、离子键、氢键、共价键 C、氢键、范德华力 D、离子键、氢键、范德华力.18. 153年前门捷列夫制得世界上第一张元素周期表,它反映了元素之间的内在联系,是对元素的一种很好的自然分类。如图为现代元素周期表的一部分,请回答下列问题:(以下问题均用相应的化学用语表达)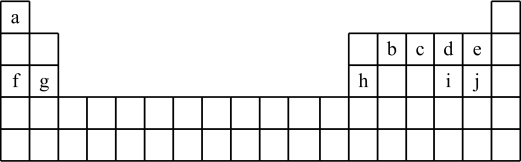 (1)、在这10种元素中,非金属性最强的元素在周期表中的位置是。(2)、由a、d、f三种元素形成的化合物含有的化学键有(填写化学键类型),属于化合物。(3)、元素b、c形成的简单气态氢化物中较稳定的是;d、h、i、j的简单离子半径由大到小的顺序排列为。(4)、用电子式表示c2的形成过程。(5)、在含有a、g、h简单阳离子的100mL溶液中,逐滴滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。由图中数据分析计算:
(1)、在这10种元素中,非金属性最强的元素在周期表中的位置是。(2)、由a、d、f三种元素形成的化合物含有的化学键有(填写化学键类型),属于化合物。(3)、元素b、c形成的简单气态氢化物中较稳定的是;d、h、i、j的简单离子半径由大到小的顺序排列为。(4)、用电子式表示c2的形成过程。(5)、在含有a、g、h简单阳离子的100mL溶液中,逐滴滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。由图中数据分析计算:
①沉淀减少时发生的离子方程式:。
②a点的数值为:mL。
19. 随着原子序数的递增,8种短周期元素原子半径的相对大小、最高正化合价或最低负化合价如图所示。请用相应的化学用语回答下列问题: (1)、元素F在元素周期表中的位置是。(2)、元素D、G的简单气态氢化物中,热稳定性较差的是(填化学式)。元素G、H的最高价氧化物的水化物中,酸性较强的是。(填化学式)(3)、化合物BD2所含的化学键类型是。由固态变为气态克服的微粒间作用力是。(4)、化合物E3C遇水反应生成氨气(NH3)和一种强碱,反应的化学方程式为 , 氮气(NH3)的电子式为。20. W、Q、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19,W只有一个电子层,Q与X、Y、Z位于不同周期,X、Y相邻,Y原子最外层电子数是Q原子内层电子数的2倍,仅由Z元素形成的固体在常温下为淡黄色。回答下列问题:(1)、Y在元素周期表中的位置为。(2)、最简单氢化物的沸点:Q(填“>”、“<”或“=”)Z。(3)、写出X元素形成的单质与Q的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式:。(4)、仅由W、Q、Z三种元素可形成化合物和:
(1)、元素F在元素周期表中的位置是。(2)、元素D、G的简单气态氢化物中,热稳定性较差的是(填化学式)。元素G、H的最高价氧化物的水化物中,酸性较强的是。(填化学式)(3)、化合物BD2所含的化学键类型是。由固态变为气态克服的微粒间作用力是。(4)、化合物E3C遇水反应生成氨气(NH3)和一种强碱,反应的化学方程式为 , 氮气(NH3)的电子式为。20. W、Q、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19,W只有一个电子层,Q与X、Y、Z位于不同周期,X、Y相邻,Y原子最外层电子数是Q原子内层电子数的2倍,仅由Z元素形成的固体在常温下为淡黄色。回答下列问题:(1)、Y在元素周期表中的位置为。(2)、最简单氢化物的沸点:Q(填“>”、“<”或“=”)Z。(3)、写出X元素形成的单质与Q的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式:。(4)、仅由W、Q、Z三种元素可形成化合物和:①化合物的名称为 , 该化合物中Q元素的化合价为价。
②化合物含有化学键的类型为(填“离子键”、“共价键”或“离子键与共价键”)。
(5)、化合物与热水反应仅生成X的最高价氧化物对应的水化物和一种具有臭鸡蛋气味的气体,写出其化学方程式:。(6)、可用作火箭的燃料,1 mol 中所含的电子总数为。21. 氧、硫、硒(Se)、碲(Te)、钋(Po)为元素周期表中原子序数依次增大的同族元素。回答下列问题:(1)、硒(Se)的原子结构示意图为。(2)、氧和硫的氢化物性质的比较:①热稳定性:H2OH2S(填“>”或“<”),判断依据是。
②沸点:H2OH2S(填“>”或“<”),判断依据是。
(3)、H2O与NH3反应产物中所含化学键类型为;H2S与NH3反应的产物中所含化学键类型为(填离子键或共价键)。(4)、钠的硫化物Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4 , 而NaClO 被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶13,则x的值为。22. 有下列七种物质:A、干冰 B、氧化镁 C、氯化铵 D、固态碘 E、烧碱 F、冰 G、过氧化钾(1)、熔化时需要破坏共价键和离子键的是(填序号,下同);(2)、既有离子键又有共价键的是;(3)、只含有极性键的是;(4)、含非极性键的是。23. 现有下列物质:①N2②Na2O2③MgF2④NH4Cl⑤Na2CO3⑥NaOH⑦HCl⑧H2O2
(1)、属于离子化合物的物质是。(2)、属于共价化合物的物质是。(3)、只由非极性键构成的物质是。(4)、由离子键和极性键构成的物质是。(5)、由极性键和非极性键构成的物质是。24. 下表是元素周期表前20号元素的有关信息:元素
a
b
c
d
e
f
g
h
原子半径()
0.030
0.066
0.117
0.232
0.106
0.186
0.143
0.099
最高正化合价
最低负化合价
已知:的半径为 , 的半径为
回答下列问题:
(1)、元素e在周期表中的位置 , 元素y与e同主族且多一电子层,y的原子结构示意图为。(2)、c、d、g原子半径由大到小的顺序为(填元素符号)。(3)、f的单质与b的常见单质加热条件下反应,产物中含有的化学键类型为。(4)、 溶液中先加入d元素最高价氧化物对应的水化物,再通入 , 可观察到的现象是 , 发生反应的离子方程式为。25. 下表列出了①~⑥六种元素在周期表中的位置。族
周期
ⅠA
0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
3
③
④
⑤
⑥
回答下列问题:(用化学用语填空)
(1)、元素①的一种核素中,含有1个质子和1个中子,表示该核素组成的符号是。(2)、元素⑤的原子结构示意图是。(3)、上述元素中,原子半径最大的是(填元素符号)。(4)、由元素①、⑥组成的化合物的电子式为 , 该化合物分子中含有(填“极性”或“非极性”)共价键。(5)、元素⑤和⑥最高价氧化物对应的水化物酸性强的是(填化学式)。(6)、金属性:③④(填“>”或“<”),它们的最高价氧化物对应的水化物反应的离子方程式为。(7)、下列说法正确的是(填序号)。a.元素②、③组成的化合物只有一种
b.元素②的气态氢化物稳定性高于元素⑤的气态氢化物
c.元素⑥在化合物中呈现的最高化合价为+7价
26. 食品添加剂中可能存在的部分短周期元素的最高正化合价或最低负化合价与原子序数的关系如下图所示。已知:x为非金属元素,d元素的最外层电子数为内层电子数的3倍。 (1)、x、e、d三种元素形成的离子化合物的电子式为。(2)、图中g元素所在元素周期表中的位置 , f元素形成的最高价氧化物与NaOH溶液反应的离子方程式为。元素h的气态氢化物稳定性比元素g的气态氢化物稳定性(填“强”或“弱”)。(3)、d、e、f、g元素的简单离子半径由大到小的顺序为(用化学式表示)。(4)、x和d组成的化合物中,既含有极性共价键又含有非极性共价键的是(填化学式)。(5)、一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子,其中Z元素的化合价为 , 写出分子的结构式。
(1)、x、e、d三种元素形成的离子化合物的电子式为。(2)、图中g元素所在元素周期表中的位置 , f元素形成的最高价氧化物与NaOH溶液反应的离子方程式为。元素h的气态氢化物稳定性比元素g的气态氢化物稳定性(填“强”或“弱”)。(3)、d、e、f、g元素的简单离子半径由大到小的顺序为(用化学式表示)。(4)、x和d组成的化合物中,既含有极性共价键又含有非极性共价键的是(填化学式)。(5)、一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子,其中Z元素的化合价为 , 写出分子的结构式。 27. 一种分子式为C4H10的物质叫丁烷,是一次性打火机里的燃料,通常情况下呈气态。常温下,用压缩体积的方法使它液化后可储存在打火机里。常温下,用压缩体积的方法使丁烷液化。请回答:(1)、有关说法正确的是____。A、液化过程中丁烷分子数增加| B、分子间作用力:气态丁烷>液态丁烷 C、1mol气态丁烷所占体积约为22.4L D、压缩过程中丁烷分子间距离减小(2)、如果打火机不小心摔坏,其中液体刚消失时,立刻捡起残骸,会感觉残骸较冷。原因是液态丁烷变为气态时要迅速(选填“吸收”、“放出”)大量的热。这一过程物理学中称为。
27. 一种分子式为C4H10的物质叫丁烷,是一次性打火机里的燃料,通常情况下呈气态。常温下,用压缩体积的方法使它液化后可储存在打火机里。常温下,用压缩体积的方法使丁烷液化。请回答:(1)、有关说法正确的是____。A、液化过程中丁烷分子数增加| B、分子间作用力:气态丁烷>液态丁烷 C、1mol气态丁烷所占体积约为22.4L D、压缩过程中丁烷分子间距离减小(2)、如果打火机不小心摔坏,其中液体刚消失时,立刻捡起残骸,会感觉残骸较冷。原因是液态丁烷变为气态时要迅速(选填“吸收”、“放出”)大量的热。这一过程物理学中称为。A.液化 B.汽化 C.挥发 D.升华
(3)、北京冬奥会火炬使用的燃料是氢气,彰显绿色低碳。相同状况下,1molH2和1molC4H10气体体积大致相等。试从微观角度解释原因。28. 氧、碳等非金属元素形成的物质种类繁多、性状各异。(1)、氧、氟、氮三种元素都可形成简单离子,它们的离子半径最小的是(填离子符号),硅元素在元素周期表中的位置是。CO2和SiO2是同一主族元素的最高正价氧化物,常温下CO2为气体,SiO2为高熔点固体。请分析原因:。(2)、比较硫和氯性质的强弱。热稳定性H2SHCl(选填“<”、“>”或“=”,下同);酸性:HClO4H2SO4。用一个离子方程式说明氯元素和硫元素非金属性的相对强弱:。(3)、红酒中添加一定量的SO2 可以防止酒液氧化,这利用了SO2 的性。若将SO2气体通入H2S水溶液中直至过量,下列表示溶液的pH随通入SO2气体体积变化的示意图正确的是(填序号)。
已知NaHSO3溶液呈酸性,而HSO 既能电离又能水解。则在NaHSO3溶液中c(H2SO3)c(SO )(选填“<”、“>”或“=”) 。
(4)、亚硫酸钠和碘酸钾在酸性条件下反应生成硫酸钠、硫酸钾、碘和水,配平该反应方程式_Na2SO3+_KIO3+_H2SO4 _Na2SO4+_K2SO4+_I2+_ H2O
29. 分子间的作用力比化学键 , 分子间作用力的大小可以影响到某些物质的 高低.①像 、 、 这样分子之间存在着一种比 的相互作用,使它们只能在较高的温度下才能汽化,这种相互作用叫做氢键.
②分子间形成的氢键会使物质的熔点和沸点 , 这是因为固体熔化或液体汽化时必须破坏分子间的氢键,消耗更多的能量.
③氢键的本质: 形成条件:
30. ①分子之间存在着一种把分子 叫做分子间作用力,又称 .②分子间作用力比化学键 , 它主要影响物质的 、 、 等物理性质,化学键属分子内作用力,主要影响物质的化学性质.
③一般来说,对于组成和结构相似的物质, 越大,分子间作用力 , 物质的熔点、沸点也越 .
④分子间作用力只存在于由分子组成的共价化合物、共价单质和稀有气体的分子之间.在离子化合物、金属单质、金刚石、晶体硅、二氧化硅等物质中只有化学键,没有分子间作用力.