2023-2024学年高中化学必修第一册4.2元素周期律(人教版)
试卷更新日期:2023-07-27 类型:同步测试
一、选择题
-
1. 元素周期表的建立成为化学发展史上的重要里程碑之一。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
X
W
Y
Z
A、原子半径:W>X B、非金属性:Z>Y C、气态氢化物的稳定性:Y>X D、Z的最高价氧化物对应的水化物是强酸2. 下表是部分短周期元素的原子半径及主要化合价,请判断以下叙述正确的是( )元素代号
a
b
c
d
e
原子半径/nm
0.130
0.118
0.090
0.037
0.073
主要化合价
+2
+3
+2
+1
-2
A、简单离子半径:a>e B、在相同条件下,单质与同浓度的稀盐酸反应的剧烈程度为:b>a C、由a、b形成的合金熔点比a单质的低,硬度比a单质的大 D、e单质与d单质化合生成一种常见液体的过程有非极性键的断裂与形成3. 中国国家航天局公布了由“祝融号”火星车拍摄的科学影像图,发现火星岩石中富含X、Y、Z、W四种短周期元素,其原子序数递增。Y是地球地壳中含量最高的元素,Z的原子半径是所有短周期主族元素中最大的,X、W同主族,且X、Z、W原子的最外层电子数之和为9。下列叙述正确的是( )A、简单离子半径: Y<Z B、Y、Z、W形成的盐溶液呈碱性 C、氢化物的沸点: X一定低于Y D、X与W形成WX是离子化合物4. 短周期元素R、X、Y、Z、M原子序数依次递增,原子最外层电子数存在关系: , 其中元素R、X、Y、M形成的化合物(结构式)具有如图所示转化关系。下列说法正确的是( ) A、原子半径: B、M在同周期的元素中,第一电离能最大 C、R、X、Y形成的化合物可能会使酸性高锰酸钾溶液褪色 D、Z分别与R、Y、M形成的化合物中均只含离子键5. 短周期元素W、X、Y和Z的原子序数依次增大。基态W原子核外电子只有一种运动状态,基态X原子2p能级上有一对成对电子,Y是电负性最大的元素,X、Z同主族,室温下化合物ZY4是气体。下列说法正确的是( )A、简单离子半径:Z>Y>X B、W2X和ZX2的中心原子均为sp2杂化 C、W2X的沸点高于W2Z的沸点 D、ZY4分子中所有原子均为8电子结构6. 2022年诺贝尔化学奖授予对点击化学和生物正交化学做出贡献的三位化学家,某应用于点击反应切块的高效化合物的结构简式如图所示,其中X、Y、Z、W是原子序数依次增大的短周期元素。下列说法正确的是
A、原子半径: B、M在同周期的元素中,第一电离能最大 C、R、X、Y形成的化合物可能会使酸性高锰酸钾溶液褪色 D、Z分别与R、Y、M形成的化合物中均只含离子键5. 短周期元素W、X、Y和Z的原子序数依次增大。基态W原子核外电子只有一种运动状态,基态X原子2p能级上有一对成对电子,Y是电负性最大的元素,X、Z同主族,室温下化合物ZY4是气体。下列说法正确的是( )A、简单离子半径:Z>Y>X B、W2X和ZX2的中心原子均为sp2杂化 C、W2X的沸点高于W2Z的沸点 D、ZY4分子中所有原子均为8电子结构6. 2022年诺贝尔化学奖授予对点击化学和生物正交化学做出贡献的三位化学家,某应用于点击反应切块的高效化合物的结构简式如图所示,其中X、Y、Z、W是原子序数依次增大的短周期元素。下列说法正确的是 A、离子半径:Z>Y B、第一电离能:X>Y C、简单氢化物的沸点:W>Y D、简单氢化物的还原性:Z>W
A、离子半径:Z>Y B、第一电离能:X>Y C、简单氢化物的沸点:W>Y D、简单氢化物的还原性:Z>W二、多选题
-
7. 短周期元素X、Y、Z、M原子序数依次增大,它们组成一种团簇分子,结构如图所示。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的。下列说法正确的是( )
 A、简单离子半径:Y>Z>M B、常温下Z和M的单质均能溶于浓硝酸 C、X+与Y结合形成的化合物是离子晶体 D、Z的最高价氧化物的水化物碱性强于M的最高价氧化物的水化物碱性8. 短周期元素W、X、Y、Z的原子序数依次增大。W位于s区,其基态原子的电子层数和未成对电子数相等;X的基态原子的电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;Z的基态原子的核外成对电子数是未成对电子数的3倍。下列说法错误的是( )A、W分别与X、Y、Z结合,均能形成10电子分子 B、X、Y的单质分别与Z2发生化合反应均能获得两种不同的产物 C、化合物YZ中Y的化合价为+2价 D、W2Z和YZ2反应能生成强酸,因此YZ2是酸性氧化物9. 短周期主族元素X、Y、Z、W在元素周期表中的位置如图所示,Y原子最外层电子数是其电子层数的3倍。下列关于这四种元素及其化合物的说法中正确的是( )
A、简单离子半径:Y>Z>M B、常温下Z和M的单质均能溶于浓硝酸 C、X+与Y结合形成的化合物是离子晶体 D、Z的最高价氧化物的水化物碱性强于M的最高价氧化物的水化物碱性8. 短周期元素W、X、Y、Z的原子序数依次增大。W位于s区,其基态原子的电子层数和未成对电子数相等;X的基态原子的电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;Z的基态原子的核外成对电子数是未成对电子数的3倍。下列说法错误的是( )A、W分别与X、Y、Z结合,均能形成10电子分子 B、X、Y的单质分别与Z2发生化合反应均能获得两种不同的产物 C、化合物YZ中Y的化合价为+2价 D、W2Z和YZ2反应能生成强酸,因此YZ2是酸性氧化物9. 短周期主族元素X、Y、Z、W在元素周期表中的位置如图所示,Y原子最外层电子数是其电子层数的3倍。下列关于这四种元素及其化合物的说法中正确的是( ) A、X、Y、Z、W中可能存在金属元素 B、化合物ZW2分子中所有原子都达到8电子稳定结构 C、气态氢化物的稳定性:Z>W>X>Y D、Y、Z可形成具有漂白性的化合物10. 部分短周期元素的原子半径及主要化合价见下表。
A、X、Y、Z、W中可能存在金属元素 B、化合物ZW2分子中所有原子都达到8电子稳定结构 C、气态氢化物的稳定性:Z>W>X>Y D、Y、Z可形成具有漂白性的化合物10. 部分短周期元素的原子半径及主要化合价见下表。元素
X
Y
Z
W
T
原子半径/nm
0.152
0.186
0.066
0.102
0.099
最外层电子数
1
1
6
6
7
下列有关说法正确的是( )
A、简单离子的半径:Y>Z>X B、气态氢化物的热稳定性:W>Z C、Y与Z形成的化合物可能具有强氧化性 D、常温下,W单质的分子间作用力小于T单质11. Q、X、Y、Z、W是原子序数依次增大的短周期主族元素,其最外层电子数之和为26,Q与X、Y、Z、W位于不同周期,X、Y相邻,Y原子最外层电子数是Q原子内层电子数的2倍,W的一种气态氧化物是高效消毒剂。下列说法正确的是( )A、简单化物的稳定性:Z<Q B、Q与Z一定位于同一主族 C、最高价氧化物的水化物的酸性:Z>Y D、工业上常用电解X与W形成的化合物水溶液的方法制备X单质12. 一种抗甲状腺药物结构简式如图所示,其中W、X、Y、Z为原子序数依次增大的短周期元素,分别位于三个周期,原子序数 , 下列说法错误的是( ) A、原子半径: B、Y和Z的最高价含氧酸均为强酸 C、W和Y形成的化合物中只含共价键 D、该物质中Y为杂化13. 短周期主族元素W、X、Y、Z的原子序数依次增大,且位于同一周期,W、X的核电荷数之和等于Z的核外电子总数,由这四种元素组成的化合物(M)的结构如图所示。下列推断错误的是( )
A、原子半径: B、Y和Z的最高价含氧酸均为强酸 C、W和Y形成的化合物中只含共价键 D、该物质中Y为杂化13. 短周期主族元素W、X、Y、Z的原子序数依次增大,且位于同一周期,W、X的核电荷数之和等于Z的核外电子总数,由这四种元素组成的化合物(M)的结构如图所示。下列推断错误的是( )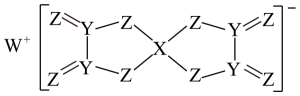 A、原子半径:W>X>Y>Z B、最简单氢化物的稳定性:Z>Y C、熔点:W2Z<YZ D、M中所有原子均达到8电子结构
A、原子半径:W>X>Y>Z B、最简单氢化物的稳定性:Z>Y C、熔点:W2Z<YZ D、M中所有原子均达到8电子结构三、非选择题
-
14. 海洋是巨大的化学资源宝库。从海水中可以制取氯、溴、镁等多种化工产品。(1)、在元素周期表中的位置是第周期、第族。(2)、的最高价氧化物对应的水化物为 , 其中溴元素的化合价是 , 的酸性比的酸性(填“强”或“弱”)。(3)、金属性强于用原子结构解释原因:和位于同一周期,原子核外电子层数相同, , 原子半径大于 , 失电子能力强于。(4)、在元素周期表中,溴()位于第4周期,与同主族。下列实验或事实能说明得电子能力强于的是(填字母)。
a.将通入溶液中可制得
b.常温常压下,为气态,为液态
c.约500℃开始分解,HCl约1000℃开始缓慢分解
15. 下表为元素周期表前三周期的一部分:X
R
Y
Z
W
(1)、基态Z原子的价电子排布式为。(2)、X与Y的简单氢化物中沸点较高的是(填化学式),原因是。(3)、选出X的基态原子的电子排布图(填“①”或“②”),另一电子排布图不能作为基态原子的电子排布图是因为它不符合(填标号)。①
 ②
②
A.能量最低原理 B.泡利原理 C.洪特规则
(4)、以上五种元素中,(填元素符号)元素第一电离能最大,与分子中键角较大的是(填分子式)。(5)、已知Z、W可形成分子 , 且Z、W原子均满足稳定结构,则的结构式为 , Z原子的杂化方式为。16. a、b、c、d、e、f是原子序数依次增大的非0族元素,位于元素周期表的前四周期。a的一种核素无中子,b的s能级电子数与p能级的电子数之比为4:3,c与e同主族,未成对电子数为2,d在同周期元素中的原子半径最大,f在同周期元素中的未成对电子数最多。请回答下列问题:(1)、上述元素中,位于元素周期表p区的元素有(填元素符号),其中基态c原子中电子占据的最高能级的原子轨道形状是。(2)、基态e原子的核外电子排布式为 , 其核外有种不同空间运动状态的电子。(3)、b、c、d、e的简单离子半径由大到小的顺序为(用离子符号表示),b、c、e元素中,第一电离能最大的元素为 , 原因为。(4)、基态f原子的未成对电子数与成对电子数之比为 , 下列属于f原子激发态电子排布式的有(填标号)
A. B. C. D.
17. 如图是部分短周期元素(用字母x等表示)化合价与原子序数的关系图。
根据判断出的元素回答问题:
(1)、h在周期表中的位置是。(2)、比较z、f、g、r常见离子的半径大小(用化学式表示,下同) ;比较r、m的最高价氧化物对应水化物的酸性强弱;比较d、m的氢化物的沸点;(3)、z的一种氢化物分子中既含非极性键又含极性键,其结构式为。(4)、由y、m和氢元素组成一种离子化合物,写出其电子式:。18. 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题: (1)、元素p是(填元素符号),元素p的基态原子电子排布式是:。(2)、cdef四种元素的第一电离能由小到大顺序为:。(3)、o、p两元素的部分电离能数据如下表:
(1)、元素p是(填元素符号),元素p的基态原子电子排布式是:。(2)、cdef四种元素的第一电离能由小到大顺序为:。(3)、o、p两元素的部分电离能数据如下表:电离能/kJ·mol-1
元素o
元素p
I1
717
759
I2
1509
1561
I3
3248
2957
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是。
(4)、下列各项叙述中,正确的是____。A、镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 B、价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素 C、所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 D、24Cr原子的电子排布式是1s22s22p63s23p63d44s219. 如图的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表.请在下面的虚线框中用实线画出周期表第一至第六周期的轮廓,并画出金属与非金属的分界线. 20. 短周期主族元素R、T、X、Y、Z原子序数依次增大,最外层电子数之和为22。R原子的最外层电子数是其内层电子数的2倍,T是地壳中含量最高的元素,与具有相同的电子层结构,Z与T同主族(1)、上述五种元素原子半径由大到小的顺序为(填元素符号)。(2)、T与X形成的化合物中含(填“离子”或“共价”)键;写出X和Z形成的简单化合物的电子式:。(3)、Z的气态简单氢化物的热稳定性比T的(填“强”或“弱”,下同);Z的最高价氧化物对应水化物的酸性比R的。(4)、某化学兴趣小组用如图装置探究元素R、Y的非金属性相对强弱:
20. 短周期主族元素R、T、X、Y、Z原子序数依次增大,最外层电子数之和为22。R原子的最外层电子数是其内层电子数的2倍,T是地壳中含量最高的元素,与具有相同的电子层结构,Z与T同主族(1)、上述五种元素原子半径由大到小的顺序为(填元素符号)。(2)、T与X形成的化合物中含(填“离子”或“共价”)键;写出X和Z形成的简单化合物的电子式:。(3)、Z的气态简单氢化物的热稳定性比T的(填“强”或“弱”,下同);Z的最高价氧化物对应水化物的酸性比R的。(4)、某化学兴趣小组用如图装置探究元素R、Y的非金属性相对强弱:
①写出仪器B的名称:。
②试管D中通入过量时发生反应的离子方程式为(已知酸性强弱:亚硫酸>碳酸)。
③装置E中酸性溶液需要足量的原因是。
④能说明元素R的非金属性比元素Y的非金属性强的实验现象为。
21. 有A、B、C、D、E、F六种主族元素,有关信息如下:①A、B同周期,其电离能数据如下表(单位:)
A
738
1451
7733
10540
B
578
1817
2745
11575
②短周期元素C原子的价层电子排布式为 , E的单质可在空气中燃烧。
③如图是元素周期表中主族元素的一部分。
C
D
E
F
试回答下列问题:
(1)、D在周期表的位置为。(2)、F原子的简化电子排布式为。(3)、E、F可以与氢形成化合物,该化合物中键能(填“>”“<”或“=”)。(4)、C元素基态原子核外最高能级的电子自旋状态(填“相同”或“相反”)。(5)、化合价是元素的一种性质,由A、B的电离能数据判断下列说法正确的是(填字母)。a.A通常显价,B通常显价
b.B元素的第一电离能较小,其活泼性比A的强
c.A、B的单质分别与盐酸反应放出等量氢气时,消耗单质的物质的量之比为3∶2
(6)、E的单质在空气中燃烧的产物是一种有毒气体,实验室经常用溶液进行处理,若所得溶液中只有一种溶质且能促进水的电离,该溶液中离子浓度的大小关系是。(7)、根据元素核外电子排布可以推知元素的性质。①被誉为“21世纪金属”的钛()元素,基态原子价层电子轨道表示式为 , 元素形成的化合物中,呈现的最高价态为价。
②日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素基态原子的价层电子排布式为 , 该元素的名称是。
22. 元素周期表反映元素之间的内在联系,是研究物质性质的重要工具。如表是元素周期表的一部分。请回答下列问题: (1)、画出④的原子结构示意图。(2)、①的单质在盛满⑧的单质的集气瓶中燃烧,反应现象为。(3)、③和④组成的一种物质中含有两种类型的化学键,该物质的电子式为。(4)、⑥的单质和④的最高价氧化物的水化物反应的化学方程式为。(5)、已知⑤的单质与②的最高价氧化物A在点燃条件下能反应生成黑色单质,推测④的单质(填“能不能”)与A反应,说明推测的理由。(6)、为比较⑦和⑧的非金属性,某小组同学设计实验进行探究。
(1)、画出④的原子结构示意图。(2)、①的单质在盛满⑧的单质的集气瓶中燃烧,反应现象为。(3)、③和④组成的一种物质中含有两种类型的化学键,该物质的电子式为。(4)、⑥的单质和④的最高价氧化物的水化物反应的化学方程式为。(5)、已知⑤的单质与②的最高价氧化物A在点燃条件下能反应生成黑色单质,推测④的单质(填“能不能”)与A反应,说明推测的理由。(6)、为比较⑦和⑧的非金属性,某小组同学设计实验进行探究。【理论依据】氧化性较强的单质能置换出氧化性较弱的单质
【实验方案】
实验操作
预测现象
取Na2S溶液于试管中,滴入少量新制氯水
_▲_
预测现象为。
【实验过程】
按照实验方案操作,观察到的现象与预测的一致,写出该反应的化学方程式。
【实验结论】
非金属性:⑦<⑧
23. 比较下列粒子的半径大小①Na Mg O F
②Na+ Mg2+ O2- F-
③ Na+ Mg2+ S2- Cl-
24. 比较钠、铝、氮的离子半径大小,并说明原因.25. 下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题: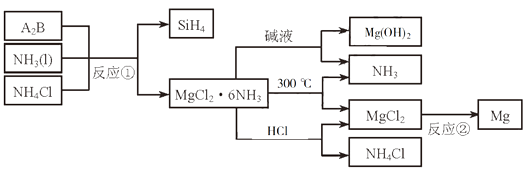 (1)、MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外): , Mg在元素周期表中的位置: , Mg(OH)2的电子式:。(2)、A2B的化学式为。反应②的必备条件是。上图中可以循环使用的物质有。(3)、在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料(写化学式)。(4)、为实现燃煤脱硫,向煤中加入浆状Mg(OH)2 , 使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:。(5)、用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
(1)、MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外): , Mg在元素周期表中的位置: , Mg(OH)2的电子式:。(2)、A2B的化学式为。反应②的必备条件是。上图中可以循环使用的物质有。(3)、在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料(写化学式)。(4)、为实现燃煤脱硫,向煤中加入浆状Mg(OH)2 , 使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:。(5)、用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下: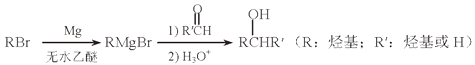
依据上述信息,写出制备
 所需醛的可能结构简式:。26. 下表为元素周期表的一部分,参照元素A~I在表中的位置,用化学用语回答下列问题:
所需醛的可能结构简式:。26. 下表为元素周期表的一部分,参照元素A~I在表中的位置,用化学用语回答下列问题:
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
一
A
二
B
C
D
三
E
F
G
H
I
四
K
(1)、D、E、H形成的简单离子的半径由大到小的顺序是。(2)、E2D2的电子式为: , GD2形成晶体的类型为:。(3)、将一定量HD2通入足量C的最高价氧化物的水化物稀溶液中,反应的离子方程式是。(4)、设计实验探究I、K两种元素非金属性的相对强弱。可选用的试剂有:氯水、NaBr溶液、AgNO3溶液、CCl4。
请完成实验报告单:
实验内容
现象
步骤一:试管1:取少量氯水;
试管2:取少量NaBr溶液,滴加少量氯水。
试管2中的现象是:
步骤二:分别向试管1、试管2中加少量(填试剂),振荡。
试管2中的现象是
①试管1的作用是。
试管2中反应的离子方程式为: , 此实验的结论是。
27. 下表是元素周期表的一部分,针对表中的①~⑧种元素,请按要求填写下列空白:主族周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
①
②
③
④
3
⑤
⑥
⑦
⑧
(1)、在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:;(2)、写出元素②的最简单氢化物的结构式;(3)、④⑤⑥⑦四种元素的简单离子半径从大到小排序(用离子符号表示);(4)、写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式;(5)、写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式;(6)、用电子式表示⑤与⑦组成化合物的形成过程。28. 表格是周期表中的一部分,根据A~I在周期表中的位置,用元素符号(化学式)或化学符号回答下列问题:主族
周期
I
II
III
IV
V
VI
VII
0
1
A
2
D
E
G
3
B
C
J
F
H
I
(1)、A~I中,化学性质最不活泼的元素基态原子的电子排布式是 , 写出E基态原子价层电子的轨道表示式。(2)、其单质能用于制漂白粉的元素是。(3)、在D,E,J中,原子半径最大的元素是。(4)、A分别与D、E、G形成的化合物中,最稳定的化合物的电子式是。(5)、表格中C的单质与NaOH溶液发生反应的化学方程式为。29. 四种短周期主族元素W、X、Y、Z的原子序数依次增大。W与Y同族,且Y的原子序数是W的2倍;X原子核外电子层数是其最外层电子数的3倍。回答下列问题:(1)、W在周期表中的位置为。(2)、W、X、Y的简单离子半径由大到小顺序为(填离子符号)。(3)、W、X形成的摩尔质量较小的化合物的电子式为。30. 请回答下列问题。随原子序数递增,x、y、z、……等八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如图所示:
 (1)、f的离子结构示意图为。(2)、将上述处在第三周期的元素的离子,按半径由小到大进行排列(填离子符号)。(3)、研究g、h非金属性强弱的方案中不可行的是____(填序号)。A、比较其简单氢化物稳定性 B、比较其单质与氢气反应的难易程度 C、比较其简单阴离子的还原性 D、比较其氧化物的水化物的酸性(4)、元素y在周期表中的位置为 , 对x、z组成的简单阳离子进行检验,反应的离子方程式是 , 现象是。(5)、f和z组成的化合物fz,被大量用于制造电子元件。工业上用f的氧化物、y单质和z单质在高温下制备fz,其中f的氧化物和y单质的物质的量之比为1∶3,则该反应的化学方程式为。
(1)、f的离子结构示意图为。(2)、将上述处在第三周期的元素的离子,按半径由小到大进行排列(填离子符号)。(3)、研究g、h非金属性强弱的方案中不可行的是____(填序号)。A、比较其简单氢化物稳定性 B、比较其单质与氢气反应的难易程度 C、比较其简单阴离子的还原性 D、比较其氧化物的水化物的酸性(4)、元素y在周期表中的位置为 , 对x、z组成的简单阳离子进行检验,反应的离子方程式是 , 现象是。(5)、f和z组成的化合物fz,被大量用于制造电子元件。工业上用f的氧化物、y单质和z单质在高温下制备fz,其中f的氧化物和y单质的物质的量之比为1∶3,则该反应的化学方程式为。