2023-2024学年高中化学必修第一册4.1原子结构与元素周期表(人教版)
试卷更新日期:2023-07-27 类型:同步测试
一、选择题
-
1. 据报道,上海某医院正在研究用放射性同位素治疗肿瘤。该同位素原子核外的电子数是( )A、125 B、72 C、53 D、1782. 硒是人体必需的微量元素,它能有效提高人体免疫机能,抑制癌症和心脑血管等疾病的发病率。下列有关说法正确的是 ( )A、硒元素位于元素周期表S区 B、硒的基态原子核外电子排布中共有7个能级 C、硒的氧化物只有一种 D、硒是第四周期第VIA族元素3. 下列有关原子核外电子排布的表达中错误的是( )A、的结构示意图:
 B、基态镁原子的核外电子排布的轨道表示式:
B、基态镁原子的核外电子排布的轨道表示式: C、基态铬原子的核外电子排布式:
D、基态的外围电子排布式:
4. 下列物质的名称或俗名对应的化学式正确的是( )A、熟石膏: B、过氧化钠: C、生石灰:CaO D、纯碱:NaOH5. 下列化学用语不正确的是A、Na+的结构示意图:
C、基态铬原子的核外电子排布式:
D、基态的外围电子排布式:
4. 下列物质的名称或俗名对应的化学式正确的是( )A、熟石膏: B、过氧化钠: C、生石灰:CaO D、纯碱:NaOH5. 下列化学用语不正确的是A、Na+的结构示意图: B、H2O的分子结构模型:
B、H2O的分子结构模型: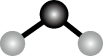 C、NaCl的电离方程式:NaCl=Na++Cl−
D、用电子式表示HCl的形成过程:
C、NaCl的电离方程式:NaCl=Na++Cl−
D、用电子式表示HCl的形成过程: 6. 化学在生产、生活和社会发展各方面发挥着关键性作用。下列叙述正确的是( )A、纯碱可用于治胃病 B、“静电除尘”、“燃煤固硫”和“汽车尾气净化”的措施均涉及化学变化 C、工人将模具干燥后再注入熔融钢水,是因为铁与水高温下会反应 D、太阳能电池的工作原理与原电池的相同7. 根据元素周期表和元素周期律,判断下列叙述不正确的是( )A、酸性比较:H2SO4>H3PO4 B、如图所示实验可证明元素的非金属性:Cl>C>Si
6. 化学在生产、生活和社会发展各方面发挥着关键性作用。下列叙述正确的是( )A、纯碱可用于治胃病 B、“静电除尘”、“燃煤固硫”和“汽车尾气净化”的措施均涉及化学变化 C、工人将模具干燥后再注入熔融钢水,是因为铁与水高温下会反应 D、太阳能电池的工作原理与原电池的相同7. 根据元素周期表和元素周期律,判断下列叙述不正确的是( )A、酸性比较:H2SO4>H3PO4 B、如图所示实验可证明元素的非金属性:Cl>C>Si
 C、氘、氚用作“人造太阳”核聚变燃料,不是化学变化
D、在元素周期表中的16个族中,第ⅢB的元素种类最多
C、氘、氚用作“人造太阳”核聚变燃料,不是化学变化
D、在元素周期表中的16个族中,第ⅢB的元素种类最多
二、多选题
-
8. X、Y均为短周期元素,两者组成化合物的化学式为X2Y3 , 已知X的原子序数为m,则Y的原子序数不可能是( )A、m+11 B、m+4 C、m﹣6 D、m﹣59. (多选)已知X、Y和Z三种元素的原子序数之和等于42。X元素基态原子的4p轨道上有3个未成对电子,Y元素基态原子的2p轨道上有2个未成对电子。X与Y可形成化合物X2Y3 , Z元素可以形成-1价离子,下列说法正确的是( )A、X元素原子基态时的核外电子排布式为[ Ar]4s24p3 B、X元素是第四周期第VA族元素 C、Y元素基态原子的核外电子排布式为1s22s22p2 D、Z元素是非金属元素10. 下列叙述中正确的是( )A、卤素单质与水反应均可用X2+H2O=HXO+HX表示 B、从F2到I2 , 卤素单质的颜色随着相对分子质量的增大而加深 C、熔、沸点:Li>Na>K D、还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠11. 中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝.关于 Lv的叙述错误的是( )A、原子序数116 B、中子数177 C、核外电子数116 D、质子数17712. 某元素原子结构示意图为
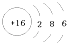 ,该原子( ) A、核电荷数为32 B、核外电子数为16 C、最外层电子数为6 D、核外电子层数为313. 向某溶液中通入气体后得到溶液 , 因通入的量不同,溶液的组成也不同,若向中逐滴加入盐酸,产生的气体体积与加入盐酸的体积的关系如图所示,则下列分析与判断错误的是(不计溶解)( )
,该原子( ) A、核电荷数为32 B、核外电子数为16 C、最外层电子数为6 D、核外电子层数为313. 向某溶液中通入气体后得到溶液 , 因通入的量不同,溶液的组成也不同,若向中逐滴加入盐酸,产生的气体体积与加入盐酸的体积的关系如图所示,则下列分析与判断错误的是(不计溶解)( ) A、若 , 则形成溶液所发生反应的离子方程式为 B、若 , 则溶液为溶液 C、若 , 则溶液中大量存在的阴离子为和 D、若 , 则溶液中14. 一种工业洗涤剂中间体结构式如图所示,其中短周期元素X、Y、Z、Q、W原子的半径依次增大,X和W同主族但不相邻,Y和Q最外层电子数之和是Z原子L层电子数的二倍,下列说法正确的是( )
A、若 , 则形成溶液所发生反应的离子方程式为 B、若 , 则溶液为溶液 C、若 , 则溶液中大量存在的阴离子为和 D、若 , 则溶液中14. 一种工业洗涤剂中间体结构式如图所示,其中短周期元素X、Y、Z、Q、W原子的半径依次增大,X和W同主族但不相邻,Y和Q最外层电子数之和是Z原子L层电子数的二倍,下列说法正确的是( ) A、X、Z、Q、W均可与Y形成二元化合物 B、简单离子半径:W>Z>Y C、Y的简单氢化物的稳定性和沸点都高于Z的简单氢化物 D、将W与O2反应后的固体放入水中,观察是否产生气体,即可判断氧化产物种类
A、X、Z、Q、W均可与Y形成二元化合物 B、简单离子半径:W>Z>Y C、Y的简单氢化物的稳定性和沸点都高于Z的简单氢化物 D、将W与O2反应后的固体放入水中,观察是否产生气体,即可判断氧化产物种类三、非选择题
-
15. 据报道,某些建筑材料会产生放射性同位素氡 Rn,从而对人体产生伤害,该同位素原子的质量数是 ,中子数是 。16. 电解普通水和重水(12H2O)的混合物,通电一段时间后,两级共生成气体18.5g,体积为33.6L(标况下).求所生成的气体中氕和氘的原子个数比是多少.
17. 填空。(1)、写出表示含有8个质子,10个中子的原子的化学符号:。(2)、根据下列微粒回答问题:。①以上6种微粒共有种核素,种元素。
②互为同位素的是。
③质量数相等的是 , 中子数相等的是。
(3)、相同物质的量的与的质量之比为;中子数之比为;电子数之比为。(4)、质量相同的和与足量钠反应,放出的气体在标准状况下的体积之比为。18. 下表为九种主族元素在周期表中的位置:
请回答下列问题:
(1)、写出表中的元素符号A、C、I 、G(2)、I元素的位置是第周期,第族。(3)、H的原子结构示意图为。(4)、B的单质与G的单质反应的化学方程式为。(5)、B与F在点燃条件下生成的物质颜色为。(6)、E、F分别与A组成含10个电子的分子的化学式为、。19. A、B、C、D、E是原子序数依次增大的前四周期元素。元素
原子结构(基态)等
A
宇宙中含量最多的元素
B
原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都低于同周期相邻元素
C
原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都高于同周期相邻元素
D
原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对
E
前四周期元素中未成对电子数最多
(1)、写出下列元素的元素符号:A;E。(2)、B元素在周期表中的位置为 , 属于周期表的区。(3)、E元素基态原子的电子排布式:。(4)、B,C,D三种元素的电负性:>>(填元素符号)。20. 短周期的元素在自然界中比较常见,尤其是非金属元素及其化合物在社会生活中有着很重要的作用。(1)、补全元素周期表中符号。C
N
O
F
Al
Si
S
Cl
表中元素形成的最稳定氢化物是 , 该氢化物在CCl4中的溶解度比在水中的溶解度(填“大”或“小”)。
(2)、硅原子核外电子运动状态为种,其最外层电子排布式为 , 硅微粒非常坚硬,比较晶体硅与碳化硅的熔点高低并解释说明。(3)、碳元素的非金属性比硫 , 可由一复分解反应推测而得,其反应的化学方程式为。(4)、烟气中的NO与尿素[CO(NH2)2](C的化合价为+4)反应进行脱硝。反应的化学方程式是:2CO(NH2)2+8NO=2CO2+6N2+O2+4H2O。该反应的氧化产物为 , 若反应过程中有2.24L(标准状况下)NO反应,则电子转移的数目为。21. 假定元素周期表是有限的,根据已知的元素周期表的某些事实和理论可归纳出一些假说。(1)、已知元素周期表中的各周期可排元素种类数如下:周期
1
2
3
4
5
6
7
元素种类数
2
8
8
18
18
32
32
人们预测元素周期表第八周期将来也会排满,那么该周期排满后的元素种类数是 。
A、18 B、32 C、50 D、无法判断(2)、根据周期表中每个周期非金属元素的种数(把稀有气体元素看作非金属元素),预测周期表中应该有种非金属元素,还有种未发现。未发现的非金属元素处于第周期第族。(3)、小明同学所在的化学探究小组,在查阅相关资料后归纳出元素周期表的另一种画法——三角形元素周期表。图上标有第ⅦA族和碳、钾两种元素的位置
回答下列问题:
①请在图中将过渡元素所在的位置涂黑。
②画出B元素外围电子排布图:
22. 稀有气体为什么不能形成双原子分子?23. 基态X原子的第二电子层上只有一个空轨道,则X是 , 其轨道表示式为 ;基态R原子的3p轨道上只有一个未成对电子,则R可能是 ;基态Y原子的核电荷数为33 ,其价电子排布式是 , 其在元素周期表中的位置是 , 属于区的元素。24. 根据要求回答:(1)、乙烯的电子式是。(2)、用一个化学方程式说明氯的非金属性比硫强。(3)、铁粉与水蒸气反应的化学方程式是。取上述反应后的固体适量,用一定浓度的盐酸溶解,滴加KSCN溶液,没有出现红色,说明该固体中没有+3价的铁。判断结论是否正确(填“是”或“否”),若不正确说明理由(若结论正确,本空不填)。25. 某兴趣小组的同学拟采用以下装置制备氯气并进行一系列相关探究实验的装置。请回答下列问题: (1)、装置A中a仪器的名称: , 用装置A制氯气所发生反应的离子方程式为 , 反应中氧化剂与还原剂的物质的量之比为。(2)、装置C的实验目的是验证氯气是否具有漂白性,为此装置C中I、II、III处依次放入(填字母)。
(1)、装置A中a仪器的名称: , 用装置A制氯气所发生反应的离子方程式为 , 反应中氧化剂与还原剂的物质的量之比为。(2)、装置C的实验目的是验证氯气是否具有漂白性,为此装置C中I、II、III处依次放入(填字母)。a
b
c
d
I
干燥的有色布条
干燥的有色布条
湿润的有色布条
湿润的有色布条
II
碱石灰
硅胶
浓硫酸
无水氯化钙
III
湿润的有色布条
湿润的有色布条
干燥的有色布条
干燥的有色布条
(3)、设计装置D、E的目的是比较氯、溴、碘的非金属性。实验过程:I.打开弹簧夹,打开a的活塞,滴加浓盐酸。
II.当D和F中的溶液都变为黄色时,夹紧弹簧夹。
III.当D中溶液由黄色变为红棕色时,关闭a的活塞。
IV.打开活塞b,将少量F中溶液滴入E中,关闭活塞b,取下E振荡,静置后CCl4层变为紫红色
①过程IV的现象能证明溴的氧化性强于碘,反应的离子方程式是。
②过程III实验的目的是。
③氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 , 得电子能力逐渐减弱。
26.(1)、碱金属元素原子最外层的电子都是个,在化学反应中它们容易失去个电子;卤族原子最外层的电子都是个,在化学反应中它们得到个电子。(2)、①钠有多种化合物,其中俗称“纯碱”的是(填“”或“”)②铁有多种氧化物,其中为黑色且具有磁性的是(填“”或“”)。
③日常生活中,活泼的铝在空气中能稳定存在的原因是表层的铝在空气中反应生成了[填“”或“”],保护内层金属。
27. 如图中的①、②是氟元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图。
请回答:
(1)、氟元素的相对原子质量为 , 钙元素的原子序数为 , D中的X为 , 写出①②两种元素形成的化合物的化学式为。(2)、①②两种元素最本质的区别是(填选项)a.质子数不同 b.中子数不同 c.相对原子质量不同
(3)、A,B,C,D结构示意图中,属于同种元素的粒子是(填字母)。(4)、A粒子的化学性质与B,C,D中哪一种粒子的化学性质相似(填字母)。28. 完成下列填空。(1)、某元素气态氢化物溶于水后溶液显碱性,其元素符号为;其轨道表示式为。(2)、B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 , C+的结构示意图为。(3)、某元素的原子最外层电子排布式为nsnnpn+2 , 则n=;该元素符号为。(4)、某元素的正三价离子的3d能级为半充满,D的元素符号为 , 其基态原子的电子排布式为。(5)、某元素基态原子的M层全充满,N层没有成对电子且只有一个未成对电子,其元素符号为 , 该元素分布在区。29. 某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2 . 该同学取一定量Na2O2样品与过量水反应,待完全反应后,得到溶液X和一定量O2 , 该同学推测反应中可能生成了H2O2 , 并进行实验探究.(1)、写出Na2O2与水反应的化学方程式 .(2)、试设计实验证明溶液X中含过氧化氢 .(3)、通过上述实验证明溶液中确实存在H2O2 . 取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式: H2O2+Fe2++OH﹣﹣﹣ Fe(OH)3↓,该反应中H2O2表现了性(填“氧化”或“还原”).(4)、已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,此时H2O2表现了性(填“氧化”或“还原”).30. 下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物.B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色.
请回答下列问题:
(1)、A是 .(2)、反应①~⑤中,属于氧化还原反应的是填序号).(3)、反应⑤的化学方程式为;甲与B反应的离子方程式为 .(4)、在空气中将C溶液滴入F溶液中,观察到的现象是 .31. X、Y、Z、R、W为原子序数依次增大的五种短周期元素。X原子最外层电子数是次外层的3倍;Y是短周期元素中金属性最强的元素;Z是生活中的常见金属,其氧化物常做耐高温材料;R最高正价与最低负价代数和为4;W的单质常用于漂白工业。回答下列问题:(1)、R元素的名称为: , W在周期表中的位置为:。(2)、已知W与Z单质化合得到的化合物甲在熔融状态下不能导电,但在水中能导电,由此可以判断甲属于化合物(选填:“离子”或“共价”),属于(选填:“电解质”或“非电解质”)(3)、工业上常用Z单质与氨气在1700℃发生置换反应,生成一种最轻的气体和一种原子个数比为1∶1的坚硬耐磨的化合物,试写出该反应的化学方程式。(4)、化合物乙由元素X、Y组成,乙能与水剧烈反应,并产生大量气泡,与反应产生氧气,乙可用做呼吸面具、潜水艇、太空舱等的供氧剂,且具有强氧化性,写出乙与反应的化学方程式。(5)、为比较元素X和R的非金属性强弱,下列方法不可行的是。a.比较这两种元素的单质与氢气化合的难易
b.比较这两种元素的气态氢化物的稳定性
c.比较这两种元素最高价含氧酸的酸性强弱
d.比较这两种元素氢化物水溶液的酸性强弱
32. 下表是元素周期表的一部分,按要求回答下列问题:族周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
1
①
2
②
③
④
⑤
3
⑥
⑦
⑧
⑨
(1)、⑦的原子结构示意图为 , ⑨的单质的电子式为。(2)、②③④三种元素对应的简单氢化物中最稳定的是(填化学式,下同)。上述九种元素中,最高价氧化物的水化物酸性最强的化合物的化学式是。(3)、③、④、⑥、⑦的简单离子半径由大到小的顺序是(用离子符号表示)。(4)、根据“对角线规则”,Be与Al具有相似的化学性质,请写出与⑥的最高价氧化物的水化物反应的化学方程式。(生成的盐中阴阳离子个数比为1∶2)。33. 按要求回答下列问题:(1)、研究发现,在低压合成甲醇反应()中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布式为。在上述反应中,非金属元素的电负性最大的是 , 在周期表中Mn属于区元素。(2)、我国科学家成功合成了世界上首个五氮阴离子盐。①氮原子的价电子轨道表示式为。
②元素的基态气志原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能()。第二周期部分元素的变化趋势如图所示。氮元素的()呈现异常的原因是。
 (3)、已知As元素的相关信息如图所示,下列说法错误的是____。
(3)、已知As元素的相关信息如图所示,下列说法错误的是____。 A、推测As能形成多种氧化物 B、热稳定性:、、HCl逐渐增强 C、As的一种核素表示为,中子数为40 D、原子半径由大到小的顺序:As、Cl、Si
A、推测As能形成多种氧化物 B、热稳定性:、、HCl逐渐增强 C、As的一种核素表示为,中子数为40 D、原子半径由大到小的顺序:As、Cl、Si