2023-2024学年高中化学必修第一册实验活动1 配制一定物质的量浓度的溶液(人教版)
试卷更新日期:2023-07-26 类型:同步测试
一、选择题
-
1. 室温下,甲同学配制5%的溶液100g,乙同学配制的溶液100mL(的溶解度为水),下列说法正确的是A、所需溶质的质量相同 B、所需仪器均包括100mL容量瓶 C、所配溶液均为不饱和溶液 D、所配溶液质量相同2. 下列关于容量瓶使用方法的叙述中,正确的是( )
①使用容量瓶前检查是否漏水;
②在容量瓶中溶解固体溶质;
③溶液需冷却至室温方可注入容量瓶;
④尽可能将溶质全部转移到容量瓶中;
⑤加水定容时,不小心超过刻度线,用胶头滴管吸出多余液体
A、①②③ B、①③④ C、③④⑤ D、①④⑤3. 下列操作可能使所配Na2CO3溶液浓度偏大的是( )A、烧杯和玻璃棒未洗涤 B、称量前Na2CO3·10H2O固体已失去部分结晶水 C、加水时超过刻度线,用胶头滴管吸出多余的液体 D、上下颠倒摇匀后溶液液面低于刻度线,补充加水至刻度线4. 实验室用98%的浓硫酸配制的稀硫酸。下列说法错误的是( )A、应选用200mL容量瓶 B、可选用量筒量取浓硫酸 C、在烧杯中稀释浓硫酸 D、定容时应选用胶头滴管5. 实验室需要460mL0.20mol∙L-1Na2CO3溶液,某同学配制过程如图所示。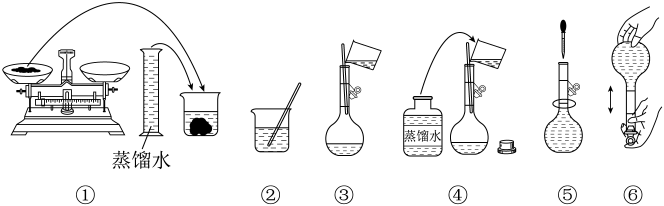
下列关于该实验的叙述错误的是
A、将药品放在称量纸上称取10.6gNa2CO3固体 B、Na2CO3固体在烧杯中完全溶解后,恢复至室温转移到容量瓶中定容 C、⑤中定容时俯视刻度线会导致溶液浓度偏低 D、容量瓶不宜长期贮存配制好的溶液6. 用18.4mol·L-1浓硫酸配制90mL 3mol·L-1的稀硫酸,下列说法错误的是A、应选用100mL容量瓶 B、可选用量筒量取浓硫酸 C、量取的浓硫酸直接倒入容量瓶中 D、定容时应选用胶头滴管7. 实验室欲配制100mL1.00mol/LNaCl溶液。下列操作及分析正确的是A、用托盘天平称量物体时将氯化钠置于右盘的滤纸上 B、将称好的NaCl固体放入容量瓶中溶解 C、定容时俯视,所得溶液浓度偏高 D、摇匀时发现漏液,损失一部分溶液,再加水定容至刻度线8. 有人提出溶液的浓度可用“质量摩尔浓度”(即一定质量的溶液中所含溶质的物质的量)表示。下列说法正确的是A、配制一定质量摩尔浓度的溶液时,必须用到容量瓶 B、将溶液的质量摩尔浓度换算为其质量分数时,必须已知该溶液的密度 C、对于一种稀溶液(密度按计),其质量摩尔浓度()与物质的量浓度()在数值上相等 D、分别取质量摩尔浓度相等的盐酸和NaOH溶液,等体积混合后一定恰好发生反应二、多选题
-
9. 用绿矾( )体配制一定物质的量浓度的 溶液,下列操作正确的是( )A、称量时,将绿矾固体放在纸片上,放在天平右盘上称量 B、将称量好的固体放入容量瓶中加蒸馏水溶解 C、定容时如果加水超过了刻度线,则需要重新配制 D、配制好的溶液应转移至指定的试剂瓶中10. 用胆矾配制0.1mol/L的硫酸铜溶液。下述方法中,最合理的是( )A、取25克胆矾溶于1000毫升水中 B、取25克胆矾加热使其失去全部结晶水,然后溶于1000毫升水中 C、称取25克胆矾溶于水,然后将此溶液稀释至1L D、将胆矾加热失去全部结晶水后,称取16克无水硫酸铜溶解于少量水,然后加水配成1000毫升溶液11. 图中是某硫酸试剂瓶标签上的部分内容。用该硫酸试剂配制50.0 mL 4.6 mol·L-1的稀硫酸,下列说法错误的是( )
硫酸化学纯(CP)
(500 mL)
化学式:H2SO4
相对分子质量:98
质量分数:98%
密度:1.84 g/mL
A、该硫酸试剂的物质的量浓度为18.4 mol·L-1 B、配制50.0 mL 4.6 mol·L-1的稀硫酸需取该硫酸12.5 mL C、配成的4.6 mol·L-1的稀硫酸中溶质的质量分数小于24.5% D、定容时俯视刻度线,所配稀硫酸的浓度会偏低12. 实验室需要配置100 mL 1.0×10-2 mol·L-1的CuSO4溶液,下列玻璃仪器中,一定要用到的有( )A、漏斗 B、玻璃棒 C、烧杯 D、容量瓶13. 配制100mL1mol/L的氢氧化钠溶液,下列操作错误的是( )A、在托盘天平上放两片大小相同的纸,然后将氢氧化钠放在纸上称取 B、把称得的氢氧化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,再把溶液转入容量瓶中 C、用蒸馏水洗涤烧杯、玻棒2~3次,洗涤液也移入容量瓶 D、沿着玻棒往容量瓶中加蒸馏水,直至溶液凹面的最低点与刻度相切14. 配制0.1mol•L﹣1NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是( )A、称量时,左盘低,右盘高 B、定容时俯视读取刻度 C、原容量瓶洗净后未干燥 D、定容时液面超过了刻度线15. 用容量瓶配制一定物质的量浓度的溶液,下列操作会使配制的NaOH溶液浓度偏低的是( )A、称量12.5g固体NaOH时,将砝码放在左盘上,NaOH放在右盘上 B、选用的容量瓶中有少量蒸馏水 C、定容时俯视刻度线 D、定容摇匀后,液面下降,又加水至刻度线三、非选择题
-
16. 水体的化学需氧量(COD)能反映水体受还原性物质污染的程度。某小组用高锰酸钾法测定学校周边河水的COD值。请回答下列问题:
I.配制200mL2.00×10-3mol•L-1的KMnO4溶液
(1)、计算、称量:需用分析天平称量gKMnO4固体(保留到小数点后四位)。(2)、选择仪器:需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、。(3)、称量后,以下操作步骤的顺序为。
定容的操作是:将蒸馏水注入容量瓶,当 , 改用胶头滴管加水至溶液凹液面最底端与刻度线相切。
(4)、下列操作会使KMnO4溶液浓度偏低的是。①转移溶液前,容量瓶底部有水
②转移溶液时,溶液不慎洒到容量瓶外
③定容时,仰视刻度线
④摇匀后,液面低于刻度线,不再加水
(5)、配制KMnO4溶液后用稀硫酸酸化,说明不用盐酸酸化的原因。(6)、II.KMnO4法测定河水的COD值测定原理为:4KMnO4+5C+6H2SO4=4MnSO4+2K2SO4+5CO2↑+6H2O
其中C代替水中还原性物质,根据消耗KMnO4溶液的体积计算水样中还原性物质的浓度,进而计算水样的COD值[COD=c(C)×M(O2)]。
取水样25.00mL于锥形瓶中,加入稀硫酸,消耗所配制的KMnO4溶液的体积为12.50mL(三次实验平均值),计算该水样是否符合国家一级A出水标准。(写出计算过程,国家一级A出水标准为COD≤50mg•L-1)
17. 用10mol/L的浓盐酸配制成1mol/L的稀盐酸220mL。试回答下列问题:(1)、配制稀盐酸时,可供选择的仪器有①托盘天平②玻璃棒③药匙④烧杯⑤胶头滴管,其中还缺少的仪器有:。(2)、经计算需要mL浓盐酸(保留一位小数)。用量筒量取浓盐酸时,假若仰视读数,则浓盐酸的实际体积(选填“大于”、“小于”、“等于”)计算值。(3)、在量取浓盐酸后,进行了下列操作:①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)。
(4)、若实验过程遇到下列情况,使盐酸的物质的量浓度偏高的是__________。A、用来稀释浓盐酸的烧杯未洗涤; B、未经冷却将溶液注入容量瓶中; C、摇匀后发现液面下降再加水; D、定容时俯视观察液面。18. 下面是用18mol/L的浓H2SO4稀释配制成500mL1mol/L的稀H2SO4的操作,请按要求填空:(1)、所需浓H2SO4的体积为。(2)、如果实验室有15mL、20mL、50mL的量筒,应选用mL量筒最好。(3)、将上述溶液沿玻璃棒转移到中,并用蒸馏水洗涤烧杯2~3次,并将洗涤液也转移到该仪器中,并摇匀。(4)、加水至距刻度1~2cm处时,改用加水,使溶液的凹液面正好跟刻度相平。(5)、分析下列操作对所配溶液的浓度的影响(填“偏高”、“偏低”、“无影响”)。用量筒量取时,发现量筒不干净,用水洗净后直接量取浓硫酸。浓度。19. 共和国勋章获得者钟南山院士强调,要注意疫情防控常态化,坚持做好日常消毒工作。含氯消毒剂在卫生防疫方面起着重要的作用。常见的含氯消毒剂有漂白粉、84消毒液等。(1)、漂白粉和84消毒液具有杀菌消毒功能,主要是因为两者均含有(填离子符号)。(2)、已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。回答下列问题:84消毒液
有效成分:NaClO
规格:1000mL
质量分数:25%
密度:1.19g/cm3
该“84消毒液”的物质的量浓度约为(计算结果保留两位有效数字)。
(3)、“84消毒液”与“洁则灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的气体,造成中毒事件,写出反应的离子反应方程式(4)、实验室用的浓盐酸配制的盐酸240mL,应量取浓盐酸的体积为mL(5)、配制该盐酸溶液一般可分为以下几个步骤:①量取②计算③溶解(冷却)④摇匀⑤转移溶液(包括洗涤)⑥定容⑦注入试剂瓶贴标签。其正确的操作顺序是(6)、下列操作使配制的溶液的物质的量浓度偏高的是①用量筒量取浓盐酸时,俯视刻度线
②用量筒量取浓盐酸后,用蒸馏水洗涤量筒后的溶液转入容量瓶中
③没有将洗涤烧杯和玻璃棒的溶液转入容量瓶中
④定容读数时,俯视容量瓶的刻度线
⑤未冷却就转移定容
20. 在某次实验中,要用 420mL 0.52 mol·L-1的NaOH 溶液,回答下列问题:(1)、实际配制时,应用托盘天平称取NaOH固体g;(2)、欲配制该0.52 mol·L-1的NaOH溶液时需用的主要仪器有托盘天平(附砝码、镊子)、药匙、量筒、烧杯、胶头滴管、玻璃棒和;(3)、下列操作对所配浓度有何影响(填写字母)?偏大的有;A.称量时用了生锈的砝码;
B.将NaOH放在纸张上称量;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中(假设:溶液的热胀冷缩程度大于容器)
D.往容量瓶转移时,有少量液体溅出;
E.定容时俯视刻度线;
F.容量瓶未干燥即用来配制溶液;
G.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
21. 某兴趣小组配制氢氧化钡溶液(1)、现需配制950 mL0.1 mol•L-1氢氧化钡溶液,应称量氢氧化钡晶体质量为g[已知Ba(OH)2·8H2O的摩尔质量为315 g•mol-1];如图配制步骤中,按先后顺序排序为(用字母A~F填写)。





A
B
C
D
E
F
(2)、配制过程中,下列操作会导致所配溶液物质的量浓度偏小的是(填序号)。a.转移时有少量溶液洒出
b.转移后未用蒸馏水洗涤烧杯
c.定容时俯视刻度线
(3)、在两份浓度、体积均相同的Ba(OH)2溶液中,分别滴入浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
其中,曲线(填序号)代表滴入了NaHSO4溶液;从开始到b点总的离子方程式是。
22. 实验室需要配制溶液。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)、选择仪器。完成本实验所必需的仪器有:托盘天平(带砝码、最小砝码为5 g)、药匙、烧杯、胶头滴管、、以及等质量的两片同种纸片。(2)、计算。配制该溶液需称量晶体g。(3)、称量。①天平调平之后,应将天平的游码调至某个位置,请在图中用一根竖线标出游码左边缘所处的位置:

②称量过程中晶体应放于天平的(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
(4)、接下来溶液配制的基本步骤如下:
①将上述实验步骤A到F按实验过程先后顺序排列(不重复)。
②在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了。
③定容时向容量瓶中加水至液面接近刻度线处,改用加水,使溶液凹液面最低处与刻度线相切。
(5)、下列操作对溶液的物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)。①摇匀后发现液面低于刻度线再加水;
②容量瓶中原有少量蒸馏水;
③定容时俯视观察液面。
23. 小组同学用FeSO4•7H2O晶体和蒸馏水配制100mL0.5mol•L-1FeSO4溶液(pH为3.3),再进行性质探究实验。(1)、Ⅰ.配制溶液。用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和。
(2)、计算需要FeSO4•7H2O晶体的质量是g。(3)、下列情况中,会使所配溶液浓度不准确的是(填字母)。a.称量晶体后,加入盛有100mL水的烧杯中
b.转移时,洗涤烧杯和玻璃棒
c.定容时,眼睛俯视刻度线
d.定容时,发现液面高于刻度线,将多余溶液倒出
(4)、Ⅱ.性质探究。立即取出一定量配制好的溶液放入2个试管中,分别进行如下实验:
实验ⅰ:滴加氢氧化钠溶液,观察到产生白色沉淀,最后变为红褐色。
实验ⅱ:滴加高锰酸钾溶液,溶液褪色。
实验i中产生白色沉淀的离子方程式是 , 生成红褐色沉淀的化学方程式是。
(5)、实验ii中高锰酸钾将Fe2+转化为。(6)、Ⅲ.对异常现象的探究。配制好的溶液放置1h后,溶液变黄。24h后,产生黄褐色沉淀,测得上层清液pH为1.4。
取少量黄色溶液,(填操作和现象),证明黄色溶液中含有Fe3+。
(7)、取黄色溶液,加入铁粉振荡,溶液由黄色变为浅绿色,反应的离子方程式为。(8)、实验证实,溶液变黄是因为空气中的O2将Fe2+氧化,反应的离子方程式为。(9)、通过下列实验证实,黄褐色沉淀中含有SO。
①证实黄褐色沉淀中含有SO的证据是。
②洗涤黄褐色沉淀的目的是。
(10)、进一步实验证实黄褐色沉淀为Fe(OH)SO4。将反应的离子方程式补充完整:Fe3++_+_=Fe(OH)SO4↓+_。
24. 实验室用固体配制1001.00溶液,回答下列问题。(1)、计算需要固体的质量为g。[](2)、配制溶液时,必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒、。(3)、下列情况中,会使所配溶液浓度偏低的是(填字母)。a.烧杯不干燥 b.转移液体时,有少量液体洒出
25. 根据所学知识回答问题:(1)、某同学在实验室中配制100mLNaCl溶液。①需称量NaCl固体的质量是g。
②在配制溶液的过程中,需用到玻璃棒。玻璃棒在实验过程中的用途有。
(2)、下图表示NaCl在水中溶解过程的微观状态示意图。
①甲、乙、丙按发生的先后,正确的排列顺序为。
②图中的微粒“
 ”表示(填微粒符号),判断依据是。
”表示(填微粒符号),判断依据是。③下列说法正确的是(填序号)。
a.NaCl固体不导电,是由于固体中不存在离子
b.NaCl在外加电场的作用下发生电离
c.NaCl溶液能导电,是由于溶液中存在自由移动的离子
(3)、测定某NaCl溶液的浓度:取xmL待测NaCl溶液,逐滴滴入溶液,当恰好沉淀时,消耗溶液的体积是ymL。①上述过程发生反应的离子方程式为。
②待测液中。
26. 某小组配制100mL 1.0mol/L 溶液并进行实验。(1)、配制溶液
①实验中使用玻璃棒的目的是。
②下列操作会导致最后所配溶液实际浓度比要求小的是(填字母)
a.将烧杯中的溶液转移到容量瓶时不慎酒到容量瓶外
b.加水时不慎超过了刻度线,把液体倒出一些
c.干净的容量瓶未经干燥就用于配制溶液
(2)、进行实验实验
现象

开始时红色没有明显变化,也没有明显气泡产生;
继续滴加盐酸,当溶液红色明显变浅时,气泡也逐渐增多;
当溶液颜色变为浅红色,继续滴加盐酸,溶液浅红色褪去,有大量气泡产生。
①实现碳酸钠向碳酸氢钠转化的现象是 , 大量气泡产生时的离子方程式是。
②利用可以实现碳酸钠向碳酸氢钠的转化,化学方程式是。
27. 实验室需用500 mL 0.1 mol/L NaOH溶液,现用NaOH固体配制该溶液。请回答下列问题:(1)、配制时需要使用的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、。(2)、用托盘天平准确称取g NaOH固体。(3)、配制溶液时,有以下操作步骤:①将容量瓶盖紧,振荡摇匀
②用托盘天平准确称量所需的NaOH,放入烧杯中,再加入适量水,用玻璃棒慢慢搅拌,使其溶解
③用适量水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶中并摇匀
④改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
⑤将已冷却的溶液沿玻璃棒注入容量瓶中
⑥继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
这些操作步骤的正确顺序为____(填序号)
A、②⑤③⑥④① B、②⑤③④⑥① C、②⑤③①⑥④(4)、定容时的操作正确,将容量瓶的玻璃塞盖紧,颠倒摇匀后发现溶液的液面稍低于刻度线,其原因可能是;取出10 mL该NaOH溶液稀释至20 mL,稀释后的NaOH溶液的物质的量浓度为mol/L。(5)、下列操作会造成所配溶液的浓度偏高的是(填序号)。①定容时俯视刻度线
②称量固体时所用的砝码生锈
③溶解NaOH的烧杯未洗涤
④溶解时有溶液溅出烧杯
28. 实验小组同学需要配制溶液。方法如下: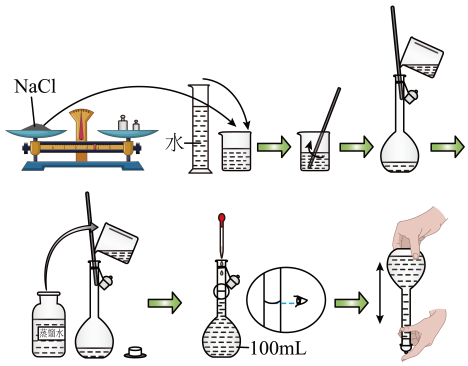 (1)、需要称取的质量为g。(2)、为完成实验,必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒和。(3)、在转移溶液时,玻璃棒的作用是。(4)、配制过程中,下列操作会导致所配溶液物质的量浓度偏小的是____(填字母)。A、配制溶液所用的容量瓶洗净后没有烘干 B、转移溶液后,未洗涤烧杯和玻璃棒就直接定容 C、摇匀后,发现溶液的凹液面低于刻度线,又滴加几滴蒸馏水29. 实验室需要配制0.50 NaCl溶液480mL。按下列操作步骤填写适当的文字或数据,以使整个操作完整。
(1)、需要称取的质量为g。(2)、为完成实验,必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒和。(3)、在转移溶液时,玻璃棒的作用是。(4)、配制过程中,下列操作会导致所配溶液物质的量浓度偏小的是____(填字母)。A、配制溶液所用的容量瓶洗净后没有烘干 B、转移溶液后,未洗涤烧杯和玻璃棒就直接定容 C、摇匀后,发现溶液的凹液面低于刻度线,又滴加几滴蒸馏水29. 实验室需要配制0.50 NaCl溶液480mL。按下列操作步骤填写适当的文字或数据,以使整个操作完整。a.选择仪器。
完成本实验所必须用到的仪器有托盘天平(带砝码,最小砝码为5g)、药匙、烧杯、、玻璃棒、胶头滴管以及等质量的两片滤纸。
b.计算。
配制该溶液需取NaCl晶体g。
c.称量。将药品倒入烧杯中。
d.溶解、冷却。
该步实验中需要使用玻璃棒,其目的是。
e.转移、洗涤。
在转移时应使用玻璃棒引流,需要洗涤烧杯和玻璃棒2~3次,目的是。
f.振荡。轻轻摇动容量瓶,使溶液混合均匀。
g.定容。
将蒸馏水注入容量瓶至液面接近刻度线处,改用滴加,使溶液凹液面与刻度线相切
h.摇匀、装瓶
i.实验过程中的以下操作会导致最终所配溶液的浓度 (填“偏高”“偏低”或“无影响”):
实验操作
最终所配溶液的浓度
向容量瓶中移液时少量溅出
定容时俯视刻度线
定容摇匀后液面下隆再加水
未等溶液冷却就定容
30. 用固体配制100mL1.00mol/L溶液。(1)、计算需要固体的质量为g。(2)、配制溶液时,正确的实验操作顺序是。a.将称好的固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使固体全部溶解并冷却至室温。
b.根据计算结果,称量固体。
c.将配制好的溶液倒入试剂瓶中,并贴好标签。
d.将烧杯中的溶液沿玻璃棒注入100L容量瓶,并用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
e.将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1~2cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠倒,摇匀。
31. 高锰酸钾溶液常用于物质的定性检验与定量分析。(1)、实验室里欲用KMnO4固体来配制250.00 mL 0.1000 mol•L-1的KMnO4酸性溶液。①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、、 。
②下列关于“容量瓶及其使用”的叙述中正确是 (填序号)。
A.使用前必须检查是否漏水 B.能配制一定体积准确浓度的标准溶液
C.可用来长期贮存溶液 D.能用作溶解固体、稀释浓溶液的容器
③下列操作对实验结果的影响偏高的是(填序号)。
A.加水定容时俯视刻度线
B.未洗涤溶解后的烧杯和玻璃棒
C.颠倒摇匀后发现凹液面低于刻度线,没有加水补到刻度线
D.未经冷却趁热将溶液注入容量瓶中并进行定容
(2)、用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。原理如下:FeSO4 + KMnO4 + H2SO4 — K2SO4 + MnSO4 + Fe2(SO4)3 + H2O (未配平),实验时应测定的数据有:量取FeSO4溶液的体积和。该反应中还原剂与氧化剂的物质的量之比为。(3)、维生素C的水溶液能使高锰酸钾溶液褪色,根据这一原理,常用高锰酸钾测定蔬菜或水果中的维生素C的含量。上述实验原理体现了维生素C具有(填氧化性、还原性)。