2023-2024学年高中化学必修第一册2.3 物质的量(人教版)
试卷更新日期:2023-07-26 类型:同步测试
一、选择题
-
1. 下列实验操作中:①过滤;②取固体试剂;③蒸发;④取液体试剂;⑤溶解;⑥配制一定物质的量浓度的溶液。一定要用到玻璃棒的是( )A、①③④⑥ B、①②③④ C、①③⑤⑥ D、②③④⑤2. 下列说法正确的是A、的摩尔质量是16 B、摩尔是国际单位制中的一个基本物理量 C、25℃和101kPa时,气体摩尔体积大于 D、1mol固态物质的体积主要取决于粒子之间的距离3. 我县响水湖公园植被丰富,雨后空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”。O就是一种空气负离子,其摩尔质量为( )A、32 g B、33 g C、32 g·mol-1 D、33 g·mol-14. 下列叙述正确的是( )A、摩尔是国际单位制中的七个基本物理量之一 B、标准状况下,1 mol任何物质体积均约为22.4 L C、通常状况下,3.01×1023个SO2分子的质量为32 g D、同温同压下,相同体积的任何气体所含的原子数目相同5. 将agFe2O3、Al2O3样品溶解在过量的100mL0.05 mol∙L−1的盐酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,消耗NaOH溶液100mL,则NaOH溶液的浓度为A、0.1 mol∙L−1 B、0.2 mol∙L−1 C、0.05 mol∙L−1 D、无法计算6. 设为阿伏加德罗常数,下列说法正确的是( )A、1.0mol羟基中含有的电子数约为10 B、30gHCHO与混合物中含C原子数约为 C、0.1L1mol/L的乙醇溶液中含有的分子数约为0.1 D、2.3g中含有的C-H键数约为0.25
二、多选题
-
7. 配制100mL1.00mol·L-1NaOH溶液的操作步骤如下。下列说法错误的是( )A、用托盘天平称取NaOH的质量为4.00g B、将烧杯中NaOH溶液转移至容量瓶时需恢复至室温后进行 C、定容操作时俯视刻度线定容,NaOH的物质的量浓度偏大 D、定容后盖好瓶塞,反复上下颠倒,摇匀后正立容量瓶发现混合液面下降,需补充少量水至刻度线8. 下列对于“摩尔”的理解正确的是( )A、摩尔是国际科学界建议采用的一种物理量 B、摩尔是物质的量的单位,简称摩,符号为mol C、摩尔可以把物质的宏观数量与微观粒子的数量联系起来 D、国际上规定,12g碳﹣12原子所含有的碳原子数目的物质的量为1摩9. H3、O4、C60、N等已被发现,下列有关说法错误的是( )A、C60的摩尔质量为720g·mol-1 B、22.4LH3中含有H原子的数目为3NA C、等质量的O2与O4中所含的原子数相等 D、1molN中含有的电子数为36NA10. 同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是( )A、所占的体积由大到小的顺序是:H2>CH4>O2>SO2>CO2 B、所含的分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2 C、所含的原子数由多到少的顺序是:CH4>H2>O2>CO2>SO2 D、密度由大到小的顺序是:SO2>CO2>O2>CH4>H211. 用18.0mol/L的浓硫酸20mL和铜共热一段时间后,待反应混合物冷却,滤去多余的铜,将滤液加水定容到100mL,溶液中浓度为2.6mol/L,则下列说法错误的是( )A、反应后c(CuSO4)为2.6mol/L B、反应中消耗的硫酸为0.1mol C、溶解的铜的质量为6.4g D、生成的SO2在标准状况下的体积为2.24L12. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、1 L0.05 mol/LFeCl3溶液中所含的Fe3+的数目为0.05NA B、0.2 mol SO2和0.1 mol O2充分反应后,得到SO3的分子数为0.1NA C、100 mL0.1 mol/LHNO2溶液中所含的的数目小于0.01NA D、电解足量的CuSO4溶液,阴极增重12.8 g,外电路中通过电子的数目为0.4NA13. 是阿伏加德罗常数的值,下列说法正确的是( )A、16.25 g 水解形成的胶体粒子数为 B、等物质的量的和中含有阴离子数相等 C、100 g 46%的乙醇()水溶液中氧原子数目为 D、标准状况下11.2 L 溶于水,溶液中、、和HClO的微粒数之和为
三、非选择题
-
14. 某同学用 NaOH 固体配制 500 mL 0.40 mol/L 的 NaOH 溶液,请回答下列问题:(1)、配制该 NaOH 溶液需用电子天平(精确度 0.01g)称取 NaOH 固体g。(2)、配制时,其正确的操作顺序是(填序号,每个操作只用一次)。
①用少量蒸馏水洗涤烧杯内壁和玻璃棒 2-3 次,洗涤液均注入容量瓶,振荡
②在盛有 NaOH 固体的烧杯中加入适量水溶解
③将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
④将容量瓶盖紧,反复上下颠倒,摇匀
⑤改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
⑥继续往容量瓶内小心加水,直到液面接近刻度线 1-2cm 处
(3)、实际配制得到的溶液浓度偏低,可能的原因是 (填字母)。A、容量瓶用蒸馏水洗净后,未待干燥便用来配制 B、固体溶解后趁热移入容量瓶中 C、定容时,仰视刻度线 D、NaOH 固体已变质(4)、某同学需要 100mL0.1mol/L NaOH 溶液,需要取上述 NaOH 溶液mL,该稀溶液配置过程中还需要增加使用的仪器是。15. 某同学进行实验时需要溶液左右,但实验室只有的浓硫酸。该同学利用所给试剂配制所需溶液。(1)、该同学应用量筒量取的浓硫酸体积为(精确到),实验必须用到的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外,至少还需要的一种玻璃仪器是(2)、量取的浓硫酸需在烧杯中先稀释,稀释浓硫酸的操作是。(3)、配制过程中主要有以下操作:①定容 ②转移 ③量取 ④洗涤 ⑤稀释 ⑥摇匀
正确的操作顺序应是___________。
A、①②③④⑤⑥ B、③⑤②④①⑥ C、④⑤③②①⑥(4)、下列操作会引起所配溶液浓度偏高的有___________A、用量筒量取浓硫酸时,仰视量筒的刻度 B、容量瓶未干燥即用来配制溶液 C、浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容 D、烧杯中稀溶液往容量瓶转移时,有少量液体溅出16. 近年来,我国储氢碳管研究获得重大进展,电弧法合成碳纳米管,常伴有大量物质-碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:3C+2K2Cr2O7+8H2SO4(稀)=3CO2↑+3K2SO4+2Cr2(SO4)3+8H2O。请回答下列问题。(1)、下列物质中:①碳纳米颗粒②K2Cr2O7晶体③CO2④熔融K2SO4⑤Cr2(SO4)3溶液⑥H2O⑦稀硫酸。属于电解质是(填序号)。(2)、CO2的摩尔质量为。(3)、用单线桥法标出上述反应电子转移的方向和数目。(4)、标准状况下,由CO和CO2组成的混合气体为6.72L,质量为12g,则该混合气体的平均相对分子质量是。(5)、实验探究小组在实验中需要用到456mL1mol•L-1的H2SO4溶液,但是在实验室中只发现一瓶8mol•L-1的H2SO4溶液,该小组用8mol•L-1的H2SO4溶液配制所需溶液。①如图所示的仪器中配制溶液肯定不需要的是(填序号),配制上述溶液还需用到的玻璃仪器是(填仪器名称)。

②该实验中需要量取8mol•L-1的H2SO4溶液mL。
17. 化学基本概念是学习化学的基石,请正确回答下列问题。(1)、今有7种物质:①液态氯化氢 ②乙醇 ③熔融的KNO3 ④铜线 ⑤NaCl晶体 ⑥小苏打溶液 ⑦氨水。属于电解质的是 , 属于非电解质的是能导电的是 。
(2)、“四种基本反应类型与氧化还原反应的关系”如图所示:
其中I为化合反应,IV是反应。
(3)、我国古代四大发明之一的黑火药是由硫粉、硝酸钾和木炭按一定比例混合而成,爆炸时的反应为S+ 2KNO3 +3C=K2S+N2↑+3CO2↑,反应中被还原的物质是(填化学式)。(4)、NaH可在野外作生氢剂,反应原理为NaH+H2O=NaOH+ H2↑,该反应中氧化产物和还原产物的质量比为。(5)、15.6gNa2X含有0.2molX2- , 含有Na+的物质的量是 , Na2X的摩尔质量为。(6)、工业制备漂白粉原理是(用化学方程式表示)。18. 氯化钠与氯化镁的混合物中,氯离子的物质的量之比为1:2,求混合物中两种物质的质量之比。19. 摩尔是 的单位,1mol任何物质中所含有的粒子数约为 .1.5mol H2SO4的质量是 ,其中含有 mol O原子,含有 个 H原子.20. 请将下表填写完整:物质
物质的量
质量
分子或离子数目
SO2
2 mol
SO42-
6.02×1023
21. 瓦斯中甲烷与氧气的质量比为1:4时极易爆炸,此时甲烷与氧气的体积比为多少?22. 空气与我们的生存息息相关。SO2是主要的大气污染物之一,CO2是主要的温室气体。(1)、SO2属于酸性氧化物,下列物质中可以与其发生反应的是 。A、Na2O B、NaCl C、CO2 D、H2O(2)、双碱法脱硫过程如下图所示。
①Na2SO3的电离方程式是。
②下列反应中,能用同一离子方程式表示的是(填序号)。
A.Ca(OH)2溶液与稀CH3COOH B.NaOH和稀H2SO4
C.Ca(OH)2溶液与稀HNO3 D.NaOH和稀盐酸
③过程I的离子方程式是 。
④过程Ⅱ中反应的化学方程式是 。
⑤双碱法脱硫过程中,循环利用的物质是(填化学式)
(3)、我国科学家研发了一种室温下“可呼吸”的Na-CO2充电电池。电池的总反应为:3CO2+4Na=2Na2CO3+C。该电池消耗6.6gCO2时,消耗标准状况下CO2的体积是 L,其中含氧原子个(已知阿伏加德罗常数的数值为NA)
23. “84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶84消毒液,该消毒液通常稀释到100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如图信息:84消毒液
(有效成分)NaClO
(规格)1000 mL
(质量分数)25%
(密度)1.20g/cm3
回答下列问题:
(1)、该“84消毒液”NaClO物质的量浓度约为(保留1位小数)。(2)、工业上用Cl2与浓氢氧化钠溶液反应制取“84消毒液”,请写出反应的化学方程式:。(3)、该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL该种“84消毒液”。下列说法错误的是_______(填字母)。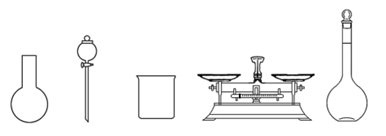 A、如图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器 B、使用前要检查容量瓶是否漏液 C、容量瓶上标有容积、温度和浓度 D、需要称量NaClO固体的质量为149.0 g E、容量瓶用蒸馏水洗净后,须烘干后再使用(4)、一瓶上述“84消毒液”理论上能吸收空气中L的CO2 (标准状况下)而变质。(已知:CO2+NaClO+H2O=NaHCO3+HClO)(5)、“84消毒液”与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因: , 某消毒小组人员用18mol·L-1的浓硫酸配制500mL3.6mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力,需取用浓硫酸的体积为mL。(6)、在配制过程中,下列操作中能使所配溶液的浓度偏高的有(填序号)。
A、如图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器 B、使用前要检查容量瓶是否漏液 C、容量瓶上标有容积、温度和浓度 D、需要称量NaClO固体的质量为149.0 g E、容量瓶用蒸馏水洗净后,须烘干后再使用(4)、一瓶上述“84消毒液”理论上能吸收空气中L的CO2 (标准状况下)而变质。(已知:CO2+NaClO+H2O=NaHCO3+HClO)(5)、“84消毒液”与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因: , 某消毒小组人员用18mol·L-1的浓硫酸配制500mL3.6mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力,需取用浓硫酸的体积为mL。(6)、在配制过程中,下列操作中能使所配溶液的浓度偏高的有(填序号)。①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水
24.(1)、一个铁原子的质量为m g, 设NA表示阿伏加德罗常数的值,则铁的摩尔质量为。(2)、标准状况下4.48LCO和CO2混合气,质量为7.2g。其中CO的体积分数为。
(3)、将饱和FeCl3溶液滴入沸水中,继续加热至液体变为色,得到的是Fe(OH)3胶体,区别Fe(OH)3胶体和饱和FeCl3溶液的方法是 , 将Fe(OH)3胶体装入U型管中,用石墨电极接通直流电,通电一段时间后,发现阴极区域附近的颜色加深,这说明 , 这种现象称为电泳。(4)、实验室将氯酸钾和二氧化锰固体混合物充分加热至不再产生气体,从所剩固体混合物中提取纯净的二氧化锰的操作依次为、、、。25. 现有1 L的 Al2(SO4)3溶液,含Al3+ 216 g,取250 mL溶液稀释到4 L,则稀释后溶液中的SO42-物质的量浓度是。26. 工业制取盐酸时,将标准状况下氢气与适量氯气恰好完全反应,再将反应生成的全部气体用水吸收,得到盐酸。请计算该工业制得盐酸的物质的量浓度。27. 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液"通常稀释100倍(体积之比)后使用。请回答下列问题:84消毒液
[有效成分] NaClO
[规格] 3.8L
[质量分数] 28%
[密度] 1.20g·cm-3
(1)、该“84消毒液”的物质的量浓度约为mol·L-1 (计算结果保留小数点后一位)。(2)、某同学取10mL该84消毒液稀释至1000mL,稀释后用于消毒,稀释后的溶液中n(Na+)=mol。(3)、“84消毒液”与“洁厕灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的气体,造成中毒事件。实验室用密度为1.25g·mL-1 , 质量分数36.5%的浓盐酸配制0.1mol·L-1的盐酸240mL。①配制240 mL 0.1 mol·L-1的盐酸应选用mL的容量瓶。
②下列操作对应所配溶液的浓度偏大的是。
A.定容时,俯视刻度线;
B.用量筒量取浓盐酸时,仰视刻度线;
C.定容摇匀后发现溶液凹面低于刻度线,加水至刻度线;
D.容量瓶在使用前未干燥,里面有少量蒸馏水。
③与洁厕灵(浓盐酸)不能混用的原因(用离子方程式表述):。
28. 某溶液中只含有Ba2+ Mg2+ Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示: (1)、沉淀1的化学式为 , 生成该沉淀的离子方程式为。(2)、若试剂B为Na2SO4溶液,则沉淀2化学式为。(3)、若试剂B为NaOH溶液,则生成沉淀2的离子方程式为。(4)、如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1 , 且溶液中含有的阴离子只有NO3- , 则溶液中NO3- 浓度为mol·L-1。
(1)、沉淀1的化学式为 , 生成该沉淀的离子方程式为。(2)、若试剂B为Na2SO4溶液,则沉淀2化学式为。(3)、若试剂B为NaOH溶液,则生成沉淀2的离子方程式为。(4)、如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1 , 且溶液中含有的阴离子只有NO3- , 则溶液中NO3- 浓度为mol·L-1。