2023-2024学年高中化学必修第一册2.2 氯及其化合物(人教版)
试卷更新日期:2023-07-26 类型:同步测试
一、选择题
-
1. 丰富多彩的颜色变化增添了化学的魅力。下列颜色变化过程中气体被氧化的是A、水蒸气使淡黄色过氧化钠变白色 B、H2通过灼热的氧化铜固体由黑色变为红色 C、白色的CuSO4粉末遇水蒸气变蓝 D、Cl2使湿润的淀粉碘化钾试纸变蓝2. 如图是实验室制备氯气并进行相关实验的装置(夹持与加热装置已省略),下列有关说法错误的是
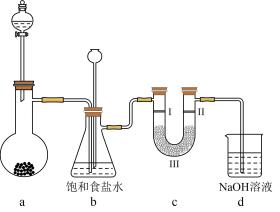 A、若无加热装置,则装置a蒸馏烧瓶中可用高锰酸钾或次氯酸钠 B、检验氯气是否有漂白性,则I、II、III分别为湿润的石蕊试纸、碱石灰、干燥的石蕊试纸 C、装置b的作用既可以洗气又可以作安全瓶监测装置c是否堵塞 D、含有4molHCl的浓盐酸与足量二氧化锰反应,产生标准状况下的Cl2体积小于22.4L3. 下列关于氯气的说法正确的是A、氯气在化学反应中能作还原剂 B、干燥的氯气不能使紫色石蕊溶液褪色 C、氯气是难溶于水的黄绿色气体 D、纯净的氢气在氯气中点燃一定发生爆炸4. 下列实验结论与实验操作及现象相符的一组是( )
A、若无加热装置,则装置a蒸馏烧瓶中可用高锰酸钾或次氯酸钠 B、检验氯气是否有漂白性,则I、II、III分别为湿润的石蕊试纸、碱石灰、干燥的石蕊试纸 C、装置b的作用既可以洗气又可以作安全瓶监测装置c是否堵塞 D、含有4molHCl的浓盐酸与足量二氧化锰反应,产生标准状况下的Cl2体积小于22.4L3. 下列关于氯气的说法正确的是A、氯气在化学反应中能作还原剂 B、干燥的氯气不能使紫色石蕊溶液褪色 C、氯气是难溶于水的黄绿色气体 D、纯净的氢气在氯气中点燃一定发生爆炸4. 下列实验结论与实验操作及现象相符的一组是( )选项
实验操作及现象
实验结论
A
将一小块金属钠加入至CuSO4溶液中,溶液蓝色褪去,有红色固体出现
钠比铜还原性强,钠置换出铜
B
向紫色石蕊溶液中加入新制氯水,溶液先变红,随后褪色
新制氯水中含有氧气分子
C
向淀粉-KI溶液中通入氯气,溶液变成蓝色
氧化性:Cl2>I2
D
向某溶液中加入AgNO3溶液,有白色沉淀生成
该溶液中一定含有Cl-
A、A B、B C、C D、D5. 将pH传感器、氯离子传感器、氧气传感器分别插入盛有氯水的广口瓶中,用强光照氯水,测得的实验数据如图所示。下列说法正确的是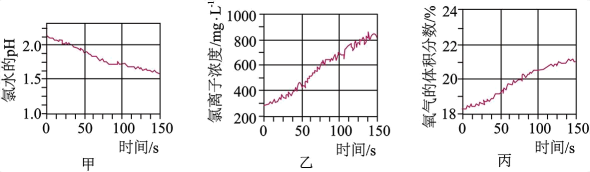 A、由图甲可推知新制氯水需避光保存,光照会使氯水的酸性增强 B、由图乙可推知新制的氯水中无氯离子,而久置的氯水中则含氯离子 C、由图丙可推知光照可催化水分解 D、由图甲、乙、丙可知新制的氯水所含成分少,而久置的氯水所含成分多6. 宏观辨识与微观探析是化学学科核心素养之一。下列反应方程式书写正确的是A、Fe在Cl2中燃烧:Fe+Cl2FeCl2 B、Cl2与FeCl2溶液反应:2Fe2++Cl2=2Fe3++2Cl- C、用AlCl3溶液和氨水制备Al(OH)3:Al3++3OH-=Al(OH)3↓ D、向NaHCO3溶液中加入Ba(OH)2溶液:HCO+OH-=CO+H2O7. 价-类二维图是一种重要的学习工具,氯的价-类二维图如图。下列说法错误的是
A、由图甲可推知新制氯水需避光保存,光照会使氯水的酸性增强 B、由图乙可推知新制的氯水中无氯离子,而久置的氯水中则含氯离子 C、由图丙可推知光照可催化水分解 D、由图甲、乙、丙可知新制的氯水所含成分少,而久置的氯水所含成分多6. 宏观辨识与微观探析是化学学科核心素养之一。下列反应方程式书写正确的是A、Fe在Cl2中燃烧:Fe+Cl2FeCl2 B、Cl2与FeCl2溶液反应:2Fe2++Cl2=2Fe3++2Cl- C、用AlCl3溶液和氨水制备Al(OH)3:Al3++3OH-=Al(OH)3↓ D、向NaHCO3溶液中加入Ba(OH)2溶液:HCO+OH-=CO+H2O7. 价-类二维图是一种重要的学习工具,氯的价-类二维图如图。下列说法错误的是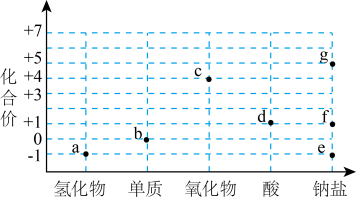 A、a→b需要加氧化剂 B、f→d可以加稀硫酸 C、b和烧碱反应可得e和f D、c不能用作自来水消毒剂8. “氯气对水一心一意,水偏弄成三分四离”,其中“三分四离”指的是新制氯水中的七种微粒。下列实验现象和结论不一致的是( )A、新制氯水使紫色石蕊溶液先变红后褪色,说明有和存在 B、向新制氯水中加入饱和溶液,有无色气体产生,说明有存在 C、氯水久置后黄绿色消失,且产生气泡,该气泡是从溶液中逸出的氧气分子 D、新制氯水中通入后黄绿色消失,说明有漂白性9. 下列有关物质的性质与用途具有对应关系的是A、钠具有还原性,液态钠可用作核反应堆的传热介质 B、具有漂白性,可在呼吸面具中作为氧气的来源 C、HClO具有弱酸性,可用作棉、麻和纸张的漂白剂 D、具有氧化性,可用于蚀刻铜电路板
A、a→b需要加氧化剂 B、f→d可以加稀硫酸 C、b和烧碱反应可得e和f D、c不能用作自来水消毒剂8. “氯气对水一心一意,水偏弄成三分四离”,其中“三分四离”指的是新制氯水中的七种微粒。下列实验现象和结论不一致的是( )A、新制氯水使紫色石蕊溶液先变红后褪色,说明有和存在 B、向新制氯水中加入饱和溶液,有无色气体产生,说明有存在 C、氯水久置后黄绿色消失,且产生气泡,该气泡是从溶液中逸出的氧气分子 D、新制氯水中通入后黄绿色消失,说明有漂白性9. 下列有关物质的性质与用途具有对应关系的是A、钠具有还原性,液态钠可用作核反应堆的传热介质 B、具有漂白性,可在呼吸面具中作为氧气的来源 C、HClO具有弱酸性,可用作棉、麻和纸张的漂白剂 D、具有氧化性,可用于蚀刻铜电路板二、多选题
-
10. 某兴趣小组利用数字化实验测定光照过程中氯水的pH、氯水中氯离子的浓度、广口瓶中氧气的体积分数三者的变化,实验结果如图所示。下列说法正确的是( )
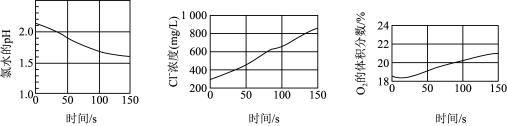 A、氯水中存在能自由移动的离子、能导电,故Cl2属于电解质 B、氯水中不存在H+ , 光照过程中才有H+生成 C、O2体积分数逐渐增加,说明发生了氧化还原反应 D、由图可知,50s时Cl-浓度约为0.45g/L,计算可知氯水中c(Cl-)0.013 mol·L-111. 氯气可用作自来水厂的消毒剂,但使用过程中要注意防泄漏。如图为自来水厂一种预防和处理泄漏的方法。下列有关说法错误的是( )
A、氯水中存在能自由移动的离子、能导电,故Cl2属于电解质 B、氯水中不存在H+ , 光照过程中才有H+生成 C、O2体积分数逐渐增加,说明发生了氧化还原反应 D、由图可知,50s时Cl-浓度约为0.45g/L,计算可知氯水中c(Cl-)0.013 mol·L-111. 氯气可用作自来水厂的消毒剂,但使用过程中要注意防泄漏。如图为自来水厂一种预防和处理泄漏的方法。下列有关说法错误的是( ) A、实验室用和浓盐酸反应制取氯气的离子方程式为 B、铁屑的作用是将还原为: C、吸收漏氯的离子方程式为 D、氯气与水反应的离子方程式为12. 某工厂,在山坡坑道的仓库里贮有氯气钢瓶。一天一只贮有氯气的钢瓶损坏,造成氯气泄漏,在场工人采取的措施正确的是( )A、把钢瓶推到坡下的小河里 B、把钢瓶扔到农田中 C、把钢瓶丢到深坑里,用石灰填埋 D、钢瓶处理后,工人应转移到坡上13. 氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是A、加入有色布条,一会儿有色布条褪色,说明有Cl2存在 B、溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在 C、先加入硝酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在 D、加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在14. 已知:新制氯水中存在、、HClO三种分子和、、、四种离子,利用数字化实验测定光照新制氯水的过程中各数据的变化,得到的图像如图。下列有关操作和说法正确的是( )
A、实验室用和浓盐酸反应制取氯气的离子方程式为 B、铁屑的作用是将还原为: C、吸收漏氯的离子方程式为 D、氯气与水反应的离子方程式为12. 某工厂,在山坡坑道的仓库里贮有氯气钢瓶。一天一只贮有氯气的钢瓶损坏,造成氯气泄漏,在场工人采取的措施正确的是( )A、把钢瓶推到坡下的小河里 B、把钢瓶扔到农田中 C、把钢瓶丢到深坑里,用石灰填埋 D、钢瓶处理后,工人应转移到坡上13. 氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是A、加入有色布条,一会儿有色布条褪色,说明有Cl2存在 B、溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在 C、先加入硝酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在 D、加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在14. 已知:新制氯水中存在、、HClO三种分子和、、、四种离子,利用数字化实验测定光照新制氯水的过程中各数据的变化,得到的图像如图。下列有关操作和说法正确的是( ) A、由图1可知,光照时有物质发生了分解,分解产物电离出了 B、由图2可知,光照会使氯水中溶解的逸出 C、由图3可知,光照时的溶解度增大,氯水酸性减弱 D、实验可观察到光照时氯水的颜色变浅15. 有列有关氯及其化合物说法中错误的是( )A、新制氯水可使蓝色石蕊试纸先变红后褪色 B、次氯酸具有强氧化性,能杀死水中的病菌,起到消毒的作用 C、氢气在氯气中燃烧,安静燃烧,发出苍白色火焰,瓶口有白烟 D、氯水久置后,漂白性和酸性均减弱16. 下列能使湿润的小红花褪色的物质是( )A、漂白粉粉末 B、氯水 C、氯酸钾溶液 D、氯化钙溶液17. 向盛有紫色石蕊溶液的试管中持续通入氯气至过量,溶液颜色可能出现无色、浅黄绿色、红色等变化。
A、由图1可知,光照时有物质发生了分解,分解产物电离出了 B、由图2可知,光照会使氯水中溶解的逸出 C、由图3可知,光照时的溶解度增大,氯水酸性减弱 D、实验可观察到光照时氯水的颜色变浅15. 有列有关氯及其化合物说法中错误的是( )A、新制氯水可使蓝色石蕊试纸先变红后褪色 B、次氯酸具有强氧化性,能杀死水中的病菌,起到消毒的作用 C、氢气在氯气中燃烧,安静燃烧,发出苍白色火焰,瓶口有白烟 D、氯水久置后,漂白性和酸性均减弱16. 下列能使湿润的小红花褪色的物质是( )A、漂白粉粉末 B、氯水 C、氯酸钾溶液 D、氯化钙溶液17. 向盛有紫色石蕊溶液的试管中持续通入氯气至过量,溶液颜色可能出现无色、浅黄绿色、红色等变化。
下列叙述正确的是( )
A、过程Ⅰ溶液由紫色变成红色,起作用的微粒是H+ B、过程Ⅱ溶液由红色变成无色,证明试管②溶液不再呈酸性 C、过程Ⅲ溶液颜色由无色变成浅黄绿色,证明溶液中有Cl2 D、若向紫色石蕊试液中持续加入Na2O2粉末,也会出现相同的颜色变化18. 下列有关物质性质实验的叙述,正确的是( )A、钠在空气中燃烧,生成淡黄色的氧化钠 B、钠是一种强还原剂,可以把钛从其盐溶液中置换出来 C、将灼热的铜丝放入盛有氯气的集气瓶中,生成棕黄色的烟 D、Fe(OH)3胶体具有吸附性,能吸附水中的悬浮颗粒并沉降,因而可用于净水三、非选择题
-
19. 某化学兴趣小组设计了如图装置,该装置能制取 Cl2 , 并进行相关性质实验,且可利用装置A 储存多余的氯气。
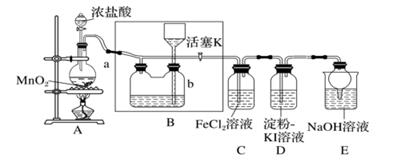 (1)、A 中发生反应的化学方程式为。(2)、储气瓶 b 可以收集氯气,则 B 内盛放的试剂是;装置 E 中球形干燥管的作用是。(3)、在装置 D 中能看到的实验现象是;此现象可推断氧化性:Cl2I2(填“>”或“<”)(4)、装置 C 中 Fe 2+ 被 Cl2氧化为 Fe 3+ ,反应的离子方程式为。20. 当你打开家里的自来水龙头时,会闻到一股刺鼻的气味,它是什么?请你试着给大家解释解释.21. 实验室制备氯气并进行相关实验的装置(加热及夹持装置均已略去)如图。
(1)、A 中发生反应的化学方程式为。(2)、储气瓶 b 可以收集氯气,则 B 内盛放的试剂是;装置 E 中球形干燥管的作用是。(3)、在装置 D 中能看到的实验现象是;此现象可推断氧化性:Cl2I2(填“>”或“<”)(4)、装置 C 中 Fe 2+ 被 Cl2氧化为 Fe 3+ ,反应的离子方程式为。20. 当你打开家里的自来水龙头时,会闻到一股刺鼻的气味,它是什么?请你试着给大家解释解释.21. 实验室制备氯气并进行相关实验的装置(加热及夹持装置均已略去)如图。
回答下列问题:
(1)、仪器a的名称为。(2)、该实验装置中有一处明显的错误,请指出具体的错误装置: , 判断的理由为。(3)、装置VI中,溶液的作用为。(4)、装置I中发生反应的化学方程式为。(5)、实验进行过程中,在装置V中(不考虑物质与水发生的反应):①可能观察到的现象为。
②发生反应的离子方程式为。
③由此可判断,氧化性:(填“>”、“<”或“=”)。
22. 如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。 (1)、装置C中盛装的溶液是 , D中试剂的作用是。(2)、E中的红色布条是否褪色?(填“是”或“否”),写出F中反应的化学反应方程式:。(3)、H中的试剂为 , 用来吸收多余氯气。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,该反应的化学方程式为。23. 化合物甲仅含两种元素。B为黄绿色气体,气体D能使湿润的红色石蕊试纸变蓝色。在一定条件下有如下转化关系:
(1)、装置C中盛装的溶液是 , D中试剂的作用是。(2)、E中的红色布条是否褪色?(填“是”或“否”),写出F中反应的化学反应方程式:。(3)、H中的试剂为 , 用来吸收多余氯气。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,该反应的化学方程式为。23. 化合物甲仅含两种元素。B为黄绿色气体,气体D能使湿润的红色石蕊试纸变蓝色。在一定条件下有如下转化关系:
请回答:
(1)、写出实验室制取气体B的化学方程式。(2)、将气体B通入紫色石蕊溶液中,观察到的现象是。气体B与水反应的离子方程式为。(3)、化合物甲中除了气体B所含元素还含有(请填写元素符号),甲的化学式为。(4)、甲与水反应的化学方程式为。24. 在氮的单质和化合物中,遇到HCl会产生白烟的是 ;与氢氧化钙加热发生反应产生刺激性气味气体的是 . (用字母填空)A、氮气B、氨气C、硝酸钠D、氯化铵.
25. 在第一次世界大战期间,有一次德军与英、法军在比利时对峙,黎明时,英、法军前线战壕的士兵突然看到一股黄绿色气体逐渐袭来,很快数百名英、法军战士窒息而死。后来人们在打扫战场时,发现跑到山坡上的士兵竟幸免于难。(1)、由上述事例可归纳出氯气的性质有(2)、写出下列反应的化学方程式。①铁丝在氯气中燃烧:
②铁粉溶于盐酸中:
(3)、将新鲜的花瓣放入干燥的氯气中可观察到的现象是原因是(4)、氯水久置或光照条件下均会变成稀盐酸,同时释放出氧气,说明次氯酸反应的化学方程式为26. 离子反应在物质分离、提纯、鉴定等方面有广泛的应用。实验室里需要纯净的氯化钠溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如图方案,请回答下列问题。
已知:操作①中发生的化学反应方程式为:;操作②和③中,试剂1是溶液,试剂2是溶液,且二者均过量。
(1)、写出在水溶液中的电离方程式:;(2)、加入试剂1发生时反应的离子方程式:;(3)、试剂2的目的是;(4)、如何检验NaCl溶液产品中的?27. 作为一种广谱型的消毒剂,将逐渐用来取代成为自来水的消毒剂。已知是一种易溶于水而难溶于有机溶剂的气体,实验室制备的原理是用亚氯酸钠固体与氯气反应:。下图是实验室用于制备和收集一定量较纯净的的装置(某些夹持装置和垫持用品省略)。其中E中盛有液体(用于除去中的未反应的)。
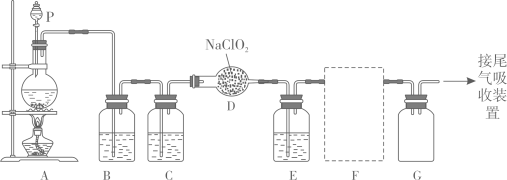 (1)、仪器P的名称是。(2)、写出装置A中烧瓶内发生反应的离子方程式:。(3)、G瓶的作用是。(4)、F为收集装置,应选用的装置是(填序号)
(1)、仪器P的名称是。(2)、写出装置A中烧瓶内发生反应的离子方程式:。(3)、G瓶的作用是。(4)、F为收集装置,应选用的装置是(填序号) (5)、若用的浓盐酸与足量的制备 , 则被氧化的的物质的量是___________(填序号)。A、 B、 C、 D、无法判断28. 84消毒液是北京某医院在1984年研制成功的一种高效含氯消毒液。该消毒液可由与溶液反应制得,其主要成分为、 , 是无色或淡黄色液体。人们主要利用84消毒液中的氧化性进行消毒。比要稳定的多,虽然也会分解,但它的水溶液在低温下存放三年才分解一半左右。(1)、84消毒液的有效成分是。(2)、84消毒液是由和两种物质组成的混合物。(3)、用与溶液制备84消毒液的反应属于氧化还原反应。(4)、很稳定,高温加热不分解。29. 按要求填空。(1)、现有下列物质:a.溶液 b.熔融的 c.固体 d.稀硫酸 e. 胶体 f. g.溶液
(5)、若用的浓盐酸与足量的制备 , 则被氧化的的物质的量是___________(填序号)。A、 B、 C、 D、无法判断28. 84消毒液是北京某医院在1984年研制成功的一种高效含氯消毒液。该消毒液可由与溶液反应制得,其主要成分为、 , 是无色或淡黄色液体。人们主要利用84消毒液中的氧化性进行消毒。比要稳定的多,虽然也会分解,但它的水溶液在低温下存放三年才分解一半左右。(1)、84消毒液的有效成分是。(2)、84消毒液是由和两种物质组成的混合物。(3)、用与溶液制备84消毒液的反应属于氧化还原反应。(4)、很稳定,高温加热不分解。29. 按要求填空。(1)、现有下列物质:a.溶液 b.熔融的 c.固体 d.稀硫酸 e. 胶体 f. g.溶液①其中能导电的电解质有(填字母)。
②区分a和e的实验方法是。
③实验宰中f通常保存在中。
④除去g中括号内杂质的试剂为(填化学式),反应的离子方程式为。
(2)、通过对下列实验过程的分析回答问题:①向石蕊溶液中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是、。
②将溶液与含的盐溶液混合,产生大量气体和沉淀。写出该反应的离子方程式:。
③某溶液中只含有、、、四种离子,已知前三种离子的个数比为 , 则溶液中和的离子个数比为。
30. 下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,C是常见的调味品,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。

回答下列问题:
(1)、A、D的化学式分别为、。(2)、写出反应②的化学方程式。反应中F体现的性质是(填编号)。①只有还原性 ②只有氧化性 ③既有还原性又有氧化性 ④不体现还原性和氧化性
(3)、A可用于自来水的杀菌消毒,请用离子方程式和简要的文字说明。工业上制备A和烧碱可以用电解饱和C溶液的方法,同时生成另一种气体,请写出化学方程式:。